Дофамин
| Дофамин | |||
|---|---|---|---|
| |||
| Общие | |||
| Систематическое наименование |
2-(3,4-дигидроксифенил)-этиламин | ||
| Хим. формула | C8H11NO2 | ||
| Физические свойства | |||
| Состояние | твёрдое, белое порошкообразное с характерным запахом | ||
| Молярная масса | 153,1784 ± 0,008 г/моль | ||
| Плотность | 1,26 г/см³ | ||
| Термические свойства | |||
| Температура | |||
| • плавления | 128 °C | ||
| Химические свойства | |||
| Константа диссоциации кислоты | 8,93 | ||
| Растворимость | |||
| • в воде | 60 г/100 мл воды | ||
| Классификация | |||
| Рег. номер CAS | 51-61-6 | ||
| PubChem | 681 | ||
| Рег. номер EINECS | 2 EC | ||
| SMILES | |||
| ChEBI | 18243 | ||
| Безопасность | |||
| ЛД50 | 1780 мг/кг (крысы, перорально)[1] | ||
| Токсичность | слабо токсичен, ирритант | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Дофами́н (допами́н, DA) — гормон и нейромедиатор. Синтезируется из L-ДОФА. В дальнейшем из дофамина может синтезироваться норадреналин. Дофамин используется как лекарственный препарат для внутривенных инъекций при сердечной недостаточности или кардиогенном шоке.
История
В 1911 году польский биохимик Казимеж Функ синтезировал продукт гидроксилирования тирозина аминокислоту L-Диоксифенилаланин, являющуюся предшественником дофамина. В 1938 году Петер Хольтц открыл фермент L-DOPA-декарбоксилазу, участвующую в метаболизме дофамина. В 1954 году канадские нейрофизиологи Джеймс Олдс и Питер Милнер обнаружили центр удовольствия в мозге и доказали, что химическим медиатором передачи сигнала является дофамин[2].
В 1957 году в процессе разработки лекарств от шизофрении и болезни Паркинсона шведский учёный Арвид Карлссон выявил роль дофамина как основного нейромедиатора центральной нервной системы. Однако его исследования не получили признания, поскольку считалось, что дофамин является только предшественником адреналина и норадреналина. Особый вклад в изучение эффектов дофамина внёс американский биохимик Пол Грингард, который начиная с 1960-х годов практически всю свою научную деятельность посвятил исследованиям эффектов дофамина[2].
В начале 1970-х годов стало известно, что дофамин, норадреналин и серотонин являются нейромедиаторами с медленным эффектом, способные осуществлять медленную синаптическую передачу, которая связана с такими сложными процессами в центральной нервной системе, как формирование эмоций и памяти. В своих работах Грингард показал, что медленные нейромедиаторы работают через метаботропные рецепторы и способны модулировать возбудимость нервных клеток и их реакции на эффекты быстрых нейромедиаторов, осуществляющих быструю синаптическую передачу и действующих через ионотропные рецепторы[2].
Позднее американский нейрофизиолог Эрик Кандел установил ключевые стадии формирования кратковременной и долговременной памяти на основе механизма медленной синаптической передачи. В 2000 году Карлссон, Грингард и Кандел получили Нобелевскую премию по физиологии и медицине за открытия, связанные с передачей сигналов в нервной системе[2].
- Основоположники Дофамина
Казимеж Функ (1884—1967)
Арвид Карлссон (1823—2018)
Пол Грингард (1925—2019)
Эрик Кандел (род. 1929)
Основные понятия
Дофамин является нейромедиатором и нейрогормоном из группы катехоламинов. Образуется в организме в результате ферментативного декарбоксилирования аминокислоты L-Диоксифенилаланина, продукта гидроксилирования тирозина. Промежуточный продукт биосинтеза дофамина, норадреналина, адреналина и меланинов, применяется как лекарственное средство леводопа — противопаркинсоническое средство; при паркинсонизме понижено содержание дофамина в базальных ганглиях мозга, для лечения этого заболевания целесообразно применение веществ, повышающих содержание дофамина в центральной нервной системы.[3] Дофамин не может быть использован для этой цели, так как он плохо проникает через гематоэнцефалический барьер. Диоксифенилаланин (дофа), который при пероральном введении всасывается, проникает в центральную нервную систему, подвергается декарбоксилированию, превращается в дофамин и, пополняя его запасы в базальных ганглиях, стимулирует дофаминовые рецепторы и обеспечивает при паркинсонизме лечебный эффект[4].
У беспозвоночных животных нейроны, использующие дофамин в качестве медиатора — дофаминергические нейроны могут быть представлены периферическими чувствительными образованиями или включаться в состав центральных ганглиев. У позвоночных дофамин в основном продуцируется нейронами, формирующими скопления в среднем мозге (чёрная субстанция), и секретируется как гормон особыми нейросекреторными клетками гипоталамуса. Дофамин участвует в обеспечении произвольной двигательной активности и регуляции эмоционального состояния; как гормон способен вызывать торможение секреции пролактина и соматотропного гормона (Гормон роста). При дефиците дофамина в подкорковых структурах мозга или отмирании нейронов чёрной субстанции у человека развивается паркинсонизм[5] — неврологический синдром, который характеризуется рядом симптомов: тремором, мышечной ригидностью (устойчивое повышение мышечного тонуса, равномерное сопротивление мышц во всех фазах пассивного движения, одинаково выраженное в сгибателях и разгибателях), постуральной неустойчивостью (неспособность удерживать равновесие, трудности ходьбы, падения) и брадикинезией (замедленный темп движений, трудность начальных движений, трудность поворотов)[6].
Дофамин оказывает своё действие через метаботропные рецепторы, вызывая образование большого числа вторичных посредников, которые могут долгое время сохраняться в межклеточном пространстве, чем обуславливают долгосрочный эффект этого нейромедиатора. Благодаря этому дофамин может модулировать возбудимость нейронов и «быструю» глутамат- и ГАМКергическую нейротрансмиссию. Поэтому дофамин вовлечён в такие сложные процессы нервной системы, как формирование памяти, настроения, мотивации и эмоций[5].
Цикл дофамина
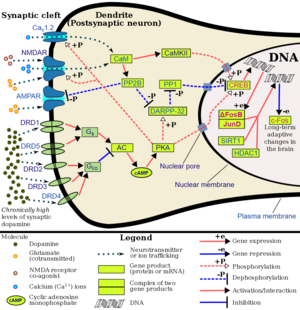
Предшественником катехоламинов, включая дофамин, является аминокислота L-тирозин. Фермент тирозингидроксилаза катализирует гидроксилирование тирозина до L-Диоксифенилаланина, затем фермент декарбоксилаза ароматических аминокислот декарбоксилирует L-Диоксифенилаланин до дофамина[5]. После синтеза дофамин упаковывается в пресинаптические везикулы и транспортируется к пресинаптическому окончанию аксона. Когда потенциал действия деполяризует пресинаптическую плазматическую мембрану, ион Ca2+ (ион кальция) проникает через кальциевые каналы внутрь пресинаптического нейрона (нервная клетка, которая посылает сигналы) и быстро запускает слияние мембран везикул (внеклеточные везикулы, которые отграничены от внешней среды липидным бислоем) с плазматической мембраной, благодаря чему нейромедиаторы высвобождаются и диффундируют через синаптическую щель для активации постсинаптических рецепторов. Кроме того, дофамин может выделяться из тел нейронов и дендритов и действовать на внесинаптические рецепторы. Такое явление называется объёмной передачей, когда нейромедиаторы диффундируют в ткани для активации относительно удалённых рецепторов и передачи сигналов[5].
Cвязывание дофамина со своими метаботропными рецепторами приводит к активации G-белка. Если рецептор связан с Gs-белком, то происходит активация аденилатциклазы и повышение содержания циклического аденозинмонофосфата в клетке. Циклический аденозинмонофосфат активирует протеинкиназу А, способную фосфорилировать белки, контролирующие возбудимость нервной клетки и обеспечивающие генерацию и передачу нервных импульсов нейроном. Если рецептор связан с Gi-белком, то происходят обратные процессы: дезактивация аденилатциклазы, снижение уровня циклического аденозинмонофосфата и дефосфорилирование белков. Для устранения непрерывного и избыточного влияния дофамина на клетки-мишени осуществляется его разрушение или обратный захват[5].
Разрушение дофамина может происходить с помощью О-метилирования (фермент — катехол-О-метилтрансфераза) либо с помощью окислительного дезаминирования (фермент — моноаминоксидаза) до дигидроксифенил-уксусной кислоты, которая далее может метилироваться до гомованилиновой кислоты. Обратный захват дофамина обеспечивает мембранный белок-транспортёр DAT, который перекачивает дофамин обратно в пресинаптический нейрон, где нейромедиатор вновь упаковывается в везикулы для дальнейшего использования[5].
Рецепторы
Дофаминовые рецепторы являются трансмембранными, связанными с G-белком; широко экспрессируются в организме и функционируют как в периферической, так и в центральной нервной системах. Постсинаптические дофаминовые рецепторы относятся к семейству GPCR. Существует по меньшей мере пять различных подтипов дофаминовых рецепторов — D1—5. Рецепторы D1 и D5 обладают довольно значительной гомологией и сопряжены с белком GS, который стимулирует аденилатциклазу, вследствие чего их обычно рассматривают совместно как D1-подобные рецепторы. Остальные рецепторы подсемейства подобны D2 и сопряжены с Gi-белком, который ингибирует аденилатциклазу, вследствие чего их объединяют под общим названием D-2-подобные рецепторы. Таким образом, дофаминовые рецепторы играют роль модуляторов долговременной потенциации. Участие во «внутреннем подкреплении» принимают D2 и D4 рецепторы. В больших концентрациях дофамин также стимулирует α- и β-адренорецепторы. Влияние на адренорецепторы связано не столько с прямой стимуляцией адренорецепторов, сколько со способностью дофамина высвобождать норадреналин из гранулярных пресинаптических депо, то есть оказывать непрямое адреномиметическое действие[7]. Дофаминовые рецепторы участвуют в процессах мотивации, обучения, тонкой моторной координации, модулирования нейроэндокринных сигналов. Этот класс включает пять типов рецепторов: D1, D2, D3, D4 и D5[8].
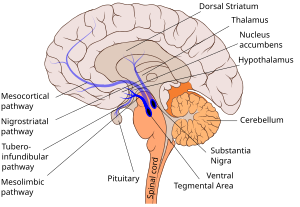
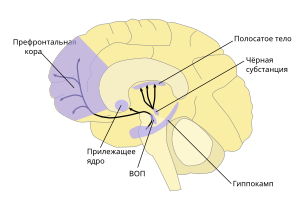
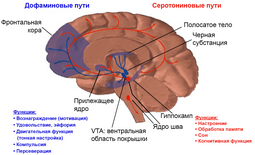
Дофаминергическая система
Как часть мезолимбического пути дофамин производится в телах нейронов, расположенных в вентральной области покрышки, и высвобождается в прилежащее ядро и префронтальную кору. Его моторные функции связаны с другим путём: производящие гормон клеточные тела расположены в чёрной субстанции, а высвобождение гормона происходит в полосатое тело Известно несколько дофаминовых ядер, расположенных в мозге. Это дугообразное ядро, дающее свои отростки в срединное возвышение гипоталамуса. Дофаминовые нейроны чёрной субстанции посылают аксоны в стриатум. Нейроны, находящиеся в области вентральной покрышки, дают проекции к лимбической системе и коре больших полушарий. Основными дофаминовыми путями являются:
- Мезокортикальный путь — один из основных дофаминовых нервных путей, связывающий вентральную область покрышки среднего мозга с лобной долей коры больших полушарий, преимущественно с префронтальной корой[9]. Этот путь важен для нормального когнитивного функционирования дорсолатерального префронтального кортекса. Считается, что мезокортикальный путь задействован в процессах мотивации и эмоциональной реакции. Участвует в формировании адекватного поведения, индивидуальных поведенческих программ и планов действий[10].
- Мезолимбический путь — один из дофаминергических нервных путей, связывающий вентральную область покрышки среднего мозга и чёрную субстанцию с различными структурами лимбической системы. Опосредованно проецируется также на лобную кору и гипоталамус[9]. Мезолимбический тракт играет существенную роль в механизмах памяти, эмоций, обучения и нейроэндокринной регуляции[9], он считается важным в продуцировании чувств удовольствия. Часто активируется при ощущении награды и желания, поскольку прилежащее ядро, к которому он ведёт, также связано с этими состояниями. Это обусловило внимание к данному пути нейробиологов, исследующих механизмы зависимости. Имеются также сведения об участии мезолимбического пути в контроле начала двигательного акта и двигательных аффективных реакций[11].
- Нигростриарный путь — один из трёх основных дофаминергических нервных путей мозга, соединяющий чёрную субстанцию (substantia nigra) и вентральную область покрышки среднего мозга со стриатумом. Участвует в инициации двигательной активности, являясь частью системы под названием моторная петля базальных ганглиев.
Нигростриарный путь является самым мощным в дофаминергической системе мозга; аксонами его нейронов выделяется около 80 % мозгового дофамина[9]. В экстрапирамидной системе дофамин играет роль стимулирующего нейромедиатора, способствующего повышению двигательной активности, уменьшению двигательной заторможенности и скованности, снижению гипертонуса мышц. Физиологическими антагонистами дофамина в экстрапирамидной системе являются ацетилхолин и ГАМК. При болезни Паркинсона в чёрной субстанции происходит потеря дофаминергических нейронов, что приводит к снижению активности данного нервного пути. Симптомы болезни проявляются лишь после угасания 80—90 % дофаминергической активности[9].
Гормон
Дофамин обладает рядом физиологических свойств, характерных для адренергических веществ. Дофамин вызывает повышение сопротивления периферических сосудов (менее сильное, чем под влиянием норадреналина). Он повышает систолическое артериальное давление в результате стимуляции α-адренорецепторов. Также дофамин увеличивает силу сердечных сокращений в результате стимуляции β-адренорецепторов. Увеличивается сердечный выброс. Частота сердечных сокращений увеличивается, но не так сильно, как под влиянием адреналина. Потребность миокарда в кислороде под влиянием дофамина повышается, однако в результате увеличения коронарного кровотока обеспечивается повышенная доставка кислорода[4].
В результате специфического связывания с дофаминовыми рецепторами почек дофамин уменьшает сопротивление почечных сосудов, увеличивает в них кровоток и почечную фильтрацию. Наряду с этим повышается натрийурез. Происходит также расширение мезентериальных сосудов. Этим действием на почечные и мезентериальные сосуды дофамин отличается от других катехоламинов (норадреналина, адреналина и др.). Однако в больших концентрациях дофамин может вызывать сужение почечных сосудов. Дофамин ингибирует также синтез альдостерона в коре надпочечников, понижает секрецию ренина почками, повышает секрецию простагландинов тканью почек[4].
Дофамин тормозит перистальтику желудка и кишечника, вызывает расслабление нижнего пищеводного сфинктера и усиливает желудочно-пищеводный и дуодено-желудочный рефлюкс. В ЦНС дофамин стимулирует хеморецепторы триггерной зоны и рвотного центра и тем самым принимает участие в осуществлении акта рвоты. Через гематоэнцефалический барьер дофамин мало проникает, и повышение уровня дофамина в плазме крови оказывает малое влияние на функции ЦНС, за исключением действия на находящиеся вне гематоэнцефалического барьера участки, такие как триггерная зона[4].
Повышение уровня дофамина в плазме крови происходит при шоке, травмах, ожогах, кровопотере, стрессовых состояниях, при различных болевых синдромах, тревоге, страхе. Дофамин играет роль в адаптации организма к стрессовым ситуациям, травмам, кровопотере. Также уровень дофамина в крови повышается при ухудшении кровоснабжения почек или при повышенном содержании ионов натрия, а также ангиотензина или альдостерона в плазме крови. По-видимому, это происходит вследствие повышения синтеза дофамина из ДОФА в ткани почек при их ишемии или при воздействии ангиотензина и альдостерона. Вероятно, этот физиологический механизм служит для коррекции ишемии почек и для противодействия гиперальдостеронемии и гипернатриемии[4].
Патологии
Наиболее известными патологиями, связанными с дофамином, являются шизофрения и паркинсонизм, а также обсессивно-компульсивное расстройство Паркинсонизм связан с пониженным содержанием дофамина в нигростриарном пути. Наблюдается при разрушении чёрной субстанции, патологии D1-подобных рецепторов. С угнетением дофаминергической передачи в нигростриарной системе связывают и развитие экстрапирамидных побочных эффектов при приёме антипсихотиков лекарственного паркинсонизма, дистонии, акатизии, поздней дискинезии. Для лечения болезни Паркинсона часто используют агонисты дофаминовых рецепторов прамипексол, бромокриптин, перголид[12][13].
С нарушением дофаминергической системы связывают и такие расстройства, как ангедония, депрессия, деменция, патологическая агрессивность, фиксация патологических влечений, синдром персистирующей лактореи-аменореи, импотенция, акромегалия, синдром беспокойных ног и периодических движений в конечностях[14]. Снижение в результате мутаций количества дофаминовых рецепторов второго типа (D2) в некоторых участках мозга повышает риск импульсивного поведения, алкогольной и наркотической зависимостей. Для людей с пониженным количеством D2-рецепторов характерен также повышенный риск ожирения (поскольку эти люди нередко склонны к обжорству), других вредных привычек — в частности, страсти к азартным играм. Причиной того, что люди с пониженным количеством D2-рецепторов склонны к поиску экстремальных способов получения удовольствия от жизни, является, по всей видимости, нехватка положительных эмоций у этих людей; кроме того, причиной может являться сниженная способность этих людей учиться на собственных ошибках, делать правильные выводы из отрицательного опыта[15].
Подавляющее большинство исследований сообщают о возрастных изменениях в синтезе дофамина, сайтах его связывания и количестве рецепторов. Исследования, использующие Позитронно-эмиссионную томографию на живых людях, показали существенное возрастное уменьшение в синтезе дофамина[16], особенно в регионах полосатого тела и экстрастриарной зрительной коры (за исключением среднего мозга)[17]. Также сообщается о значительном возрастном уменьшении рецепторов D1, D2 и D3[18][19][20][21][22]. Исследования показали общее уменьшение рецепторов D1 и D2[20] и, более специфически, уменьшение D1 и D2 рецепторов, связанных с хвостовым ядром и скорлупой[19][22]. Существенное возрастное уменьшение дофаминовых рецепторов D2 и D3 было обнаружено в передней поясной коре, лобной коре, боковой височной коре, гиппокампе, медиальной височной коре, миндалевидных телах, медиальном таламусе и боковом таламусе[18]. Одно из исследований также сообщает о существенной обратной корреляции между связыванием дофамина в затылочной доле и возрастом[19]. Посмертные исследования показали, что количество D1 и D2 рецепторов уменьшается с возрастом и в хвостатом ядре, и в скорлупе, при этом пропорция данных рецепторов с возрастом не изменяется[21]. Постепенная потеря дофамина считается причиной многих неврологических симптомов, которые развиваются с возрастом, таких как уменьшение размахивания руками и увеличение ригидности[23]. Изменение в уровне дофамина может быть причиной возрастных изменений в когнитивной гибкости[23].
Примечания
- ↑ Dopamine. DrugBank. Дата обращения: 14 августа 2025.
- ↑ 2,0 2,1 2,2 2,3 Дофамин // Большая российская энциклопедия : [в 35 т.] / гл. ред. Ю. С. Осипов. — М. : Большая российская энциклопедия, 2004—2017.
- ↑ Леводопа — описание вещества, фармакология, применение, противопоказания, формула. РЛС®. Дата обращения: 15 августа 2025.
- ↑ 4,0 4,1 4,2 4,3 4,4 Матлина Э. Ш., Меньшиков В. В. Клиническая биохимия катехоламинов, М., 1967
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 Дофамин // Большая российская энциклопедия : [в 35 т.] / гл. ред. Ю. С. Осипов. — М. : Большая российская энциклопедия, 2004—2017.
- ↑ Aminoff M. J., Greenberg D. A., Simon R. P. Clinical Neurology (неопр.). — 6th. — Lange: McGraw-Hill Medical, 2005. — С. 241—245. — ISBN 0071423605.
- ↑ Mehta M.A., Riedel W.J. Dopaminergic Enhancement of Cognitive Function. // Curr. Pharm. Des. 2006. v. 12. pp. 2487—2500.
- ↑ Beaulieu J. M., Gainetdinov R. R. The physiology, signaling, and pharmacology of dopamine receptors (англ.) // Pharmacological Reviews : journal. — 2011. — Vol. 63, no. 1. — P. 182—217. — doi:10.1124/pr.110.002642. — PMID 21303898.
- ↑ 9,0 9,1 9,2 9,3 9,4 Орловская Д. Д. Нейрохимические системы мозга // Общая психиатрия / Под ред. А. С. Тиганова. — Москва, 2006.
- ↑ Рациональная фармакотерапия в психиатрической практике: руководство для практикующих врачей / Под общ. ред. Ю. А. Александровского, Н. Г. Незнанова. — Москва: Литтерра, 2014. — 1080 с. — (Рациональная фармакотерапия). — ISBN 978-5-4235-0134-1.
- ↑ Луцкий И.С., Евтушенко С.К., Симонян В.А. Симпозиум «Болезнь Паркинсона (клиника, диагностика, принципы терапии)» // Последипломное образование. — 2011. — № 5 (43).
- ↑ Справочное руководство по психофармакологическим и противоэпилептическим препаратам, разрешенным к применению в России / Под ред. С. Н. Мосолова. — 2-е, перераб. — М.: «Издательство БИНОМ», 2004. — С. 17. — 304 с. — 7000 экз. — ISBN 5-9518-0093-5
- ↑ Катунина Е. А. Агонисты дофаминовых рецепторов и проблема эквивалентности доз // Неврология. — 2010. — № 2.
- ↑ Левин Я. И. Нейрохимическая медицина. Часть 1. Церебральные дофаминергические системы // Современная терапия психических расстройств. — 2008. — № 1.
- ↑ Марков А. Эволюция человека. Книга 2. Обезьяны, нейроны и душа. — Corpus, 2011. — Т. 2. — 512 с. — ISBN 978-5-271-36294-1
- ↑ Mobbs, Charles V. Handbook of the neuroscience of aging / Mobbs, Charles V., Hof, Patrick R.. — Amsterdam : Elsevier/Academic Press, 2009. — ISBN 978-0-12-374898-0
- ↑ Ota, M.; Yasuno, F.; Ito, H.; Seki, C.; Kozaki, S.; Asada, T.; Suhara, T. (2006). Age-related decline of dopamine synthesis in the living human brain measured by positron emission tomography with L-[β-11C]DOPA. Life Sciences. 79 (8): 730—736
- ↑ 18,0 18,1 Kaasinen, V.; Vilkman, H.; Hietala, J.; Någren, K.; Helenius, H.; Olsson, H.; Farde, L.; Rinne, J. O. (2000). Age-related dopamine D2/D3 receptor loss in extrastriatal regions of the human brain. Neurobiology of Aging. 21 (5): 683—688
- ↑ 19,0 19,1 19,2 Wang Y, Chan GL, Holden JE, et al. (September 1998). Age-dependent decline of dopamine D1 receptors in human brain: a PET study. Synapse. 30 (1): 56-61
- ↑ 20,0 20,1 Iyo, M.; Yamasaki, T. (1993). The detection of age-related decrease of dopamine, D1, D2 and serotonin 5-HT2 receptors in living human brain. Progress in Neuro-Psychopharmacology and Biological Psychiatry. 17 (3): 415—421.
- ↑ 21,0 21,1 Rinne, Juha O.; Lonnberg, Pirkko; Marjamaiki, Paivi (1989). Age-dependent decline in human brain dopamine D1 and D2 receptors. Brain Research. 508 (2): 349—352
- ↑ 22,0 22,1 Wong, D. F.; et al. (1984). Effects of age on dopamine and serotonin receptors measured by positron tomography in the living human brain. Science. 226 (4681): 1393—1396.
- ↑ 23,0 23,1 . — ISBN 0-12-734610-4.
Литература
- Дофамин // Большая российская энциклопедия : [в 35 т.] / гл. ред. Ю. С. Осипов. — М. : Большая российская энциклопедия, 2004—2017.
- Ашмарин И. П., Ещенко Н. Д., Каразеева Е. П. Нейрохимия в таблицах и схемах. — М.: Экзамен, 2007.
- Васильев В. Н. Диагностика и терапия инкурабельных нервных и психических заболеваний допаминовой этиологии. Биокоррекция Васильева. — М.: Медиакит, 2009. — 247 с. — ISBN 978-5-9901746-1-0.
Ссылки
- Знание.Вики:Cite web (не указан язык)
- Знание.Вики:Статьи с некорректным использованием шаблонов:Книга (указан неверный код языка)
- Страницы, использующие волшебные ссылки ISBN
- Химические вещества по алфавиту
- Алкалоиды
- Гормоны мозгового вещества надпочечников
- Нейромедиаторы
- Катехоламины
- Соединения азота по алфавиту