Щитовидная железа
Щитови́дная железа́ (лат. glandula thyreoidea, греч. θυρεοειδής — «щитоподобная») представляет собой эндокринный орган позвоночных, осуществляющий накопление йода и биосинтез йодсодержащих гормональных соединений (тироксина T4 и трийодтиронина T3), которые регулируют метаболические процессы, энергетический обмен и развитие организма. Данная железа также производит пептидный гормон кальцитонин, участвующий в кальциево-фосфорном гомеостазе через воздействие на костную ткань[1].
Филогенетическое происхождение
Эволюция щитовидной железы берёт начало от эндостиля — специализированной структуры примитивных хордовых, функционирующей как желобковидный орган на вентральной поверхности глотки[2]. Эта структура содержала железистые и реснитчатые клеточные элементы, обеспечивавшие секрецию и транспорт слизистых веществ для захвата пищевых частиц, одновременно осуществляя поглощение йода и выработку тиреоидных гормонов.
У современных миног происходит онтогенетическое преобразование эндостиля в полноценную щитовидную железу, что отражает эволюционный переход от экзокринной к эндокринной функции[2].
Межвидовые особенности строения
У рыб железа обычно локализуется ниже жаберных структур и не всегда имеет чёткое разделение на доли. У некоторых костистых рыб (телеостовых) участки тиреоидной ткани располагаются рядом с почками, селезёнкой, сердцем или глазами, что указывает на диффузное распределение функциональных элементов.
У четвероногих позвоночных железа находится в шейной области. Большинство тетрапод характеризуется наличием двух парных тиреоидных структур, тогда как у млекопитающих формируется единый орган, морфология которого типична для многих видов этого класса[3].
Структурная организация и морфология
Макроскопическое строение
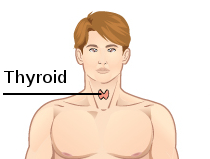
Щитовидная железа человека имеет характерную бабочкообразную форму, располагаясь в передней шейной области под гортанью и перед трахеей. Размеры органа составляют 2,5-4 см в длину для каждой доли, 1,5-2 см в ширину и 1-1,5 см в толщину. Объёмные показатели в норме не превышают 18 мл у женщин и 25 мл у мужчин, при массе железы 12-25 г у взрослых и 2-3 г у новорождённых.
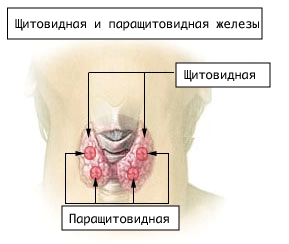
Перешеек соединяет две боковые доли на уровне второго-третьего трахейного кольца, имея высоту и ширину около 1,25 см. У 18,3-44,6 % людей выявляется дополнительная пирамидальная доля (пирамида Лалуэтта), представляющая собой остаток тиреоглоссального протока[4].
Микроскопическая архитектура
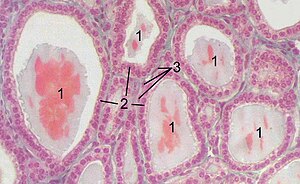
Основной функциональной единицей железы являются сферические фолликулы диаметром 0,02-0,9 мм, образованные однослойным эпителием тироцитов и содержащие коллоид с тиреоглобулином. Этот гликопротеин включает 123 тирозиновых остатка, служащих субстратом для йодирования. Между фолликулами располагаются парафолликулярные C-клетки, продуцирующие кальцитонин.
Открытие основных структурных элементов приписывается Джеффри Вебстерсону (1664), который впервые описал фолликулярную организацию тиреоидной ткани[5].
Васкуляризация и иннервация
Кровоснабжение осуществляется через верхние щитовидные артерии (ветви наружной сонной артерии) и нижние щитовидные артерии (из щито-шейного ствола подключичной артерии).
У 5 % населения присутствует непарная щитовидная артерия, отходящая от дуги аорты. Венозный отток реализуется через щитовидное венозное сплетение в плечеголовные вены.
Симпатическая иннервация происходит от верхнего шейного ганглия, парасимпатическая — от ветвей блуждающего нерва (верхний и возвратный гортанные нервы). Лимфодренаж направляется к регионарным узлам вдоль внутренних ярёмных вен[6].
Гормональная продукция
Преимущественно железа секретирует тироксин (T4) в количестве 80-90 % от общей продукции и трийодтиронин (T3) — 10-20 %. В циркуляции гормоны связываются с транспортными белками: тироксин-связывающим глобулином (70 %), транстиретином (10 %) и альбумином (15 %). Биологически активными являются только свободные фракции: 0,03 % T4 и 0,3 % T3.
Периферические ткани обеспечивают 85 % конверсии T4 в T3, производя также 95 % реверсивного T3 и 87 % активного T3. Этот процесс осуществляется дейодиназными ферментами в печени, почках и других органах[7].
Метаболические эффекты
Тиреоидные гормоны регулируют основной обмен, влияя на потребление кислорода митохондриями и активность Na⁺-K⁺-АТФазы[8]. Они стимулируют липолиз, гликогенолиз и глюконеогенез, одновременно снижая уровень холестерина через усиление его секреции с жёлчью.
Сердечно-сосудистые эффекты включают увеличение частоты и силы сердечных сокращений, повышение минутного объёма кровообращения. В развивающемся организме гормоны обеспечивают нормальное созревание мозга, рост костей и половое развитие.
Кальциевый гомеостаз
Четыре паращитовидные железы общей массой 0,1-0,13 г, расположенные на задней поверхности щитовидной железы, секретируют паратгормон. Кальцитонин, вырабатываемый C-клетками, способствует встраиванию кальция и фосфатов в костную ткань, ингибируя остеокласты и стимулируя остеобласты[9].
Развитие и формирование
Эмбриогенез
Развитие щитовидной железы начинается на 3-4 неделе гестации в виде эпителиального выпячивания дна глотки между tuberculum impar и copula linguae. Железа мигрирует каудально через тиреоглоссальный проток, который дегенерирует к концу пятой недели развития.
Ультимофарингеальное тело, формирующееся из четвёртого глоточного кармана, даёт начало парафолликулярным клеткам, встраивающимся в тиреоидную паренхиму во время миграции железы[10].
Постнатальное созревание
TSH впервые определяется на 11 неделе внутриутробного развития. Клинически значимый уровень T4 достигается к 18-20 неделям беременности. Концентрация T3 остается низкой (менее 15 нг/дл) до 30 недель, повышаясь до 50 нг/дл к моменту рождения.
Недоношенные новорождённые подвержены риску гипотиреоза из-за незрелости тиреоидной системы, что требует скрининговых программ для раннего выявления заболевания[11].
Регуляторные механизмы
Гипоталамо-гипофизарная ось
Тиреотропин-рилизинг-гормон (TRH), открытый Эндрю Шелли в 1969 году (Нобелевская премия 1977), стимулирует секрецию тиреотропного гормона (TSH) из аденогипофиза[12]. Воздействие холода усиливает выработку TRH для активации термогенеза.
Дофамин, соматостатин и глюкокортикоиды подавляют продукцию TSH по механизму отрицательной обратной связи. Сами тиреоидные гормоны также ингибируют секрецию TRH и TSH при достижении физиологических концентраций.
Молекулярные основы синтеза
Натрий-йодидный симпортер обеспечивает активный транспорт двух ионов натрия и одного йодида в тироциты. Пендрин переносит йодид из цитоплазмы в фолликулярную полость, где тиреопероксидаза окисляет его до молекулярного йода. Йодирование тирозиновых остатков тиреоглобулина приводит к образованию монойодтирозина (MIT) и дийодтирозина (DIT), которые затем конденсируются с формированием T4 и T3[13].
Генетическая регуляция
В клетках щитовидной железы экспрессируется около 70 % из 20 000 белок-кодирующих генов человека[14]. Из них 174 гена проявляют специфическую активность в тиреоидной ткани, а 20 характеризуются высокой органоспецифичностью, контролируя синтез тиреоглобулина, тиреопероксидазы и кальцитонина.
Патологические состояния
Функциональные расстройства
Гипертиреоз характеризуется избыточной продукцией тиреоидных гормонов, наиболее часто обусловленной болезнью Грейвса. Данное заболевание было описано Робертом Джеймсом Грейвсом в 1834 году. Термин «гипертиреоз» введён Чарльзом Мейо в 1910 году.
Гипотиреоз представляет собой недостаточность тиреоидной функции, при этом аутоиммунный тиреоидит Хашимото, описанный в 1912 году с выявлением специфических антител в 1956 году, считается главной причиной в йодобеспеченных регионах[15].
Структурные аномалии
Узловые образования встречаются у 4-7 % населения, злокачественная трансформация наблюдается в 5 % случаев. Зоб диагностируется у 5 % людей и может ассоциироваться с различными функциональными состояниями.
Рак щитовидной железы чаще поражает женщин в соотношении 2:1. Наиболее часто встречается папиллярная карцинома, за ней следуют фолликулярная, медуллярная формы и лимфомы[16].
Онкологические заболевания
Радиационное воздействие на область головы и шеи представляет значимый фактор риска развития тиреоидного рака. Метастатическое поражение железы опухолями других локализаций наблюдается относительно редко, но требует дифференциальной диагностики при выявлении узловых образований[17].
Диагностические подходы
Лабораторные методы
Определение концентраций TSH, свободных T4 и T3 составляет основу гормональной диагностики. TSH рассматривается как наиболее чувствительный маркер тиреоидной дисфункции. Измерение антител к тиреопероксидазе и тиреоглобулину позволяет выявить аутоиммунные процессы.
Стимуляционные тесты с TRH применяются при подозрении на вторичный гипотиреоз. Тиреоглобулин служит маркером рецидива рака после тиреоидэктомии и должен быть неопределяемым при успешном лечении[18].
Инструментальная диагностика
Ультразвуковое исследование дифференцирует солидные и кистозные образования, оценивает эхогенность и васкуляризацию узлов. Радиоизотопное сканирование с йодом-123 или технецием-99 позволяет оценить функциональную активность тиреоидной ткани.
Тонкоигольная аспирационная биопсия обеспечивает цитологическую верификацию характера узловых образований. Компьютерная томография применяется для оценки распространённости злокачественных процессов и планирования хирургических вмешательств[19].
Терапевтические стратегии
Антитиреоидные препараты (пропилтиоурацил, карбимазол, метимазол) блокируют синтез тиреоидных гормонов при гипертиреозе. Левотироксин представляет стандарт заместительной терапии. Бета-адреноблокаторы обеспечивают симптоматическое облегчение при тиреотоксикозе.
Терапия радиоактивным йодом-131 основана на селективном поглощении изотопа тиреоцитами с последующей деструкцией гиперфункционирующей ткани. Метод эффективен при болезни Грейвса и токсическом многоузловом зобе.
Тиреоидэктомия выполняется при злокачественных новообразованиях, компрессионном синдроме или неэффективности консервативного лечения. Современные трансоральные методы минимизируют косметические дефекты. Основные риски включают повреждение возвратного гортанного нерва и паращитовидных желез[20].
Хронология формирования знаний
Древние цивилизации и античность
Применение жжёной губки и морских водорослей для лечения зоба зафиксировано в Китае с 1600 года до н. э. Аюрведический трактат «Сушрута-самхита» (около 1200—600 г. до н. э.) содержит описания гипер- и гипотиреоза.
Аристотель и Ксенофонт в V веке до н. э. документировали случаи диффузного токсического зоба[21]. Гиппократ и Платон в IV веке до н. э. впервые описали железу, предполагая, что она выполняет слюнную функцию. Плиний Старший в I веке до н. э. рекомендовал жжёные морские водоросли для лечения альпийского зоба.
Эпоха Возрождения и Новое время
Леонардо да Винчи создал первую анатомическую иллюстрацию щитовидной железы в 1500 году. Андреас Везалий в 1543 году дал первое точное анатомическое описание органа. Томас Уортон в 1656 году предложил современное название «thyroid» из-за сходства с древнегреческими щитами.
Альбрехт фон Галлер в XVIII веке опроверг ошибочные представления Галена о функции железы как слюнной, но альтернативных гипотез не выдвинул[22].
Современная эра открытий
Бернар Куртуа открыл йод в 1811 году. А. Кохер в 1833 году опубликовал анализ 100 тиреоидэктомий, выявив симптомы кретинизма в 16 из 24 случаев полного удаления железы, что положило конец практике радикальных операций. Д. Р. Мюррей в 1891 году впервые применил экстракт щитовидной железы для лечения. К. Э. Бауман в 1896 году обнаружил высокую концентрацию йода в тиреоидной ткани. Д. Марин в 1917 году научно обосновал связь между дефицитом йода и развитием зоба. Тироксин выделен в чистом виде в 1914 году, синтезирован в 1927 году. Трийодтиронин открыт в 1952 году. Превращение T4 в T3 в периферических тканях установлено в 1970 году[23].
Хирургические достижения
Первые тиреоидэктомии выполнены Аэцием в VI веке и Али ибн Аббасом аль-Магуси в 990 году. Теодор Кохер разработал современную технику операций и получил Нобелевскую премию в 1909 году «за работы по физиологии, патологии и хирургии щитовидной железы»[24].
Йодная профилактика и общественное здоровье
Внедрение йодирования соли привело к снижению частоты зоба у детей в Детройте в 20 раз. В настоящее время более 120 стран мира имеют программы обязательного йодирования соли, что практически ликвидировало эндемический кретинизм в развитых регионах[25].
Примечания
- ↑ Родионова Т. И. Роль гормонов щитовидной железы в регуляции обменных процессов миокарда // Саратовский научно-медицинский журнал / Т. И. Родионова, В. В. Самитин. — 2009. — Т. 5, № 1. — С. 123–127.
- ↑ 2,0 2,1 Строев Ю.И. Самый тяжелый элемент жизни (к 200-летию открытия йода) // Экологическая физиология, биохимия и токсикология / Ю. И. Строев, Л. П. Чурилов. — 2012. — № 3. — С. 313–342.
- ↑ de Escobar G. M. Maternal thyroid hormones early in pregnancy and fetal brain development // Best Practice & Research Clinical Endocrinology & Metabolism / G. M. de Escobar, M. J. Obregón, F. E. del Rey. — 2004. — Vol. 18, № 2. — P. 225—248.
- ↑ Бережанская С. Б. Зависимость объема щитовидной железы от антропометрических данных у детей раннего возраста // Российский вестник перинатологии и педиатрии / С.Б. Бережанская, З.И. Малиненко. — 2013. — № 5. — С. 87–91.
- ↑ Lydiatt D. D. Historical vignettes of the thyroid gland // Indian Journal of Endocrinology and Metabolism / D. D. Lydiatt, G. S. Bucher. — 2011. — № 24(1). — P. 1–9.
- ↑ Малюга В. Ю. Клинико-анатомические особенности кровоснабжения околощитовидных желез // Эндокринная хирургия / В. Ю. Малюга, А. А. Куприн. — 2018. — Т. 12, № 1. — С. 40–54.
- ↑ Артыкбаева Г. М. Роль дейодиназ 1-го и 2-го типа в метаболизме тиреоидных гормонов // Проблемы эндокринологии / Г. М. Артыкбаева. — 2016. — № 2. — С. 46–52.
- ↑ Bianco A. C. Adaptive activation of thyroid hormone and energy expenditure // Biosci Rep / A. C. Bianco, A. L. Maia, W. S. Da Silva, M. A. Christoffolete. — 2005. — Vol. 25, № 3—4. — P. 191–208.
- ↑ Talmage R. V. Evidence for an important physiological role for calcitonin // Proceedings of the National Academy of Sciences / R. V. Talmage, S. A. Grubb, H. Norimatsu, C. J. Vanderwiel. — 1980. — Vol. 77, № 1. — P. 609–613.
- ↑ Огнерубов Н. А. Аномалии развития щитовидной железы: обзор литературы // Вестник Тамбовского университета / Н. А. Огнерубов, А. В. Зрютина. — 2013. — Т. 18, № 2—6. — С. 3309–3311.
- ↑ Contempré B. Detection of thyroid hormones in human embryonic cavities during the first trimester of pregnancy // Journal of Clinical Endocrinology & Metabolism / B. Contempré, E. Jauniaux, R. Calvo, D. Jurkovic, S. Campbell, G.M. de Escobar. — 1993. — Vol. 77, № 6. — P. 1719—1722.
- ↑ Grujić M. Andrew Victor Schally: Pioneering Neuroendocrinologist and Architect of Luteinizing Hormone-Releasing Hormone Analogs // Cureus / M. Grujić, R. M. Živković, K. Janković, N. Milosavljević. — 2024. — Vol. 16, № 9.
- ↑ Dème D. Kinetics of thyroglobulin iodination and of hormone synthesis catalysed by thyroid peroxidase // European Journal of Biochemistry / D. Dème, J. Pommier, J. Nunez. — 1976. — Vol. 70, № 2. — P. 435–440.
- ↑ The thyroid gland-specific proteome. Royal Institute of Technology (2024). — Human Protein Atlas.
- ↑ Лыгина Е. А. Жизнь и наследие Хакару Хашимото // Клиническая и экспериментальная тиреоидология / Е. А. Лыгина, В. В. Латий. — 2021. — Т. 17, № 2. — С. 20–23.
- ↑ Гостимский А. В. Современный подход к проблеме диагностики и лечения больных раком щитовидной железы // Вестник хирургии им. И. И. Грекова / А. В. Гостимский, А. Ф. Романчишен, Ю. В. Кузнецова. — 2014. — Т. 173, № 6. — С. 85–89.
- ↑ Тронько Н. Д. Частота рака щитовидной железы и ее эпидемиологические детерминанты: роль ионизирующего излучения // Проблемы эндокринологии / Н. Д. Тронько, В. П. Богуславский, А. Е. Присяжнюк, Е. В. Большова. — 1994. — Т. 40, № 3. — С. 55–59.
- ↑ Царева Ю. О. Функция щитовидной железы и ее биоритмические изменения // Современные проблемы науки и образования / Ю. О. Царева, И. М. Соколов, М. А. Аристарин. — 2015. — № 1.
- ↑ Михеева Н. В. Ультразвуковое исследование и сцинтиграфия в диагностике очаговых поражений щитовидной железы // Вестник РНЦРР МЗ РФ / Н. В. Михеева. — 2008. — № 8. — С. 1—45.
- ↑ Гарбузов П. И. Радиойодтерапия заболеваний щитовидной железы // Онкология / П. И. Гарбузов. — 2007.
- ↑ Konstantinidou S. The thyroid gland in ancient Greece: a historical perspective // Hormones (Athens) / S. Konstantinidou, E. Konstantinidou. — 2018. — Vol. 17, № 2. — P. 287–291.
- ↑ History of Medicine: Leonardo Da Vinci and the Elusive Thyroid. Columbia Surgery. Columbia University (2015).
- ↑ Фадеев В. В. Диагностика и лечение эутиреоидного зоба: место комбинированной терапии препаратами йода и левотироксина // Клиническая и экспериментальная тиреоидология / В. В. Фадеев. — 2010. — № 2. — С. 13—23.
- ↑ Emil Theodor Kocher – Facts. NobelPrize.org. Nobel Prize Organization (2025).
- ↑ Leung A. M. History of U.S. Iodine Fortification and Supplementation // Nutrients / A. M. Leung, L. E. Braverman, E. N. Pearce. — 2012. — Vol. 4, № 11. — P. 1740–1746.