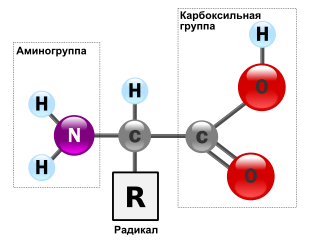
Аминокислоты
Аминокисло́ты — это класс органических соединений, молекулы которых содержат как карбоксильную (—COOH), так и аминную (—NH2) функциональные группы. В состав аминокислот входят четыре основных химических элемента: углерод (C), водород (H), кислород (O) и азот (N), однако в радикалах некоторых аминокислот могут присутствовать и другие элементы. На данный момент известно около 500 природных аминокислот[1], но лишь 21 из них используется в генетическом коде живых организмов. По своей структуре аминокислоты можно рассматривать как производные карбоновых кислот, в которых один или несколько атомов водорода замещены на аминогруппы.
История
В период после 1953 года было обнаружено большинство из приблизительно 500 ныне известных аминокислот. Их поиск и открытие происходили в ходе исследований новых антибиотиков, продуцируемых различными микроорганизмами, грибами, а также содержащихся в семенах, растениях, плодах и жидкостях животного происхождения. Из всех идентифицированных аминокислот около 240 встречаются в природе в свободном виде, тогда как остальные присутствуют лишь в качестве промежуточных продуктов метаболизма[1].
Открытие аминокислот в составе белков
История открытия аминокислот в составе белковых молекул[2] прослеживается с начала XIX века.
Незаменимые аминокислоты, которые не могут синтезироваться в организме человека и должны поступать с пищей, выделены жирным шрифтом в таблице.
| Аминокислота | Аббревиатура | Год | Источник | Впервые выделен |
| Глицин | Gly, G | 1820 | Желатин | А. Браконно |
| Лейцин | Leu, L | 1820 | Мышечные волокна | А. Браконно |
| Тирозин | Tyr, Y | 1848 | Казеин | Ю. фон Либих |
| Серин | Ser, S | 1865 | Шёлк | Э. Крамер |
| Глутаминовая кислота | Glu, E | 1866 | Растительные белки | Г. Риттхаузен[нем.] |
| Глутамин | Gln, Q | 1877 | Пшеничная мука | Э. Шулце |
| Аспарагиновая кислота | Asp, D | 1868 | Конглутин, легумин (ростки спаржи) | Г. Риттхаузен[англ.] |
| Аспарагин | Asn, N | 1806 | Сок спаржи | Л.-Н. Воклен и П. Ж. Робике |
| Фенилаланин | Phe, F | 1881 | Ростки люпина | Э. Шульце, Й. Барбьери |
| Аланин | Ala, A | 1888 | Фиброин шёлка | А. Штреккер, Т. Вейль |
| Лизин | Lys, K | 1889 | Казеин | Э. Дрексель |
| Аргинин | Arg, R | 1895 | Вещество рога | С. Гедин |
| Гистидин | His, H | 1896 | Стурин, гистоны | А. Коссель, С. Гедин |
| Цистеин | Cys, C | 1899 | Вещество рога | К. Мёрнер |
| Валин | Val, V | 1901 | Казеин | Э. Фишер |
| Пролин | Pro, P | 1901 | Казеин | Э. Фишер |
| Гидроксипролин | Hyp, hP | 1902 | Желатин | Э. Фишер |
| Триптофан | Trp, W | 1902 | Казеин | Ф. Хопкинс, Д. Кол |
| Изолейцин | Ile, I | 1904 | Фибрин | Ф. Эрлих |
| Метионин | Met, M | 1922 | Казеин | Д. Мёллер |
| Треонин | Thr, T | 1925 | Белки овса | С. Шрайвер и другие |
| Гидроксилизин | Hyl, hK | 1925 | Белки рыб | С. Шрайвер и другие |
Физические свойства
Аминокислоты демонстрируют физические свойства, существенно отличающиеся от свойств соответствующих кислот и оснований[3]. Эти соединения представляют собой кристаллические вещества с высокими температурами плавления. Они характеризуются повышенной растворимостью в воде по сравнению с органическими растворителями. Многим аминокислотам присущ сладкий вкус.
Указанные характеристики свидетельствуют о солеподобной природе аминокислот. Их уникальные физико-химические свойства обусловлены специфической структурой молекул, содержащих одновременно кислотную и основную функциональные группы с противоположными свойствами.
Химические свойства
Аминокислоты являются амфотерными соединениями, что обусловлено особенностями их структуры[3]. Наличие карбоксильной группы (—COOH) в молекулах аминокислот определяет их способность проявлять кислотные свойства, в то время как присутствие аминогруппы (—NH2) обусловливает их основные свойства. Благодаря этой уникальной особенности строения аминокислоты способны вступать в реакции как с кислотами, так и со щелочами. При взаимодействии с кислотами аминогруппа аминокислот протонируется, образуя катион аммония, тогда как при реакции со щелочами происходит депротонирование карбоксильной группы с образованием карбоксилат-аниона.
NH2 —CH2 —COOH + HCl → HCl · NH2 —CH2 —COOH (Хлороводородная соль глицина)
NH2 —CH2 —COOH + NaOH → H2O + NH2 —CH2 —COONa (натриевая соль глицина)
Водные растворы аминокислот проявляют характерные свойства буферных систем благодаря своей способности образовывать цвиттер-ионы. Эти молекулы существуют в форме внутренних солей, где положительно заряженная аминогруппа и отрицательно заряженная карбоксильная группа нейтрализуют друг друга в пределах одной молекулы. Такая особенность позволяет аминокислотам противостоять резким изменениям pH среды, что является ключевой характеристикой буферных растворов.
NH2 —CH2COOH N+H3 —CH2COO-
В особых условиях некоторые аминокислоты, такие как гистидин, способны нести заряд на всех трёх ионогенных группах одновременно. В этом случае они формируют более сложные структуры, известные как двойные соли.
Что касается реакционной способности, аминокислоты демонстрируют универсальность. Они обладают химическими свойствами, характерными как для карбоновых кислот, так и для аминов. Это двойственное поведение открывает широкий спектр возможных химических превращений, делая аминокислоты важнейшими строительными блоками в биохимических процессах и перспективными соединениями для синтетической химии.
Этерификация:
NH2 —CH2 —COOH + CH3OH → H2O + NH2 —CH2 —COOCH3 (метиловый эфир глицина)
Ключевое свойство аминокислот — склонность к реакции поликонденсации. Данный процесс приводит к формированию полиамидных соединений. К продуктам такого синтеза относятся:
- пептиды;
- белковые молекулы;
- синтетические полимеры (нейлон, капрон).
Реакция образования пептидов:
HOOC —CH2 —NH —H + HOOC —CH2 —NH2 → HOOC —CH2 —NH —CO —CH2 —NH2 + H2O
Изоэлектрическая точка аминокислоты — это показатель pH среды, при котором наибольшее число молекул данного соединения приобретает электронейтральное состояние. В этих условиях аминокислота демонстрирует минимальную электрофоретическую подвижность. Данный феномен используется в методиках разделения аминокислот, пептидов и белковых структур.
Молекула аминокислоты, содержащая протонированную аминогруппу (—NH3+) и депротонированную карбоксильную группу (—COO−), определяется как цвиттер-ион. Такая форма характеризуется существенным дипольным моментом при общем нулевом заряде. Цвиттер-ионы формируют основу кристаллической структуры большей части аминокислот.
В случае аминокислот с множественными амино- и карбоксильными группами концепция единого цвиттер-иона утрачивает четкость [4].
Получение
Методы получения аминокислот включают[5]:
- гидролитическое расщепление белковых структур;
- синтетические химические процессы.
Эти подходы позволяют выделить или синтезировать большую часть известных аминокислот. Гидролиз белков представляет собой биохимический метод, в то время как химический синтез охватывает ряд различных реакций, специфичных для каждой конкретной аминокислоты.
Оптическая изомерия
α-Аминокислоты, за исключением глицина, характеризуются наличием хирального α-углеродного атома. Треонин и изолейцин отличаются присутствием двух асимметрических центров. Данная структурная особенность обуславливает оптическую активность этих соединений[6].
В биологических системах преобладают α-аминокислоты L-ряда. Именно эти изомеры участвуют в рибосомальном биосинтезе белковых молекул. D-изомеры в данном процессе не задействованы.
D-аминокислоты в живых организмах
Специфическая рацемизация аспарагиновых остатков
В структурных белках с низкой метаболической активностью происходит спонтанная неферментативная рацемизация аспарагиновых остатков. В дентине и эмали зубов L-аспартат трансформируется в D-форму со скоростью приблизительно 0,1% ежегодно[7]. Это явление применяется для определения возраста млекопитающих. Аналогичный процесс наблюдается при старении коллагена. Механизм рацемизации предположительно включает формирование сукцинимидного цикла путём внутримолекулярного ацилирования азота пептидной связи свободной карбоксильной группой аспарагиновой кислоты[8].
Распространение D-аминокислот
Развитие методов следового аминокислотного анализа позволило обнаружить D-аминокислоты в клеточных стенках некоторых бактерий (1966 г.), а позднее — в тканях высших организмов[9]. D-аспартат и D-метионин, вероятно, выполняют функцию нейромедиаторов у млекопитающих.
D-аминокислоты в пептидах
Некоторые пептиды содержат D-аминокислоты, образующиеся в результате посттрансляционной модификации. Примером служат опиоидные гептапептиды кожи южноамериканских амфибий филломедуз, включающие D-метионин и D-аланин. Присутствие D-аминокислот обуславливает высокую анальгетическую активность этих пептидов.
Аналогичным образом формируются пептидные антибиотики бактериального происхождения, эффективные против грамположительных бактерий — низин, субтилин и эпидермин[10].
D-аминокислоты чаще встречаются в пептидах и их производных, синтезируемых нерибосомным путём в клетках грибов и бактерий. Вероятно, исходным материалом служат L-аминокислоты, изомеризуемые одной из субъединиц ферментного комплекса, осуществляющего синтез пептида.
Протеиногенные аминокислоты
Двадцать α-аминокислот, закодированных в геноме, инкорпорируются в полипептидные цепи при биосинтезе белка. Эти соединения именуются протеиногенными или стандартными аминокислотами. В некоторых белках обнаруживаются нестандартные аминокислоты — продукты посттрансляционной модификации стандартных.
В последние годы к протеиногенным аминокислотам стали относить селеноцистеин (Sec, U) и пирролизин (Pyl, O), включаемые в белки при трансляции[11]. Их называют 21-й и 22-й аминокислотами соответственно.
Причины эволюционного отбора именно этих 20 аминокислот остаются неясными. Например, гомосерин — ключевой метаболит в биосинтезе треонина, изолейцина и метионина — не имеет собственной аминоацил-тРНК-синтетазы и тРНК, в отличие от упомянутых аминокислот.
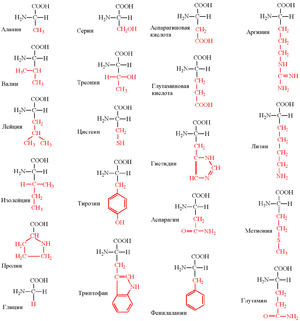
Структурные формулы протеиногенных аминокислот традиционно представляют в виде специальной таблицы.
20 стандартных аминокислот. R-группы выделены красным.
Классификация аминокислот[12]
| Аминокислота | 3-буквы | 1-буква | Генетический код | Мнемоническое
правило |
Полярность | Класс по радикалу | Mr | Vw
(Å3) |
pI | Гидрофобность | Частота в белках (%) |
| Глицин | Gly | G | GGU, GGC, GGA, GGG | Glycine | Неполярные | Алифатические | 75,067 | 48 | 6,06 | −0,4 | 7,03 |
| Аланин | Ala | A | GCU, GCC, GCA, GCG | Alanine | Неполярные | Алифатические | 89,094 | 67 | 6,01 | 1,8 | 8,76 |
| Валин | Val | V | GUU, GUC, GUA, GUG | Valine | Неполярные | Алифатические | 117,148 | 105 | 6,00 | 4,2 | 6,73 |
| Изолейцин | Ile | I | AUU, AUC, AUA | Isoleucine | Неполярные | Алифатические | 131,175 | 124 | 6,05 | 4,5 | 5,49 |
| Лейцин | Leu | L | UUA, UUG, CUU, CUC, CUA, CUG | Leucine | Неполярные | Алифатические | 131,175 | 124 | 6,01 | 3,8 | 9,68 |
| Пролин | Pro | P | CCU, CCC, CCA, CCG | Proline | Неполярные | Гетероциклические | 115.132 | 90 | 6,30 | −1,6 | 5,02 |
| Серин | Ser | S | UCU, UCC, UCA, UCG, AGU, AGC | Serine | Полярные | Оксимоноаминокарбоновые | 105,093 | 73 | 5,68 | −0,8 | 7,14 |
| Треонин | Thr | T | ACU, ACC, ACA, ACG | Threonine | Полярные | Оксимоноаминокарбоновые | 119,119 | 93 | 5,60 | −0,7 | 5,53 |
| Цистеин | Cys | C | UGU, UGC | Cysteine | Полярные | Серосодержащие | 121,154 | 86 | 5,05 | 2,5 | 1,38 |
| Метионин | Met | M | AUG | Methionine | Неполярные | Серосодержащие | 149,208 | 124 | 5,74 | 1,9 | 2,32 |
| Аспарагиновая
кислота |
Asp | D | GAU, GAC | asparDic acid | Полярные | заряженные отрицательно | 133,104 | 91 | 2,85 | −3,5 | 5,49 |
| Аспарагин | Asn | N | AAU, AAC | asparagiNe | Полярные | Амиды | 132,119 | 96 | 5,41 | −3,5 | 3,93 |
| Глутаминовая
кислота |
Glu | E | GAA, GAG | gluEtamic acid | Полярные | заряженные отрицательно | 147,131 | 109 | 3,15 | −3,5 | 6,32 |
| Глутамин | Gln | Q | CAA, CAG | Q-tamine | Полярные | Амиды | 146,146 | 114 | 5,65 | −3,5 | 3,9 |
| Лизин | Lys | K | AAA, AAG | before L | Полярные | заряженные положительно | 146,189 | 135 | 9,60 | −3,9 | 5,19 |
| Аргинин | Arg | R | CGU, CGC, CGA, CGG, AGA, AGG | aRginine | Полярные | заряженные положительно | 174.203 | 148 | 10,76 | −4,5 | 5,78 |
| Гистидин | His | H | CAU, CAC | Histidine | Полярные
заряженные положительно |
Гетероциклические | 155,156 | 118 | 7,60 | −3,2 | 2,26 |
| Фенилаланин | Phe | F | UUU, UUC | Fenylalanine | Неполярные | Ароматические | 165,192 | 135 | 5,49 | 2,8 | 3,87 |
| Тирозин | Tyr | Y | UAU, UAC | tYrosine | Полярные | Ароматические | 181,191 | 141 | 5,64 | −1,3 | 2,91 |
| Триптофан | Trp | W | UGG | tWo rings | Неполярные | Ароматические,
Гетероциклические |
204,228 | 163 | 5,89 | −0,9 | 6,73 |
По радикалу:
- неполярные: глицин, аланин, валин, изолейцин, лейцин, пролин;
- полярные незаряженные (заряды скомпенсированы) при pH=7: серин, треонин, цистеин, метионин, аспарагин, глутамин;
- ароматические: фенилаланин, триптофан, тирозин;
- полярные заряженные отрицательно при pH=7: аспартат, глутамат;
- полярные заряженные положительно при pH=7: лизин, аргинин, гистидинт[12]
По функциональным группам:
- алифатические;
- моноаминомонокарбоновые: глицин, аланин, валин, изолейцин, лейцин;
- оксимоноаминокарбоновые: серин, треонин;
- моноаминодикарбоновые: аспартат, глутамат, за счёт второй карбоксильной группы несут в растворе отрицательный заряд;
- амиды моноаминодикарбоновых: аспарагин, глутамин;
- диаминомонокарбоновые: лизин, аргинин, несут в растворе положительный заряд;
- серосодержащие: цистеин, метионин.
- ароматические: фенилаланин, тирозин, триптофан;
- гетероциклические: триптофан, гистидин, пролин;
- аминокислоты: пролинт[12].
По классам аминоацил-тРНК-синтетаз:
- Класс I: валин, изолейцин, лейцин, цистеин, метионин, глутамат, глутамин, аргинин, тирозин, триптофан.
- Класс II: глицин, аланин, пролин, серин, треонин, аспартат, аспарагин, гистидин, фенилаланинт[12]
Для лизина существуют аминоацил-тРНК-синтетазы обоих классов.
По путям биосинтеза
Биосинтез протеиногенных аминокислот характеризуется многообразием и вариативностью. Синтез одной аминокислоты может осуществляться различными путями, при этом разные пути могут иметь сходные этапы. Несмотря на сложность, предпринимаются попытки систематизации аминокислот по их биосинтетическим путямт[12]
Выделяют следующие биосинтетические семейства аминокислот:
- Семейство аспартата: аспартат, аспарагин, треонин, изолейцин, метионин, лизин.
- Семейство глутамата: глутамат, глутамин, аргинин, пролин.
- Семейство пирувата: аланин, валин, лейцин.
- Семейство серина: серин, цистеин, глицин.
- Семейство пентоз: гистидин, фенилаланин, тирозин, триптофан.
Отнесение аминокислоты к определённому семейству не всегда однозначно и может варьировать в зависимости от организма и преобладающего пути синтеза. Распределение аминокислот по семействам обычно осуществляется с учётом этих факторов.
По способности организма синтезировать аминокислоты из предшественников:
- Незаменимые. Для большинства животных и человека незаменимыми аминокислотами являются: валин, изолейцин, лейцин, треонин, метионин, лизин, фенилаланин, триптофан.
- Заменимые. Для большинства животных и человека заменимыми аминокислотами являются: глицин, аланин, пролин, серин, цистеин, аспартат, аспарагин, глутамат, глутамин, тирозинт[12]
Разделение аминокислот на заменимые и незаменимые имеет определённые ограничения. Статус аминокислоты может изменяться в зависимости от физиологических условий:
- Тирозин: заменим при достаточном поступлении фенилаланина. У пациентов с фенилкетонурией приобретает статус незаменимой аминокислоты.
- Аргинин: синтезируется в организме человека, но при определённых физиологических состояниях может рассматриваться как незаменимая аминокислота.
- Гистидин: эндогенный синтез не всегда обеспечивает потребности организма, что обусловливает необходимость его поступления с пищей.
По характеру катаболизма у животных:
- Глюкогенные — при распаде дают метаболиты, не повышающие уровень кетоновых тел, способные относительно легко становиться субстратом для глюконеогенеза: пируват, α-кетоглутарат, сукцинил-KoA, фумарат, оксалоацетат.
- Кетогенные — распадаются до ацетил-KoA и ацетоацетил-KoA, повышающие уровень кетоновых тел в крови животных и человека и преобразующиеся в первую очередь в липиды.
- Глюко-кетогенные — при распаде образуются метаболиты обоих типовт[12]
Аминокислоты:
- Глюкогенные: глицин, аланин, валин, пролин, серин, треонин, цистеин, метионин, аспартат, аспарагин, глутамат, глутамин, аргинин, гистидин.
- Кетогенные: лейцин, лизин.
- Глюко-кетогенные (смешанные): изолейцин, фенилаланин, тирозин, триптофан.
«Миллеровские» аминокислоты
Термин «миллеровские» аминокислоты обозначает соединения, синтезируемые в условиях, аналогичных эксперименту Стенли Л. Миллера 1953 г. В ходе подобных экспериментов образуются рацемические смеси различных аминокислот, включая аланин, глицин, валин, лейцин, изолейцин, треонин, пролин, серин, аспартат, глутамат[13].
Родственные соединения
Некоторые вещества, способные выполнять определённые биологические функции аминокислот, в медицинской практике также именуются аминокислотами. К ним относится, например, таурин[14].
Практическое применение
Способность аминокислот к поликонденсации используется для получения полиамидов — пептидов, белков, а также синтетических полимеров (нейлон, капрон, энант).
Аминокислоты входят в состав спортивного питания и комбикормов. В пищевой промышленности применяются как вкусовые добавки, например, глутамат натрия[15].
Примечания
- ↑ 1,0 1,1 Wagner I., Musso H. New Naturally Occurring Amino Acids (нем.) // Angewandte Chemie International Edition in English : magazin. — 1983. — November (Bd. 22, Nr. 11). — S. 816—828..
- ↑ S. Hansen. Entdeckung der Aminosäuren. — 2015. Архивировано 15 июня 2016 года..
- ↑ 3,0 3,1 Общая биология. Учебник для 9 — 10 классов средней школы. Под ред. Ю. И. Полянского. Изд. 17-е, перераб. — М.: Просвещение, 1987. — 288с..
- ↑ Anton P. Novikov, Alexey V. Safonov, Konstantin E. German, Mikhail S. Grigoriev. What kind of interactions we may get moving from zwitter to “dritter” ions: C–O⋯Re(O4) and Re–O⋯Re(O4) anion⋯anion interactions make structural difference between L-histidinium perrhenate and pertechnetate (англ.) // CrystEngComm. — 2023-12-01. — ISSN 1466-8033. — doi:10.1039/D3CE01164J. Архивировано 8 декабря 2023 года..
- ↑ Аминокислоты. Пептиды. Белки Х.-Д. Якубке, Х. Ешкайт ; пер. с нем. Н. П. Запеваловой, Е. Е. Максимова ; под ред. Ю. В. Митина..
- ↑ Илиел Э., Вайлен С., Дойл М. Основы органической стереохимии = Basic Organic Stereochemistry / Пер. с англ. З. А. Бредихиной, под ред. А. А. Бредихина. — М.: Бином. Лаборатория знаний, 2007. — 703 с..
- ↑ Трофимова Т. И. Курс физики. — М.: Высшая школа, 1990. — С. 315. — 478 с..
- ↑ Сивухин Д. В. Общий курс физики. — 3-е. — М.: Физматлит, 2005. — Т. IV. Оптика. — С. 608—611. — 792 с..
- ↑ J. van Heijenoort. Formation of the glycan chains in the synthesis of bacterial peptidoglycan // Glycobiology. — 2001-3. — Т. 11, вып. 3. — С. 25R—36R. Архивировано 20 августа 2018 года..
- ↑ H. Brötz, M. Josten, I. Wiedemann, U. Schneider, F. Götz. Role of lipid-bound peptidoglycan precursors in the formation of pores by nisin, epidermin and other lantibiotics // Molecular Microbiology. — 1998-10. — Т. 30, вып. 2. — С. 317—327. Архивировано 20 августа 2018 года..
- ↑ Joseph A. Krzycki. The direct genetic encoding of pyrrolysine // Current Opinion in Microbiology. — 2005-12. — Т. 8, вып. 6. — С. 706—712. Архивировано 20 августа 2018 года..
- ↑ 12,0 12,1 12,2 12,3 12,4 12,5 12,6 Березов Т.Т., Коровкин Б.Ф. Классификация аминокислот // Биологическая химия. — 3-е изд., перераб. и доп.. — М.: Медицина, 1998. — 704 с..
- ↑ A Production of Amino Acids Under Possible Primitive Earth Conditions by Stanley L. Miller.
- ↑ Коденцова, В. М. Функциональный ингредиент таурин: адекватные и клинически эффективные дозы / В. М. Коденцова, Д. В. Рисник, О. Б. Ладодо // Медицинский совет : журн. — 2022. — Т. 16, № 14. — С. 88–95..
- ↑ Садовникова М. С., Беликов В. М. Пути применения аминокислот в промышленности. //Успехи химии. 1978. Т. 47. Вып. 2. С. 357―383..