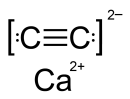Углерод

| Обозначение | С |
| Период | II |
| Группа | IVA |
| Атомная масса, а.е.м. | 12,011 |
| Атомный номер | 6 |
| Распределение электронов | 1s²2s²2р² |
| Температура плавления | 3750°С (графит) при давлении 12 мПа |
| Электроотрицательность (по Полингу) | 2,55 |
| Степень окисления | +4, +3, +2, +1, 0, −1, −2, −3, −4 |
| Молярный объём | 5,3 см³/моль |
| Плотность (н.у.) | 2,26 г/см³ (графит), 3,52 г/см³ (алмаз) |
Углеро́д — шестой элемент Периодической системы химических элементов Дмитрия Ивановича Менделеева, международное название «Carboneum» происходит от лат. carbo (уголь)[1]. Химическая формула углерода — С. Расположен во втором периоде в главной подгруппе четвёртой группы, неметалл. При нормальных условиях агрегатное состояние углерода — твёрдое вещество с атомной кристаллической решеткой. Может существовать в следующих аллотропных модификациях: алмаз, графит, кокс, древесный уголь, сажа. Природный углерод состоит из смеси двух стабильных изотопов 12С (98,892 %) и 13С (1,108 %). В небольшом количестве углерод существует в виде радиоактивного изотопа 14С с относительной атомной массой 14. На образовании и распаде 14С основан метод радиоуглеродного датирования, широко применяющийся в четвертичной геологии и археология. Впервые получил углерод в свободном виде английский химик Смитсон Теннант в 1791 году. Углерод — биогенный элемент, составляющий основу жизни на нашей планете, структурная единица органических соединений, он участвует в построении живых организмов, обеспечивает их жизнедеятельность[2].
История открытия углерода
Углерод известен как уголь, копоть, сажа, алмаз, графит. В 1778 году Карлом Вильгельмом Шееле, нагревая графит с селитрой, обнаружил, что при этом, как и при нагревании угля с селитрой, выделяется оксид углерода (IV) или углекислый газ. Химический состав алмаза был установлен в результате опытов Антуана Лорана Лавуазье в 1772 году после изучения горения алмаза на воздухе и исследований Смитсона Теннанта в1797 году, доказавшего, что одинаковые количества алмаза и угля дают при окислении равные количества углекислого газа. Углерод как химический элемент был признан только в 1789 Антуаном Лораном Лавуазье[2].
Впервые «чистый уголь» был исследован им, как процесс сжигания в воздухе и кислороде. в 1787 году Гитоном де Морво, Антуаном Лораном Лавуазье, Клодом Луи Бертолле и Антуаном Франсуа Фуркруа было предложено название «углерода» (carbone) вместо французского «чистый уголь» (charbone pur). Первым получил свободный углерод английский химик Смитсон Теннант в 1791 году, пропуская пары фосфора над прокалённым мелом. При этом образовывался фосфат кальция и углерод. Алмаз сгорал без остатка при сильном нагревании. Процесс горения алмаза был известен с 1751 года во времена французского короля Франца Первого. После повторного сжигания алмаза с помощью зажигательной машины А. Лавуазье пришел к выводу, что алмаз — это кристаллический углерод. В алхимическом периоде графит — второй аллотроп углерода, который назвали «plumbago» и считали его видоизмененным свинцовым блеском[2].
В 1740 году Иоганном Генрихом Поттом было обнаружено отсутствие примеси свинца в графите. В 1779 году Карл Шееле счёл графит сернистым телом особого рода, особым минеральным углём, содержащим связанную «воздушную кислоту» — СО2 или углекислый газ. В 1760 году Гитон де Морво превратил алмаз в графит, а затем в угольную кислоту при нагревании. В начале XIX века Александром Ивановичем Шерером, Василием Михайловичем Севергиным старое слово «уголь» в русской химической литературе иногда заменялось словом «углетвор», с 1824 года Михаил Фёдорович Соловьёв ввёл название «углерод».
Углерод имеет следующие названия:
- международное — «Carboneum»;
- немецкое — «Kohlenstoff» (происходит от «Kohle» — уголь);
- древнерусское — «угорати», или «угарати» (обжигать, опалять) имеет корень гар, или гор, с возможным переходом в гол[2].
Нахождение углерода в природе. Получение
В природе углерод встречается в виде простых веществ — алмаза и графита, он входит в состав углекислого газа — СО2, карбонатов: доломита — СаMg (CO3)2, мрамора — CaCO3, природного газа, нефти, каменного угля. Углерод образует огромное количество органических и неорганических соединений. Многообразие соединений углерода определило возникновение одного из основных разделов химии — органической химии. Углерод входит в состав всех органических веществ: предельных, непредельных и ароматических углеводородов, спиртов, альдегидов, карбоновых и нуклеиновых кислот, белков, жиров и углеводов[3].
Углерод получают пиролизом углеводородов при нагревании и без доступа воздуха. Например, при пиролизе метана образуется углерод С и выделяется две молекулы водорода Н2[4]:СН4 → С + 2Н2.
Для получения графита в качестве исходного сырья используют нефтяной или металлургический кокс, антрацит и пек. Отдельные частицы исходных углеродных материалов в результате карбонизации при обжиге связываются в монолитное твердое тело, которое затем подвергают кристаллизации (графитации). По одному из методов кокс или антрацит измельчают и смешивают с пеком в определенных соотношениях, прессуют при давлении до 250 МПа, а затем подвергают обжигу при 1200 °С и графитации при нагревании до 2600 — 3000 °С. Для уменьшения пористости полученный графит пропитывают синтетической смолой или жидким пеком, после чего снова подвергают обжигу и графитации. В производстве графита повышение плотности пропитку, обжиг и графитацию повторяют до пяти раз[5].
Строение атома углерода
Углерод находится в четвёртой А группе во втором периоде Периодической системы химических элементов Д. И. Менделеева. Заряд ядра атома углерода равен +6. На внешнем энергетическом уровне атома углерода находятся четыре валентных электрона. В невозбуждённом состоянии два из них являются спаренными, а два — неспаренными. За счёт образования трёх ковалентных связей, две из которых образуются по обменному механизму, а одна по донорно-акцепторному, в невозбуждённом состоянии максимальная валентность углерода равна трём. При этом атом углерода выступает в роли донора, предоставляя для образования связи неподелённую электронную пару. В нейтральном атоме углерода находится шесть электронов. Два электрона образуют первый электронный слой и находятся на 1s электронном подуровне, следующие четыре электрона образуют второй электронный слой, два из которых находятся на 2s электронном подуровне, а два других — на 2р электронном подуровне. Нейтральный атом углерода имеет электронно-графическую конфигурацию 1s²2s²2р² и поэтому в основном состоянии двухвалентен[3][4].
При поглощении энергии электроны внешнего уровня атома углерода распариваются и атом переходит в «возбуждённое» состояние, в котором на внешнем уровне содержится четыре неспаренных электрона. В большинстве химических соединений углерод может проявлять валентность равную четырём при переходе одного электрона из состояния 2s в 2р. При таком переходе атома углерода из нейтрального состояния в «возбуждённое» происходит «распаривание» электронов. Этому возбуждённому состоянию атома углерода соответствует электронная конфигурация 1s²2s¹2p³[3][4].
Физические свойства
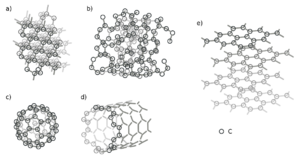
Углерод относится к неметаллам, имеет твёрдую структуру и низкую температуру плавления, высокую термическую и электрическую проводимость. Углерод имеет несколько кристаллических модификаций: алмаз, графит, графен, карбин[6].
Алмаз — кристаллическое, твёрдое вещество. Кристаллы алмаза имеют гранецентрированную кубическую решётку: а = 3,560. При нормальных условиях алмаз метастабилен. При температурах выше 1400°С в вакууме или в инертной атмосфере алмаз может превратится в графит[6].
Графит — серо-чёрная, непрозрачная, жирная на ощупь, чешуйчатая, очень мягкая масса с металлическим блеском. Графит термодинамически стабилен при нормальных условиях. Графит способен возгоняться при атмосферном давлении и температуре около 3700°С. При давлении выше 1051 кгс/см2 и температуре выше 3700°С может быть получен жидкий углерод. В основе строения «аморфного» углерода лежит структура мелкокристаллического графита. Такой углерод не представляет собой самостоятельной модификации, как кокс, сажа, древесный уголь. При нагревании выше 1500—600°С без доступа воздуха «аморфный» углерод превращается в графит. Физические свойства «аморфного» углерода зависят от наличия примесей и дисперсности частиц. У «аморфного» углерода плотность, теплоёмкость, теплопроводность и электропроводность всегда выше, чем у графита[6].
Карбин представляет собой мелкокристаллический порошок чёрного цвета с плотностью 1,9 — 2 г/см3 и был получен искусственным способом. Структура карбина представляет собой длинные цепочки атомов углерода, уложенных параллельно друг другу[7].
Графен имеет двухмерную решётку молекул, состоящих из слоя атомов углерода толщиной в одну молекулу (мономолекулярный слой), по форме напоминающую пчелиные соты. Впервые графен получен и исследован Александром Геймом и Константином Новосёловым, ставшими за это открытие лауреатами Нобелевской премии по физике в 2010 году[8].
Фуллерены представляют собой замкнутые молекулы, состоящие из пятиугольников и шестиугольников с атомами углерода в вершинах. Размер молекул фуллерена варьируется от C20 до C540. Наиболее распространённым и хорошо изученным является фуллерен C60 или бакминстерфуллерен, молекула которого представляет полиэдром, состоящий из 12 пятиугольников и 20 шестиугольников. В 1970 году японский учёный Осава Эйдзи впервые предположил о существовании фуллерена С60. При получении сажи в 1986 году был предложен возможный механизм образования С60. Присутствие фуллерена С60 в составе сажи было подтверждено в 1987 году. В сентябре 1990 года были получены макроскопические количества С60 и с помощью рентгенофазового анализа был определён диаметр молекулы С60, равный примерно 7 Å. В 1996 году учёным Крото Харалду (Гарольду) Уолтеру, Кёрлу Роберту и Ричардом Смолли была присуждена Нобелевская премия по химии за открытие фуллерена.[9]
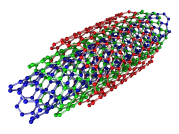
Углеродные нанотрубки (УНТ) представляют собой наноразмерные цилиндры, сформированные свёрнутым графеновым листом. В трубчатой молекуле УНТ каждый атом углерода находится в состоянии смешанной sp²–sp³–гибридизации. Свёрнутый графеновый слой в углеродной нанотрубке представлен гексагональной структурой, состоящей из углеродных шестигранников, в которых атомы углерода связаны друг с другом прочной ковалентной связью. Открытие многостенных углеродных нанотрубок приписывается Иидзиме Сумио, опубликовавшим в журнале «Nature» в 1991 году новаторскую статью, посвящённую их образованию в твёрдом осадке, образующемся на катоде в ходе электродуговых экспериментов по получению фуллеренов. Одностенные нанотрубки были открыты в 1993 году Иидзимой Сумио в соавторстве с Тосинари Итихаси из японской корпорации «NEC» и Д. Бетьюном в ходе неудачной попытки получения многостенных углеродных нанотрубок, внутреннее пространство которых заполнено переходными металлами.[10]
Сравнение аллотропных модификаций алмаза и графита приведены в таблице 1[6].
| Свойство | Алмаз | Графит |
|---|---|---|
| Кристаллическая решетка | атомная | атомная |
| Вид химической связи | ковалентная неполярная | ковалентная неполярная |
| Растворимость в воде | нерастворим | нерастворим |
| Структура | тетраэдр | слоистая |
| Цвет | прозрачные кристаллы | серый, блеск металлический |
| Твёрдость по шкале Мооса | 10, принят за абсолют | 1 — 2 |
| Плотность, г/см³ | 3,47 — 3,55 | 2,08 — 2,2 |
| Электропроводность | изолятор, не проводит электрический ток | проводит электрический ток |
Химические свойства углерода
Углерод малоактивный неметалл, на холоде реагирует только с фтором — F2 с образованием тетрафторида углерода CF4. В химических реакциях с неметаллами и сложными веществами углерод проявляет восстановительные свойства:
CO2 + C = 2CO — реакция протекает при нагревании до температуры выше 900°С.
При пропускании водяных паров через раскаленный уголь образуется оксид углерода (II) СО и водород:
C + H2O = CO + H2 — процесс возможен при нагревании до температуры выше 1200°С, смесь CO + H2 — синтез–газ для получения метанола в промышленности;
C + 2H2O = CO2 + H2 — реакция осуществима при нагревании до температуры выше 1000°С;
Углерод восстанавливает многие металлы из их оксидов — карботермия[6]:
2ZnO + C = 2Zn + CO2
CuO + C = Cu + CO
Данные реакции являются основным способом получения металлов средней активности в промышленности (металлургия и пирометаллургия)[6].
Концентрированные серная и азотная кислоты при нагревании окисляют углерод до оксида углерода (IV)[6]:
C + 2H2SO4 = CO2 + 2SO2 + 2H2O;
C + 4HNO3 = CO2 + 4NO2 + 2H2O;
3C + HNO3 = 3 CO2 + 4 NO + 2 H2O.
В реакциях с металлами и водородом проявляет слабые окислительные свойства[11]:
С + 2Ca = CaС2 — реакция протекает в присутствии никель-содержащего катализатора, продуктом реакции является карбид кальция, CaС2;
С + Si = SiC — продукт реакции карборунд, CSi, катализатором служит никель;
3C + CaO = CaC2 + CO — продукт реакции карбид кальция, CaС2 и оксид углерода (II), СО.
При нагревании углерод взаимодействует с кислородом, образуя оксиды углерода СО и СО2:
2С + О2 = 2СО;
С + О2 = СО2[11].
При взаимодействии карбида алюминия Al4С3 с водой H2O образуется метан СН4
Al4С3 + 12H2O = 4Al(ОН)3 + 3СН4↑,
а при взаимодествии с карбидом кальция СаС2 образуется этин (ацетилен) С2Н2:
СаС2 + 2H2O = Са(ОН)2 + С2Н2↑
При температуре 750 — 900 °С углерод взаимодействует с серой S с образованием сульфида углерода (сероуглерода) CS2:
С + 2S → CS2 — этот способ используют в промышленных масштабах для получения сероуглерода CS2
При нагревании углерода С и водорода Н2 в присутствии катализатора можно получить метан CH4:
C + 2H2 = CH4↑.
Углерод образует следующие соединения, характристика которых приведена в таблице.
| Соединения углерода | Определение | Химическая формула, название | Свойства |
|---|---|---|---|
| Оксид углерода (IV)[12] | Соединения углерода с кислородом | При обычных условиях диоксид углерода бесцветный газ, в 1,5 раза тяжелее воздуха. При давлении 0,6 МПа превращается в жидкость, которую хранят в стальных баллонах. При быстром выливании из баллона вследствие испарения превращается в белую снегообразную массу. Твёрдый диоксид углерода называют «сухим льдом».
Образуется в природе при окислении органических веществ (при гниении растительных и животных остатков, дыхании, сжигании топлива). В больших количествах выделяется из вулканических трещин и из вод минеральных источников. В лабораторных условиях диоксид углерода получают в аппарате Киппа действием на мрамор СаСО3 соляной кислотой НСl: СаСО3 + 2НСl = СаСl2 + H2O + СО2↑. В промышленности диоксид углерода получают при обжиге известняка: СаСО3 = СаО + СО2↑[12] | |
| Угольная кислота[13] | Слабая двухосновная кислородсодержащая кислота, средней силы (для первой стадии диссоциации pKа = 3,45); так как содержание Н2СО3 в растворе очень мало, то и кислотность раствора очень низкая[13]. | В твёрдом состоянии существуют α– и β–формы угольной кислоты (плотность 1,49 г/см³ и 1,67 г/см³ соответственно), которые выше 200 К возгоняются без разложения и стабильны в газовой фазе до 210 К и 230 К.
Образуется при растворении диоксида углерода в воде, равновесие смещено влево: СО2 + H2O ↔ Н2СО3 Образует кислые (гидрокарбонаты) и средние (карбонаты) соли. Угольная кислота – одно из звеньев глобального углеродного цикла в природе, образуется при поглощении СО2 океанами, участвует в геологических процессах, дыхании человека, животных и растений, регулирует величину рН крови человека и теплокровных животных[13]. | |
| Оксид углерода (II)[14] | Монооксид углерода, шесть валентных атомов углерода размещены на трёх связывающих орбиталях и образуют и образуют тройную связь, харатеризующуюся высокой прочностью[14]. | Оксид углерода (II) — бесцветный ядовитый газ, не имеет запаха, конденсируется в жидкость при температуре –192 °С, затвердевает при температуре −205 °С. В воде малорастворим и химически с ней не взаимодействует .
Образуется из простых веществ: С + ½О2 = СО + Q. На воздухе СО горит голубоватым пламенем с выделением большого количества теплоты Q c образованием диоксида углерода СО2. При температуре о 400 °С до 500 °С протекает эндотермическая реакция: С + СО2 = 2СО - Q. Данная реакция используется в доменном процессе, в газогенераторах. В лаборатории оксид углерода (II) можно получить приливая муравьиную кислоту к нагретой серной кислоте: НСООН = СО + H2O[14]. | |
| Карбиды[15] | Соединения углерода с металлами и элементами, которые по отношению к углероду являются электроположительными. Получают прокаливанием металлов или их оксидов с углём[15]. | Кристаллические тела, карбиды металлов главных подгрупп (I, II, III групп) периодческой системы химических элементов представляют собой солеобразные соединения с преобладанием ионной связи.
В карбидах кремния и бора связь между атомами ковалентная и они характеризуются высокой твёрдостью, тугоплавкостью и химической инертностью. Большинство металлов побочных групп (IV — VIII) периодческой системы химических элементов образуют карбиды с химической связью, близкой с металлической. Они обладают значительной электрической проводимостью,высокой твёрдостью и тугоплавкостью. Эти свойства объясняются наличием в чугунах и сталях карбида железа[15]. | |
| Сероуглерод[16] | Соединение углерода с серой, сернистый аналог угольного ангидрида[16]. | Бесцветная жидкость с эфирным запахом, плотность 1261 кг/м³, температура кипения 46,25 °C, растворяется во многих органических растворителях — этаноле, диэтиловом эфире, хлороформе , плохо растворима в воде (при –3 °C образует гидрат 2CS2·Н2О), под действием света разлагается, продукты разложения имеют жёлтый цвет и очень неприятный запах.
Промышленный яд, огнеопасен. В инертной атмосфере выше 300 °C разлагается с образованием графита и паров серы S; температура вспышки –30 °C, температура самовоспламенения 100 °C, горит с образованием СО2 и SO2, смеси с воздухом (1,25 — 50 % CS2 по объёму) взрывоопасны. Разлагается водой при 150 °C с выделением сероводорода H2S; легко обменивает серу S на кислород O2 при нагревании с оксидами металлов; с сульфидами щелочных металлов образует тиокарбонаты, со спиртовыми растворами щелочей — ксантогенаты[16][17] |
Применение углерода
Соединения углерода широко применяются в народном хозяйстве[6].
| Соединение углерода | Применение |
|---|---|
| Графит | в металлургии для изготовления плавильных тиглей и лодочек, труб, испарителей, кристаллизаторов, футеровочных плит, чехлов для термопар, в качестве противопригарной "присыпки" и смазки литейных форм, для изготовления грифелей карандашей, угольных электродов, плавильных тиглей, замедлителя нейтронов в ядерных реакторах, вкладышей для подшипников скольжения, втулок для поршневых штоков, уплотнительных колец для насосов и компрессоров, как смазка для нагретых частей машин и установок[3][5] |
| Алмаз | изготовление ювелирных изделий, режущих инструментов, абразивных материалов, в буровом оборудовании[3] |
| Углерод | восстановитель железа, кремния, изготовление активированного угля (адсорбента) для очистки воздуха и растворов, носителей для катализаторов полимеризации[3] |
| Карбин | в изготовлении источников тока в электронике, космонавтике, авиации, медицине, оптике, микроволновой и электрической технологиях[7] |
| Графен | в изготовлении солнечных батарей; для водоочистки, фильтрации и опреснения морской воды; для изготовления жидкокристаллических мониторов, светоизлучающих диодов, транзисторов, микросхем, сенсорных панелей; в графеновых аккумуляторах и источниках энергии; в медицине; для создания суперкомпозитов; для производства нанобетона; для очистки воды от радиоактивных загрязнений[8] |
| Фуллерен[9] | в медицинской химии и биохимии в качестве антиоксидантов и антибактериальных агентов; внедрение атомов металлов в решётку фуллерена открывает возможности для создания контрастных веществ для магнитно-резонансной томографии; ценный химиотерапевтическй агент для лечения рака костей и лейкемии; в качестве носителей лекарств из–за их хорошей биосовместимости; в устройствах фотовольтаики, фотокатализаторах и органической электронике, поскольку они хорошо сочетаются с донорами электронов, образуя пары донор — акцептор; в фотоэлектрических устройствах, электрохимических материалах, легирующих примесях для проводящих полимерных плёнок, газовых сенсорах и сверхпроводниках; в качестве электрода для суперконденсаторов; являются подходящими молекулами для хранения водорода, благодаря возможности гидрирования связей C—C с образованием связей C—H, которые разрушаются при нагревании с высвобождением водорода[9] |
| Углеродистые нанотрубки[10] | в сферах строительства, экологии, катализа (в качестве подложки для металлических катализаторов (Pd, Au, Ru, Rh, CeO2, RuO2, MgO) для высокотемпературных каталитических процессов, таких как риформинг и синтез Фишера – Тропша), разработки электронных устройств (в качестве анодного материала для литий-ионных аккумуляторов и электронных сенсоров) и биотехнологии (в качестве основы для доставки лекарств, биосенсоров); в качестве сорбентов катионов тяжёлых металлов (Hg(II), Pb(II), Cr(VI), Cd(II), As(III)/(V), Co(II), U(VI)) для очистки сточных вод[10]. |
Литература
- Общая химия. Учебник / под ред. С. Ф. Дунаева. — М.: Academia, 2017. — 160 c.
- Общая и неорганическая химия: учебное пособие / под ред. В. В. Денисова, В. М. Таланова. — Рн/Д: Феникс, 2018. — 144 c.
- Глинка Н. Л. Общая химия: учебное пособие для СПО. — М.: КноРус, 2019. — 360 c.
- Глинка Н. Л. Общая химия: учебное пособие для вузов / под ред. А. И. Ермакова. — М.: Интеграл-Пресс, 2003. — 728 с.
- Карапетьянц М. Х. Общая и неорганическая химия: учебник / под ред. М. Х. Карапетьянц, С. И. Дракин. — М.: Ленанд, 2018. — 600 c.
- Большая Медицинская Энциклопедия (БМЭ) / под ред. Б. В. Петровского , 3-е издание — М.: Академия медицинских наук СССР, 1974 — 1989 год. — т. 23.
Примечания
- ↑ Большая советская энциклопедия / Глав. ред. А. М. Прохоров. — Москва: Советская энциклопедия, 1969–1978. — 631 с.
- ↑ 2,0 2,1 2,2 2,3 Углерод, Carboneum, С (6). Химический факультет МГУ. Дата обращения: 3 ноября 2023.
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 Углерод (C). Просто о сложном. Химия - это просто. Дата обращения: 5 ноября 2023.
- ↑ 4,0 4,1 4,2 Зломанов, В. П. Углерод. Большая Российская энциклопедия (22 мая 2023). Дата обращения: 6 января 2024.
- ↑ 5,0 5,1 Костиков, В. И. Графит. Химическая энциклопедия. Дата обращения: 5 января 2024.
- ↑ 6,0 6,1 6,2 6,3 6,4 6,5 6,6 6,7 Углерод: его применение и значение в науке и технике. Химия это интересно. Дата обращения: 5 ноября 2023.
- ↑ 7,0 7,1 Кулакова И. И. Карбин – третья аллотропная модификация углерода: открытие и свойства // Первое сентября : газета. — 2007. — № 13.
- ↑ 8,0 8,1 Новосёлов, К. С. Графен. Большая Российская энциклопедия (4 декабря 2023). Дата обращения: 6 января 2024.
- ↑ 9,0 9,1 9,2 Иванов, А. В. Фуллерены (25 августа 2022). Дата обращения: 5 января 2024.
- ↑ 10,0 10,1 10,2 Иванов, А. В. Углеродные нанотрубки (18 мая 2022). Дата обращения: 5 января 2024.
- ↑ 11,0 11,1 Характерные химические свойства оксидов: основных, амфотерных, кислотных.. Наука для тебя - Образовательный портал по Химии.. Дата обращения: 15 ноября 2023.
- ↑ 12,0 12,1 Раков, Э. Г. Диоксид углерода. Большая Российская энциклопедия (17 января 2023). Дата обращения: 5 января 2024.
- ↑ 13,0 13,1 13,2 Раков, Э. Г. Угольная кислота. Большая Российская энциклопедия (2023-07-1). Дата обращения: 5 января 2024.
- ↑ 14,0 14,1 14,2 Раков, Э. Г. Оксид углерода. Большая Российская энциклопедия (9 января 2023). Дата обращения: 5 января 2024.
- ↑ 15,0 15,1 15,2 Раков, Э. Г. Карбиды. Большая Российская энциклопедия (6 апреля 2023). Дата обращения: 5 января 2024.
- ↑ 16,0 16,1 16,2 Бронштейн, E. 3., Милков, Л. Е.,Точилкин, А. И. Сероуглерод. Большая Медицинская энциклопедия. Дата обращения: 5 января 2024.
- ↑ Редакция химических наук. Сероуглерод. Большая Российская энциклопедия (11 августа 2022). Дата обращения: 5 января 2024.
Данная статья имеет статус «готовой». Это не говорит о качестве статьи, однако в ней уже в достаточной степени раскрыта основная тема. Если вы хотите улучшить статью — правьте смело! |