Метанол
| Метанол | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Мети́ловый спирт, карбино́л |
| Традиционные названия | Метанол |
| Хим. формула | |
| Рац. формула | |
| Физические свойства | |
| Состояние | Жидкость |
| Молярная масса | 32,04 г/моль |
| Плотность | (20 °C) 0,7914 г/см3 г/см³ |
| Динамическая вязкость | 0,817 мПа·с (при 20 °C) |
| Термические свойства | |
| Температура | |
| • плавления | −93,9 °C |
| • кипения | +64,96 °C |
| • вспышки | +15,6 °C |
| • самовоспламенения | +440 °C |
| Пределы взрываемости | 6,7–36,5 % |
| Критическая точка | |
| • температура | +239,49 °C |
| Мол. теплоёмк. | 81,60 Дж/(моль·К) |
| Энтальпия | |
| • образования | −238,57 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | Неограниченно |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
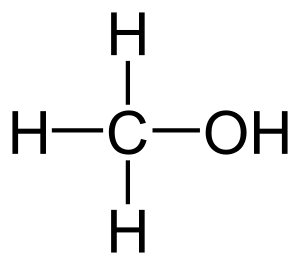
Метанол — первый представитель гомологического ряда одноатомных спиртов. С воздухом в объёмных концентрациях 6,98 % — 35,5 % образует взрывоопасные смеси при температуре +8 °С, обладает хорошей растворимостью в воде. Опасный для человека яд, контаминант[2].
Метиловый спирт (древесный спирт, карбинол, метанол, метилгидрат, гидроксид метила) — органическое вещество, бесцветная ядовитая жидкость с характерным запахом, подобным запаху этилового спирта. Химическая формула: CH3OH. Метиловый спирт — один из важных по значению крупнотоннажных продуктов химической промышленности. Используется в качестве полупродукта для промышленных синтезов. Основные потребители — производства формальдегида, синтетических смол, пентаэритрита, уротропина и многих других продуктов на его основе. Использование в составе алкогольных напитков может привести к пищевому отравлению или смерти[3].
История открытия
Метанол впервые был обнаружен Боулем в 1661 году в продуктах сухой перегонки древесины[4]. Он назвал его «спиртом из самшита», потому что он получил его перегонкой древесины самшита. Его химическую формулу, или элементный состав, CH3OH, в 1834 году определили Жан Батист Дюма и Эжен Пелиго. Они также ввели в органическую химию название «метилен», от греческих слов «methu» и «hyle», что означает «вино» и «лес» соответственно.
Поскольку в составе метанола всего один атом углерода, это простейший спирт. Метанол обычно называют древесным спиртом потому, что вначале он стал известен как побочный продукт производства древесного угля, образующийся из древесины при сухой перегонке. Из 1 тонны древесины получают 10-20 литров метанола наряду с другими продуктами. В 1830 годах полученный таким способом метанол стали использовать как топливо для освещения, приготовления пищи, обогрева, но позже его вытеснило более дешевые топливо — керосин[4].
В 1857 году Бертло синтезировал метанол омылением метилхлорида. Вплоть до 1920-х годов древесина была единственным сырьём для получения метанола, хотя потребности химической промышленности в нём непрерывно возрастали. Во время Первой мировой войны весь метанол наряду с ацетоном и другими важными химическими соединениями получали в углевыжигательных печах[4].
С началом промышленной революции уголь заменили на древесину во многих областях применения. Были разработаны процессы парофазной высокотемпературной газификации угля и кокса, в результате которой получали газы, содержащие оксид углерода и водород. Эти газы нашли применение для уличного освещения городов под названием «светильный газ». Используя водород, произведённый по той же технологии, Фриц Габер и Карл Бош разработали промышленный метод гидрирования молекулярного азота до аммиака при очень высоких температурах и давлениях. Это позволило разработать другие промышленные химические процессы переработки аналогичного сырья в условиях высоких температур и давлений, например, синтез метанола. Так как синтез метанола аналогичен с синтезом аммиака, то, их часто производят на одном и том же заводе. Синтез метанола путем взаимодействия монооксида углерода с водородом впервые предложил в 1905 году французский химик Поль Сабатье[4].
В 1913 году компания «Badische Anilin und Soda Fabrik (BASF)» взяла за основу работы Пола Алвина Митташа и Кристиана Шнайдера и запатентовала процесс синтеза метанола из синтез-газа, полученного из угля в присутствии цинкхромового оксидного катализатора при температуре 300—400 °С и давлении 250—350 атмосфер. После Первой мировой войны BASF возобновила свои исследования по синтезу метанола и в 1923 году построила в Лойне (Германия) первую промышленную установку по синтезу метанола при высоком давлении. В период между 1923 годом и 1926 годом Ф. Фишер[5] и Г. Тропш, химики лаборатории по исследованию угля в Германии в городе Мюльхайме, опубликовали подробные результаты изучения возможности синтеза углеводородов, в том числе синтеза метанола из синтез-газа (смеси угарного газа и водорода). Эти работы легли в основу технологического процесса, известного как синтез Фишера — Тропша[4].
В 1927 году в США корпорация «Commercial Solvent Corporation» использовала технологию синтеза под высоким давлением для превращения в метанол смесей диоксида углерода с водородом, образующихся как побочные газообразные продукты ферментации. В то же время компания «DuPont» на том же самом заводе приступила к производству метанола и аммиака из синтез-газа, полученного из угля. В 1940-е годы в США был внедрен технологический процесс парофазной конверсии природного газа, в основу которого легли исследования, проведенные в BASF в 1930-е годы. С тех пор уголь стал все меньше и меньше использоваться как сырьё для получения синтез-газа, и ему на смену пришёл более чистый и дешёвый природный газ, запасы которого в недрах оказались огромными[4].
В 1930-е годы для синтеза метанола стали использовать в качестве сырья сырую нефть и керосин в небольших количествах. В паровой конверсии метана получался синтез — газ высокого качества. Это позволило внедрить технологии синтеза метанола при низком давлении. В 1966 году «Компания Imperial Chemical Industries (ICI)» впервые получила метанол при давлении в 80 кгс/см². Процесс протекал при 250-300 °С в присутствии медь — цинкового катализатора (CuО/ZnO). В настоящее время процесс синтеза метанола при низком давлении широко используется в органическом синтезе. Применение активных катализаторов стало возможным благодаря использованию в качестве сырья синтез-газа с пониженным содержанием каталитических ядов (сера, её органические и неорганические соединения, и карбонилы металлов). Позже компания «Lurgi» реализовала собственный процесс при ещё более низких рабочих температуре и давлении (230—250 °С, 40-50 кгс/см²)[4].
За последние 40 лет процесс синтеза метанола из оксидов углерода (в СО присутствует некоторое количество диоксида углерода) и водорода был усовершенствован и доработан. По этой технологии селективность по метанолу (превышает 99,8 %, а энергетический коэффициент полезного действия (КПД) доходит почти до 75 %. Сегодня в мире почти весь метанол получают из синтез-газа. В настоящее время исследовательские работы направлены на развитие новых способов синтеза метанола при ещё более низких температурах и давлении. Изучается возможность использования в качестве сырья смеси оксидов углерода и водорода из разнообразных источников, а также возможность синтеза метанола прямым окислением метана, минуя стадию образования синтез-газа, а также через гидрирование диоксида углерода, полученного химической утилизацией углекислого газа. С точки зрения экономии энергоресурсов такой метод получения метанола является наилучшим.[4].
Физические свойства
Метанол — очень токсичное органическое вещество, яд, действующий на нервную и сосудистую системы. При обычных условиях это бесцветная, легколетучая, горючая жидкость, иногда с запахом, напоминающим запах этилового спирта. На организм человека метанол действует опьяняющим образом и является сильным ядом, вызывающим потерю зрения (при приёме во внутрь (5-10 мл метилового спирта возможно тяжёлое отравление) и, в зависимости от дозы, смерть (при попадании 30 мл и более)[6].
Теплопроводные свойства метанола в два раза меньше, чем у бензина. Метанол участвует в образовании взрывоопасных веществ из-за собственной горючести. С воздухом в объёмных концентрациях (6,72 — 36,5 % метиловый спирт образует взрывоопасные смеси; температура вспышки +15,6 °С. Метиловый спирт смешивается во всех соотношениях с водой и большинством органических растворителей, обладает всеми свойствами одноатомных спиртов[7][8].
Физические характеристики метанола приведены в таблице 1[9].
| Показатель | Значение | Показатель | Значение |
|---|---|---|---|
| молекулярная масса | 32,40 | теплота парообразования, ккал/моль | 8,94 |
| плотность, г/см³ (при 20 °С) | 0,81 | теплота сгорания, ккал/моль:
жидкого газообразного |
173,65
177,40 |
| вязкость, мПа — с | 0,817 | плотность и вязкость метанола
уменьшаются при повышении температуры |
— |
| температура кипения, °С | 64,70 | температура плавления, °С | - 97,68 |
Строение
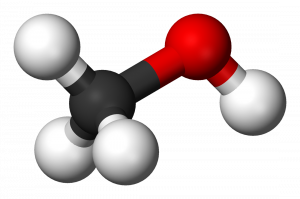
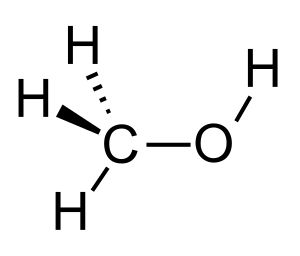
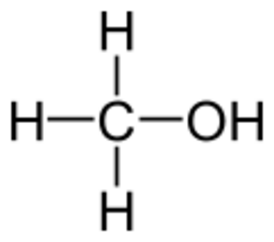
Метанол — это кислородсодержащее органическое вещество с общей формулой СnH2n+2O. Молекулярная формула метанола — CH₃OH. В составе метилового спирта 4 атома водорода (37,5 % по массе) и один атом углерода (12,6 % по массе) и кислорода (49,9 % по массе)[7].
Гидроксильная группа (— ОН) в структуре молекулы метанола является функциональной группой и определяет его физические и химические свойства. В молекуле метанола присутствуют ковалентные полярные химические связи (С — Н) и ковалентные неполярные химические связи (С — С, О — Н и С — О). Электроотрицательности атомов водорода (ЭО = 2,1) и углерода (ЭО = 2,4) меньше электроотрицательности атомов кислорода (ЭО = 3,5). Высокая температура кипения метанола и хорошая его растворимость в воде объясняется полярностью связи в гидроксильной группе (— ОН). Электронная плотность обеих связей смещена к более электроотрицательному атому кислорода. Атом кислорода в молекуле метанола находится в состоянии sp³ — гибридизации. В образовании химических связей с атомами углерода и водорода участвуют две 2sp3 — гибридные орбитали, еще две 2sp3 — гибридные орбитали заняты неподеленными электронными парами атома кислорода. Поэтому валентный угол (C — О — H) близок к тетраэдрическому и составляет почти 108о[1].
Между молекулами спирта имеют место межмолекулярные водородные связи, которые способствуют притяжению и ассоциации молекул спиртов. Межмолекулярные водородные связи и объясняют высокую температуру кипения метанола и жидкое агрегатное состояние при обычных условиях. Водородные связи образуются в водных растворах между молекулой метанола и воды, то есть молекулы метанола в воде гидратируются. Этим объясняется хорошая растворимость метанола в воде[1].
Химические свойства
Метанол обладает свойствами очень слабого основания и слабой кислоты. Это можно объяснить наличием алкильной ((метил СН₃ —) и гидроксильной (— ОН) групп. Метанол — неэлектролит, в водном растворе на ионы не диссоциирует, поэтому кислотные свойства более слабые по сравнению с водой[12].
Метанол с растворами щелочей практически не реагирует, образующиеся в результате гидролиза алкоголяты почти полностью распадаются[12]:
СН₃ОН + NaOH ↔ СН₃ОNa + НOH
Метанол взаимодействует с щелочными и щелочноземельными металлами, образуя при этом алкоголяты, проявляя свойства кислот[12]:
2СН₃ОН + 2Na ↔ СН₃ОNa + Н ― H
Метилаты под действием воды полностью гидролизуются, при этом выделяется метанол и гидроксид металла.
СН₃ОNa + НOH ↔ СН₃ОН + NaOH
При взаимодействии метанола с галогеноводородами (HCl, HBr, HI) группа ― ОН замещается на галоген и образуется галогеналкан (метилхлорид или хлорметан)[12]:
СН₃ОН + НCl ↔ СН₃Cl + НOH
При окислении метанола кислородом в присутствии серебряного катализатора образуется формальдегид[12]:
СН₃ОН + 0,5О2 ↔ НСНО + НОН
При окислении метанола оксидом меди (II) при нагревании, метанол окисляется до метаналя (формальдегида) и медь восстанавливается до простого вещества[12].
С аммиаком метанол в паровой фазе в присутствии катализаторов (при 370-400 °С и повышенных давлениях образует метиламины[12]:
СН₃ОН + NH₃ ↔ CH₃NH2 + НОН
СН₃ОН + СН₃NН2 ↔ (CH₃)2NH + НОН
CH₃OH + (СН₃)2NH2 ↔ (СН₃)₃N + НОН
При повышенных температурах дегидратацией на катализаторе получают диметиловый эфир, относящийся к простым эфирам[12]:
2СН₃ОН ↔ (СН₃)2О + НОН
Сложные эфиры получаются этерификацией, при взаимодействии метанола, минеральных кислот и органических кислот. Этерификацией в химической промышленности получают различные метилхлориды, метилбромиды, метилнитраты, метилсульфаты и другие химические вещества[12]:
СН₃ОН + H2SO4 ↔ СН₃SО₃ОН + НОН;
СН₃ОН + СН₃СООН ↔ СН₃СООСН₃ + НОН
Метанол горит с выделением большого количества теплоты и с образованием углекислого газа и воды[12].
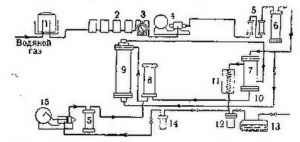
Промышленное получение
Метод синтеза метанола из оксида углерода(||) и водорода был разработан в 1913 г. компанией «Badische Anilin und Soda Fabrik (BASF)»[4].
Синтез ― газ (смесь СО и водорода) для синтеза метанола получают в результате конверсии (риформинга) углеводородного сырья: природного газа, коксового газа, жидких углеводородов (нефти, мазута) и твёрдого топлива (угля, сланцев). Исходный газ для синтеза метанола можно получить почти из всех видов сырья, которые используют при получении водорода для синтеза аммиака. Кроме того, в обеих технологических схемах используются схожие процессы и аппараты, поэтому производство метанола часто комбинируют с производством аммиака. Примером такого смешанного производства являются ОАО «Метафракс Кемикалс» (Пермский край, город Губаха), ОАО «Невинномысский Азот» (Ставропольский край, город Невинномысск) и НПО «Азот» (город Новомосковск)[13].
Синтез метанола протекает по гетерокаталитической реакции, которая обратимая, экзотермическая, протекающая в газовой фазе с уменьшением объёма[13]:
СО + Н2 ↔ СН₃ОН + 90,8 кДж
СО2 + 3Н2 ↔ СН₃ОН + Н2О — 49,6 кДж
Согласно принципа Ле-Шателье равновесие реакции можно сместить в сторону выхода продукта при повышении давления и понижении температуры. Но при низких температурах скорость реакции небольшая, поэтому необходимо нагревание реакционной смеси до температуры начала химической реакции синтеза. Синтез метанола осуществляют в присутствии катализаторов на основе оксида цинка и оксида меди. Поскольку катализаторы теряют свою активность при наличии в сырье сернистых соединений, то сырьё подвергают сероочистке. Применение цинк-медных катализаторов позволяет осуществлять процесс синтеза метанола при низких температурах (250—300 °С) и низком давлении (5-10 мПа). При синтезе метанола протекают побочные реакции, которые обуславливают бесполезный расход синтез — газа и удорожают очистку метанола[13].
Стадии получения метанола по технологии «Компании Imperial Chemical Industries (ICI)»[14]:
- сероочистка природного газа;
- паровая конверсия (риформинг) природного газа и водяного пара (температура 932 °С, давление 1,87 мПа, катализатор ― никельсодержащий) с получением синтез ― газа;
- синтез метанола (температура 240—270 °С, давление 8 мПа, катализатор ― медьсодержащий) с образованием метанола ― сырца, с массовой долей (метанола 84―86 %);
- ректификация метанола-сырца (отгонка легких фракций, основная ректификация) с получением готового продукта метанола-ректификата[14].
Производители метанола в России
Метанол — один из первых продуктов переработки природного газа. В России его производят 4,5 миллиона тонн в год, экспорт составляет около двух миллионов тонн в год. Метанол в России производят в компаниях «Метафракс», «Щекиноазот», «Томск Газпром», «ТОМЕТ», «НАК АЗОТ», «Аммоний», «Невиномысский АЗОТ», «Акрон», «АНХК» и «НОВАТЭК». Мировой рынок метанола составляет около 85 миллионов тонн, около половины которых перерабатывается в Китае. Сегодня Россия, наряду с Китаем, Саудовской Аравией, Тринидадом, Тобаго, Ираном, входит в пятерку крупнейших стран-производителей метанола. Мировой спрос на метиловый спирт растет в среднем на 5,5 % в год, к 2027 году может достигнуть 135 миллионов тонн[15].
Применение
Метанол как сырьё используется для получения формальдегида: на этот продукт затрачивается 29 % всего мирового потребления метанола. Формальдегид расходуют на производство потребительских товаров: фотоплёнку, ковролин, растворители и краску. Конденсацией формальдегида и карбамида получают карбамидоформальдегидные смолы, идущие на производство мебели, фурнитуры. Для автомобильной промышленности из метанола производят антифриз, компоненты топливной системы, тормозные колодки. Вакцины, капсулы для лекарственных препаратов, фармацевтические продукты также производят из метанольного сырья. В строительстве метанол используют для получения средств для обработки древесины для строительства[2].
9 % мирового потребления метанола приходится на производство уксусной кислоты. Уксусная кислота используется для получения терефталевой кислоты (PTA), которая используется для изготовления полиэфирного волокна для ковровых покрытий и текстиля. Терефталевая кислота является основным компонентом полиэтилентерефталатного (ПЭТ) пластика, который используется для упаковки напитков и товаров для дома. Куртки из флиса и одежда из спандекса сделаны из уксусной кислоты. Уксусная кислота является основным компонентом мономера винилацетата, который используется для производства красок и клеев на водной основе и заменяет продукты на основе растворителей[13].
Метиловый спирт идет на производство метиламинов, из которого производят пестициды, гербициды, фунгициды и инсектициды. Метанол как сырьё применяется для получения метилметакрилата (ММА) и составляет 2 % мирового потребления метанола. Метилметакрилат используется, как защитное покрытие, из него изготавливают телевизоры с плоским экраном и жидкокристаллические дисплеи, служит упаковкой для пищевых продуктов и фармацевтических препаратов. Основное применение полимеров и сополимеров метилметакрилата — изготовление различных поверхностных покрытий, пропиточных смол и эмалей. Например, латексная краска для наружных работ основана на эмульсиях, содержащих ММА. Более 80 % потребления ММА приходится на строительную и автомобильную промышленность. Метанол используют для получения метил-трет-бутилового эфира (МТБЭ), используемого в качестве присадки, добавляемой в бензин для повышения его октанового числа[15].
Литература
- Артеменко А. И. Органическая химия. — М.: Высшая школа, 1987. — 430 с.
- Караваев М. М., Мастеров А. П. Производство метанола. — М.: Химия, 1973. — 160 с.
- Кузнецов В. Д.: [и др.], Теоретические основы химической технологии, — М.: Наука, 1977. т. 11. № 6. — 866—871 с.
- Леонов В. Е., Лободин С. С. Журнал Всесоюзного химического общества им. Д. И. Менделеева. — М.: Химия, 1984. т. 29. № 4. — 414—423 с.
- Нейланд, О. Я. Органическая химия. — М.: Высшая школа, 1990. — 751 с.
- Островский В. Е., Дятлов А. А. Доклад АН СССР. 1982. т. 264, № 2. — 290 с.
- Розовский А. Я. Кинетика и катализ. — М.: Наука, 1980. т. 21. в. 1. 97 — 107 с.;
- Розовский А. Я., Лин Г. И. Теоретические основы процесса синтеза метанола. — М.: Химия, 1990. — 267 с.
Примечания
- ↑ 1,0 1,1 1,2 Метанол: химические свойства и получение. Подготовка к ЕГЭ, ОГЭ и олимпиадам. Дата обращения: 25 сентября 0202.
- ↑ 2,0 2,1 2,2 Метиловый спирт. Большая Российская Энциклопедия. Дата обращения: 25 сентября 2023.
- ↑ Метанол // Деловой журнал «Neftegaz.RU». — 2013. — 1 января.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 4,7 4,8 История открытия и изучения метанола // Bstudy.net.
- ↑ Фишер Франц Йозеф Эмиль. Большая Российская Энциклопедия. Дата обращения: 21 сентября 2023.
- ↑ 6,0 6,1 Метанол - химические и физические свойства, общая характеристика. Образовательный портал Nauka.Club. Дата обращения: 18 сентября 2023.
- ↑ 7,0 7,1 Метанол - химические и физические свойства, общая характеристика. Образовательный портал Nauka.Club. Дата обращения: 19 сентября 2023.
- ↑ Барон Н. М., Пономарёва А. М., Равдель А. А., Тимофеева З. Н. Краткий справочник Физико-химических величин / под ред. А. А. Равделя , А. М. Пономарёвой. — СПб.: Иван Фёдоров, 2003. — С. 85. — 240 с. — ISBN 5-8194-0071-2.
- ↑ 9,0 9,1 Получение метанола. Studbooks.net. Дата обращения: 22 сентября 2023.
- ↑ Бриглеб. Большая энциклопедия нефти и газа. Дата обращения: 25 сентября 2023.
- ↑ Дядченко В.П. Введение в стереохимию. Методическая разработка для студентов. — М.: МГУ, 1994. — 74 с.
- ↑ 12,0 12,1 12,2 12,3 12,4 12,5 12,6 12,7 12,8 12,9 Метанол: химические свойства и получение. chemege.ru. Дата обращения: 22 сентября 2023.
- ↑ 13,0 13,1 13,2 13,3 Кемалов,Р.А., Кемалов, А.Ф. Технологии получения и применения метанола. Казанский Федеральный Университет, Институт геологии и нефтегазовых технологий, Кафедра высоковязких нефтей и природных битумов. Дата обращения: 22 сентября 2023.
- ↑ 14,0 14,1 Рахматуллина, А.П., Бескровный, Д. В. Химическая технология переработки газового сырья. Химия синтез-газа. — К.: Изд-во КНИТУ, 2017. — С. 69—72.
- ↑ 15,0 15,1 Метанол и продукты на его основе. УралХимСинтез. Дата обращения: 26 сентября 2023.
Данная статья имеет статус «готовой». Это не говорит о качестве статьи, однако в ней уже в достаточной степени раскрыта основная тема. Если вы хотите улучшить статью — правьте смело! |
- Страницы, использующие волшебные ссылки ISBN
- Химические вещества по алфавиту
- Страницы с неработающими файловыми ссылками
- Знание.Вики:Готовые статьи по науке
- Знание.Вики:Готовые статьи о технологиях
- Знание.Вики:Готовые статьи по алфавиту
- Одноатомные спирты
- Продукция основного органического синтеза
- Органические вещества
- Сильнодействующие ядовитые вещества
- Ядовитые вещества
- Биотопливо