Медь
| |||||
| Внешний вид простого вещества | |||||
|---|---|---|---|---|---|
 Самородок меди |
|||||
| Свойства атома | |||||
| Имя, символ, номер | Медь, 29 | ||||
| Тип группы | Металл | ||||
| Группа, период, блок | 11, 4, Подгруппа меди | ||||
| Атомная масса (молярная масса) |
63.546(3) а. е. м. (г/моль) | ||||
| Электронная конфигурация | 1s22s22p63s23p63d104s1 | ||||
| Радиус атома | 128 пм | ||||
| Химические свойства | |||||
| Ковалентный радиус | 132 [1] пм | ||||
| Радиус Ван-дер-Ваальса | 140 [2] пм | ||||
| Радиус иона | (+2) 73 (+1) 77 (для КЧ=6) пм | ||||
| Электроотрицательность | 1.90 (шкала Полинга) | ||||
| Электродный потенциал | +0.337 В/ +0.521 В | ||||
| Степени окисления | 0, +1, +2, +3. +4 | ||||
| Энергия ионизации (первый электрон) |
745.0 (7.72) кДж/моль (эВ) | ||||
| Термодинамические свойства простого вещества | |||||
| Термодинамическая фаза | Твердая | ||||
| Плотность (при н. у.) | 8.96 г/см³ | ||||
| Температура плавления | 1356.55 K (1083.4 °С) | ||||
| Температура кипения | 2840.15 К (2567 °С) | ||||
| Теплота плавления | 13.01 кДж/моль | ||||
| Теплота испарения | 304.6 кДж/моль | ||||
| Молярная теплоёмкость | 24.44 Дж/(K·моль) | ||||
| Молярный объём | 7.1 см³/моль | ||||
| Кристаллическая решётка простого вещества | |||||
| Структура решётки | Гранецентрированная кубическая | ||||
| Параметры решётки | 3.615 Å | ||||
| Температура Дебая | 315 K | ||||
Медь (химический символ — Cu, от латинского Cuprum, английский — Copper) — химический элемент четвёртого периода, 11-й группы (в устаревшем короткопериодном варианте таблицы до 1989 года — побочной подгруппе первой группы, IB) четвёртого периода периодической системы химических элементов Дмитрия Ивановича Менделеева[1].
Медь имеет порядковый номер 29 и является переходным 3d-элементом. В природе встречается в виде соединений и самородков. В чистом виде пластична, имеет розовый (красный) цвет, быстро окисляется в атмосфере, образуя на поверхности жёлтовато-красную оксидную плёнку. С древних времён медь использовалась человеком в чистом виде, и в форме сплавов. Входит в состав живых организмов (биогенный элемент)[1].
История
Медь цвета золота, но не золото
— Кудрская поговорка
- Латинское название меди Cuprum происходит от острова Кипр, где римляне производили добычу медной руды. Также использовалось латинское название Aes — в переводе «рудник». Происхождение названия меди в русском языке имеет несколько версий: 1) смида (название металла, древнегерманский язык) и Schmied (кузнец, Smith, английский язык), 2) μέταλλον (рудник/копь, древнегреческий язык)[2].
- Благодаря распространению в природе в виде самородков, а также своей мягкости и ковкости медь была одним из первых материалов, обрабатывавшихся человеком с целью производства орудий. Позднее медь выделяли выплавкой из руд при относительно низких температурах (1083 oС).
- Ранние находки оружия, щитов из меди и бронзы (сплав меди и олова) датируются VIII—VI веком до нашей эры (обнаружены на Алтае, в Сибири, Закавказье, Древней Греции, Египте и Риме). Благодаря вытеснению каменных орудий бронзой произошёл переход в Бронзовый век. Латунь (сплав меди и цинка) также широко использовалась.
- Бронзу и латунь применяли для производства предметов роскоши, украшений и скульптур[3].
Элемент в периодической системе Д. И. Менделеева. Строение атома
Медь находится в 11 группе четвёртого периода периодической системы Дмитрия Ивановича Менделеева и входит в подгруппу меди (вместе с серебром и золотом, монетные металлы)[1].
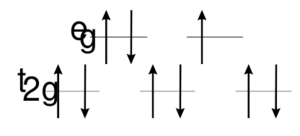
Валентными в атоме меди являются 3d и 4s-электроны. Характерной для полиэдров для меди является линейная (+1), плоскоквадратная (+1, +2), тетраэдрическая (+1, +2), тетрагонально-пирамидальная (+2), октаэдрическая (+2) геометрия. В октаэдрическом окружении связи с атомами в аксиальных положениях удлинены вследствие проявления в атоме меди(II) эффекта Яна-Теллера[4].
В состав природной меди входят два изотопа — 2963Cu (69.17 %) и изотопа 2965Cu (30.83 %). К настоящему моменту известно более 20 стабильных изотопов меди, имеющих массу от 52 до 80 а. е. м. (г/моль) и период полураспада от 75 нс до 61.83 ч[1].
Нахождение в природе
Среднее содержание меди в земной коре 4,7·10-3 % по массе. Большая часть меди (около 80 %) находится в земной коре в соединении с серой; около 15 % меди — в виде карбонатов, оксидов, силикатов, являющихся продуктами выветривания первичных сульфидных медных руд. Медь образует около 250 минералов. Известными являются: халькопирит (медный колчедан) CuFeS2, ковеллин CuS, халькозин (медный блеск) Cu2S, борнит Cu5FeS4, куприт Cu2O, малахит CuCO3·Cu(OH)2, азурит CuCO3·2Cu(OH)2. Медь находится в морской воде 3·10-7 %, в речной — 1·10-7 %.
Среднее содержание меди в живых организмах 2·10-4 % по массе. В зонах влажного климата ионы меди выщелачиваются из кислых почв и наблюдается дефицит меди, а также связанные с ним болезни растений и животных. В степях и пустынях ионы меди малоподвижны[5].
Физические свойства
Медь — твёрдый металл золотисто-розового цвета (розового цвета при отсутствии оксидной плёнки). Медь относительно легко поддается механической обработке. Температура плавления 1083,4оС, температура кипения 2567оС, плотность меди 8,92 г/см3.[6]
Химические свойства
В соединениях медь может проявлять степени окисления +1 и +2.
Медь — химически малоактивный металл. При нагревании может вступать в реакцию с некоторыми неметаллами: кислородом, серой, галогенами.
При нагревании медь реагирует с достаточно сильными окислителями, например, с кислородом, образуя CuО, Cu2О в зависимости от условий[6]:
4Cu + О2 → 2Cu2О
2Cu + О2 → 2CuО
Медь реагирует с серой с образованием сульфида меди (II):
Cu + S → CuS
Видеоопыт взаимодействия меди с серой можно посмотреть здесь.
Медь взаимодействует с галогенами. При этом образуются галогениды меди (II):
Cu + Cl2 = CuCl2
Сu + Br2 = CuBr2
Но, обратите внимание:
2Cu + I2 = 2CuI
Видеоопыт взаимодействия меди с хлором можно посмотреть здесь.
С азотом, углеродом и кремнием медь не реагирует:
Cu + N2 ≠
Cu + C ≠
Cu + Si ≠
Медь не взаимодействует с водородом.
Cu + H2 ≠
Медь взаимодействует с кислородом с образованием оксида:
2Cu + O2 → 2CuO
Медь взаимодействует и со сложными веществами:
Медь в сухом воздухе и при комнатной температуре не окисляется, но во влажном воздухе, в присутствии оксида углерода (IV) покрывается зелёным налетом карбоната гидроксомеди (II):
2Cu + H2O + CO2 + O2 = (CuOH)2CO3
В ряду напряжений медь находится правее водорода и поэтому не может вытеснить водород из растворов минеральных кислот (разбавленной серной кислоты и др.).
Например, медь не реагирует с разбавленной серной кислотой:
Cu + H2SO4 (разб.) ≠
Видеоопыт взаимодействия меди с соляной кислотой можно посмотреть здесь.
При этом медь реагирует при нагревании с концентрированной серной кислотой. При нагревании реакция идет, образуются оксид серы (IV), сульфат меди (II) и вода:
Cu + 2H2SO4(конц.) → CuSO4 + SO2 + 2H2O
Медь реагирует даже при обычных условиях с азотной кислотой.
С концентрированной азотной кислотой:
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O
С разбавленной азотной кислотой:
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O
Растворы щелочей на медь практически не действуют.
Медь вытесняет металлы, стоящие правее в ряду напряжений, из растворов их солей.
Например, медь реагирует с нитратом ртути (II) с образованием нитрата меди (II) и ртути:
Hg(NO3)2 + Cu = Cu(NO3)2 + Hg
Медь окисляется оксидом азота (IV) и солями железа (III)
2Cu + NO2 = Cu2O + NO
2FeCl3 + Cu = 2FeCl2 + CuCl2
Получение
Выделяют три основных способа получения меди[7]:
Пирометаллургический — при высоких температурах, в результате чего расплавленная масса разделяется на штейн-сплав и шлак-сплав.
Гидрометаллургический — основа данного метода состоит в получении меди с помощью определённых водных растворов. Минералы меди растворяют в разбавленной серной кислоте или аммиаке, из полученного раствора выделяют медь.
Электролизный — под действием электрического тока, путём выделения металла из раствора сульфата меди с содержанием свободной серной кислоты.
Применение
Использование меди в промышленности связано с её высокими тепло- и электропроводностью, пластичностью. До 50 % меди применяется в электротехнике, металл, содержащий не менее 99,99 % основного компонента. Высокие теплопроводность и антикоррозионные свойства позволяют изготавливать из меди детали теплообменников, криогенных установок, вакуумных аппаратов. Около 30 % меди применяют в виде сплавов. Около 10-12 % меди применяется для приготовления красок, инсектофунгицидов, микроудобрений, катализаторов окислительных процессов, в медицине, в кожевенной и меховой промышленности, в производстве искусственного шёлка[5].
Галерея
Примечания
- ↑ 1,0 1,1 1,2 1,3 Дроздов А. А., Зломанов В. П., Мазо Г. Н., Спиридонов Ф. М. Неорганическая химия / под ред. Ю. Д. Третьякова. — М.,: Академия, 2007. — 400 с. — ISBN 5-7695-2533-9.
- ↑ Медь, Cuprum, Сu(29). chem.msu.ru. Дата обращения: 28 августа 2023.
- ↑ Трифонов Д. Н., Трифонов В. Д. Как были открыты химические элементы: пособие для учащихся. — М.,: Просвещение, 1980. — 224 с.
- ↑ Кукушкин Ю. Н. Химия координационных соединений. — М.: Высшая школа, 1985.
- ↑ 5,0 5,1 Медь. Большая российская энциклопедия. Дата обращения: 26 ноября 2024.
- ↑ 6,0 6,1 Ахметов Н. С. Общая и неорганическая химия. — М..: Высшая школа, 2001. — 743 с.
- ↑ Производство меди. MANUFACTURERS.RU (8 февраля 2022). Дата обращения: 26 ноября 2024.
Ссылка
Данная статья имеет статус «готовой». Это не говорит о качестве статьи, однако в ней уже в достаточной степени раскрыта основная тема. Если вы хотите улучшить статью — правьте смело! |
Данная статья имеет статус «проверенной». Это говорит о том, что статья была проверена экспертом |
- Знание.Вики:Cite web (не указан язык)
- Страницы, использующие волшебные ссылки ISBN
- Статьи с шаблонами-карточками без имени
- Химические элементы
- Знание.Вики:Готовые статьи по химии
- Знание.Вики:Готовые статьи по науке
- Знание.Вики:Готовые статьи по алфавиту
- Элементы 4 периода
- Металлы
- Химия
- Химические вещества
- Проверенная статья