Уксусная кислота
| Уксусная кислота | |
|---|---|
  | |
 | |
| Общие | |
| Систематическое наименование |
Этановая кислота |
| Сокращения | Уксус |
| Традиционные названия | Уксусная кислота |
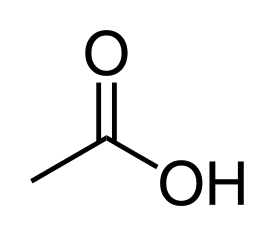
| Хим. формула | CH3COOH |
| Физические свойства | |
| Состояние | жидкость |
| Молярная масса | 60,05 г/моль |
| Плотность | 1,0492 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 16,75 °C |
| • кипения | 118,1 °C |
| Критическая точка | 321,6 °C, 5,79 МПа |
| Мол. теплоёмк. | 123,4 Дж/(моль·К) |
| Энтальпия | |
| • образования | −487 кДж/моль |
| Химические свойства | |
| Константа диссоциации кислоты | 4,76 (Ka=1,75*10-5) |
| Оптические свойства | |
| Показатель преломления | 1,372 |
| Структура | |
| Дипольный момент | 1,74 Д |
| Классификация | |
| Рег. номер CAS | 64-19-7 |
| Безопасность | |
| Пиктограммы ECB |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
У́ксусная кислота́ (химическая формула — C2H4O2 или CH3COOH, AcOH) — слабая одноосновная органическая кислота, относящаяся к классу предельных карбоновых кислот. Уксусная кислота, также известная как этановая кислота, является одним из наиболее важных и распространённых органических соединений. Это простая карбоновая кислота, которая играет ключевую роль в жизненно важных природных процессах, а также находит широкое применение в различных областях промышленности.
История открытия и первого получения уксусной кислоты
Уксусная кислота известна человечеству с древних времён. Ещё в Древнем Египте и Вавилоне её использовали в качестве консерванта и лекарственного средства. В Средние века уксусную кислоту получали путём брожения вина, сидра и других жидкостей. Однако лишь в начале XIX века было изобретено промышленное производство ледяной уксусной кислоты[1].
В 1815 году немецкий химик Франц Карл Эмиль Ловиц (1809-1871 гг.) разработал метод получения концентрированной ледяной уксусной кислоты путём ректификации (фракционной перегонки) древесного уксуса. Этот способ позволил получать уксусную кислоту высокой степени чистоты. Ледяная уксусная кислота стала широко использоваться в химической промышленности и медицине.
Следующий важный шаг в истории уксусной кислоты был сделан в 1847 году немецким химиком Адольфом Вильгельмом Германом Кольбе (1818-1884 гг.). Он осуществил первый синтез уксусной кислоты из неорганических веществ, восстановив дихлоруксусную кислоту до уксусной[2]. Это стало важной вехой в развитии органической химии, продемонстрировав возможность синтеза сложных органических соединений из простых неорганических прекурсоров.
Физические свойства уксусной кислоты
Уксусная кислота — это бесцветная, прозрачная жидкость с характерным резким, кислым запахом и вкусом. Это химическое соединение обладает рядом важных физических свойств.
Одним из ключевых свойств уксусной кислоты является её гигроскопичность, то есть способность поглощать влагу из окружающей среды. Это объясняется наличием в молекуле гидроксильной группы (—OH), которая может образовывать водородные связи с молекулами воды. Благодаря этому уксусная кислота легко растворяется в воде в любых пропорциях, образуя однородные растворы[3].
Температура плавления уксусной кислоты составляет 16,7 °C, а температура кипения — 118,1 °C при нормальном атмосферном давлении. Плотность чистой уксусной кислоты равна 1,0492 г/см³ при 20 °C. Следует отметить, что уксусная кислота также хорошо растворяется в органических растворителях, таких как этанол, диэтиловый эфир и др.
Стоит подчеркнуть, что физические свойства уксусной кислоты делают её важным промышленным и бытовым химическим веществом. Её широко используют в пищевой, текстильной, фармацевтической и других отраслях промышленности. Кроме того, уксусная кислота находит применение в качестве компонента бытовой химии и средств личной гигиены.
Получение уксусной кислоты
Существует несколько основных способов получения уксусной кислоты в промышленности и лабораторных условиях.
Один из наиболее распространённых методов — окисление ацетальдегида (CH3CHO)[4]. Ацетальдегид может быть получен каталитическим окислением этанола или гидратацией ацетилена. Далее ацетальдегид окисляется до уксусной кислоты в присутствии катализаторов, таких как медные или платиновые соли.
Другим важным способом является окисление н-бутана (CH3CH2CH2CH3). Этот процесс протекает в две стадии: сначала н-бутан окисляется до масляной кислоты (CH3CH2COOH), а затем последняя окисляется до уксусной кислоты. Катализаторами могут служить оксиды металлов.
Синтез уксусной кислоты также возможен из неорганических веществ. Например, карбонилирование метанола (CH3OH) с использованием катализаторов на основе родия или иридия приводит к образованию уксусной кислоты. Этот процесс широко применяется в промышленности[4].
Наконец, уксусная кислота может быть получена в результате брожения этанола. Этот способ основан на жизнедеятельности уксуснокислых бактерий, которые окисляют этанол до уксусной кислоты. Данный метод имеет большое значение для производства пищевого и медицинского уксуса.
Таким образом, современная промышленность использует разнообразные методы получения уксусной кислоты, основанные на окислении органических соединений, карбонилировании метанола и биологическом брожении этанола. Применение различных катализаторов позволяет оптимизировать эти процессы и повысить выход целевого продукта[5].
Химические свойства и реакции уксусной кислоты
Уксусная кислота (CH3COOH) относится к классу карбоновых кислот и обладает типичными кислотными свойствами. Она диссоциирует в водных растворах с образованием ионов водорода (H+) и ацетат-ионов (CH3COO-):
CH3COOH ⇌ CH3COO- + H+
Благодаря этому процессу, уксусная кислота проявляет слабые кислотные свойства и способна взаимодействовать с различными веществами, образуя соли-ацетаты.
При взаимодействии уксусной кислоты с активными металлами, такими как натрий, калий или кальций, происходит вытеснение водорода с образованием солей-ацетатов:
2CH3COOH + 2Na → 2CH3COONa + H2
С менее активными металлами, например, железом или цинком, реакция идёт медленнее, но также приводит к образованию ацетатов:
2CH3COOH + Zn → (CH3COO)2Zn + H2
Уксусная кислота способна взаимодействовать и с неметаллами. Так, при нагревании она реагирует с серой, фосфором и другими неметаллами, образуя различные органические соединения[6].
Взаимодействие уксусной кислоты с основаниями, такими как гидроксид натрия или гидроксид кальция, также приводит к образованию солей-ацетатов:
CH3COOH + NaOH → CH3COONa + H2O
Аналогичным образом уксусная кислота реагирует с оксидами металлов и солями, образуя ацетаты.
Интересно, что уксусная кислота может вступать в реакции окисления-восстановления. При взаимодействии с сильными окислителями, например, с перманганатом калия в присутствии серной кислоты, она окисляется до диоксида углерода и воды:
2CH3COOH + 2KMnO4 + 3H2SO4 → 2CO2 + 2MnSO4 + 2KHSO4 + 4H2O
В то же время, уксусная кислота может быть подвергнута реакции хлорирования, в результате которой образуются более сложные соединения, такие как монохлоруксусная кислота (CH2ClCOOH) и дихлоруксусная кислота (CHCl2COOH)[7].
Таким образом, уксусная кислота — важное и многофункциональное органическое соединение, обладающее широким спектром химических свойств и реакционной способностью.
Нахождение уксусной кислоты в природе
Уксусная кислота, также известная как этановая кислота, является распространённым природным соединением, присутствующим во многих органических веществах. Она может быть обнаружена как в растениях, так и в животных организмах.
В растениях уксусная кислота образуется в результате метаболических процессов, таких как фотосинтез и дыхание. Она присутствует в соках и тканях многих плодовых и овощных культур, таких как яблоки, виноград, помидоры и огурцы. Уксусная кислота также выделяется некоторыми видами растений в качестве защитного механизма от насекомых-вредителей или патогенных микроорганизмов.
Помимо растений, уксусная кислота образуется и в животных организмах в процессе расщепления жиров и белков. Она участвует в обмене веществ и может являться побочным продуктом жизнедеятельности некоторых бактерий, обитающих в кишечнике. Кроме того, уксусная кислота образуется при гниении и брожении органических отходов, таких как пищевые остатки, навоз и опавшие листья. Этот процесс особенно активен в почве, где микроорганизмы разлагают органические соединения, высвобождая уксусную кислоту[8].
Таким образом, природные источники уксусной кислоты весьма разнообразны и включают в себя как живые организмы, так и продукты их жизнедеятельности и разложения. Понимание этих природных процессов позволяет лучше понять роль уксусной кислоты в окружающей среде и использовать её в различных сферах деятельности человека.
Применение уксусной кислоты
Уксусная кислота находит широкое применение в различных отраслях промышленности и в повседневной жизни. В химической промышленности уксусная кислота используется для синтеза целого ряда других химических веществ, таких как винилацетат, красители и лекарственные препараты. Винилацетат, в свою очередь, является сырьём для производства поливинилацетатных клеёв, пластификаторов и других полимерных материалов.
В пищевой промышленности уксусная кислота используется в качестве пищевой добавки (Е260) для придания характерного кислого вкуса и в качестве консерванта[9]. Она широко применяется в производстве маринадов, соусов, заправок для салатов, квашеной капусты и других ферментированных продуктов. Фармацевтическая промышленность использует уксусную кислоту для синтеза различных лекарственных средств, а также в качестве активного компонента некоторых препаратов.
Уксусная кислота находит применение и в лёгкой промышленности в качестве растворителя для лаков и красок. Она служит важным реагентом в органическом синтезе, используется при производстве ацетата целлюлозы, уксуснокислых солей и эфиров. Кроме того, уксусную кислоту применяют в бытовой химии, например, для устранения известковых отложений, очистки поверхностей, а также в качестве дезинфицирующего средства. Таким образом, изучение и понимание свойств уксусной кислоты имеет большое значение как для повседневной жизни, так и для научного познания.
Биологическая роль и токсичность уксусной кислоты
Помимо практического применения, уксусная кислота, также известная как этановая кислота, играет важную биологическую роль в организме человека. Она является продуктом метаболизма углеводов и жиров и участвует в ряде жизненно важных процессов. Например, уксусная кислота вырабатывается в результате расщепления этанола в печени и выступает в качестве источника энергии для клеток.
Однако, несмотря на свою биологическую необходимость, уксусная кислота может быть токсичной для организма при высоких концентрациях или при попадании на кожу и слизистые оболочки[10]. Вдыхание паров или попадание жидкой уксусной кислоты может вызвать серьёзные повреждения глаз, дыхательных путей и пищеварительной системы. Также возможны ожоги кожи при контакте[10]. Поэтому при работе с уксусной кислотой следует соблюдать меры предосторожности: использовать средства защиты, работать в хорошо проветриваемых помещениях и избегать прямого контакта. В случае попадания на кожу или в глаза необходимо немедленно промыть поражённые участки большим количеством воды.
Примечания
- ↑ Martin, Geoffrey. Industrial and Manufacturing Chemistry (неопр.). — Part 1, Organic. — London: Crosby Lockwood, 1917. — С. 330—31..
- ↑ Goldwhite, Harold. Short summary of the career of the German organic chemist, Hermann Kolbe (англ.) // New Haven Section Bull. Am. Chem. Soc. : journal. — 2003. — September (vol. 20, no. 3). Архивировано 4 марта 2009 года..
- ↑ Уксусная кислота. Дата обращения: 8 сентября 2009. Архивировано 5 июня 2008 года..
- ↑ 4,0 4,1 Реутов О. А. Органическая химия. — М.: Изд-во МГУ, 1999. — Т. 4..
- ↑ Advances in Organometallic Chemistry. Дата обращения: 3 октября 2017. Архивировано 17 сентября 2014 года..
- ↑ Ходаков Ю. В., Эпштейн Д. А., Глориозов П. А. § 8. Реакции ионного обмена // Неорганическая химия. Учебник для 9 класса. — 7-е изд. — М.: Просвещение, 1976. — С. 15—18. — 2 350 000 экз..
- ↑ Jones, R.E.; Templeton, D. H. The crystal structure of acetic acid (англ.) // Acta Crystallogr.: journal. — International Union of Crystallography, 1958. — Vol. 11, no. 7. — P. 484—87..
- ↑ Кольман Я., Рём К.—Г. Наглядная биохимия. — 4-е изд.. — М.: БИНОМ. Лаборатория знаний, 2012. — 469 с..
- ↑ Уксус — статья из Большой советской энциклопедии..
- ↑ 10,0 10,1 (Роспотребнадзор). № 2400. Этановая кислота (уксусная кислота) // ГН 2.2.5.3532-18 «Предельно допустимые концентрации (ПДК) вредных веществ в воздухе рабочей зоны» / утверждены А.Ю. Поповой. — Москва, 2018. — С. 162. — 170 с. — (Санитарные правила). Архивировано 12 июня 2020 года..




