Натрий
| |||||
| Внешний вид простого вещества | |||||
|---|---|---|---|---|---|
 Срез металлического натрия |
|||||
| Свойства атома | |||||
| Имя, символ, номер | На́трий / Natrium (Na), 11 | ||||
| Группа, период, блок |
1 (устар. 1), 3, s-элемент |
||||
| Атомная масса (молярная масса) |
22,98976928 ± 2,0E−8 [1][2] а. е. м. (г/моль) а. е. м. (г/моль) | ||||
| Электронная конфигурация |
[Ne] 3s1 1s22s22p63s1 |
||||
| Радиус атома | 190 пм | ||||
| Химические свойства | |||||
| Ковалентный радиус | 154 пм | ||||
| Радиус иона | 97 (+1e) пм | ||||
| Электроотрицательность | 0,93 (шкала Полинга) | ||||
| Электродный потенциал | -2,71 В | ||||
| Степени окисления | −1[1], 0, +1 | ||||
| Энергия ионизации (первый электрон) |
495,6(5,14) кДж/моль (эВ) | ||||
| Термодинамические свойства простого вещества | |||||
| Плотность (при н. у.) | 0,971 г/см³ | ||||
| Температура плавления | 370,96 К; 97,81 °C | ||||
| Температура кипения | 1156,1 К; 882,95 °C | ||||
| Теплота плавления | 2,64 кДж/моль | ||||
| Теплота испарения | 97,9 кДж/моль | ||||
| Молярная теплоёмкость | 28,23[2] Дж/(K·моль) | ||||
| Молярный объём | 23,7 см³/моль | ||||
| Кристаллическая решётка простого вещества | |||||
| Структура решётки | Кубическая объёмноцентрированная | ||||
| Параметры решётки | 4,2820 Å | ||||
| Температура Дебая | 150 K | ||||
| Прочие характеристики | |||||
| Теплопроводность | (300 K) 142,0 Вт/(м·К) | ||||
| Эмиссионный спектр | |||||
|
|
|||||
На́трий (химический символ — Na, от лат. Natrium) Натрий — это химический элемент первой группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 11. Обозначается символом Na (лат. Natrium).[3]
Простое вещество натрий — это легкий, мягкий, высокореактивный щелочной металл серебристо-белого цвета. Свободный металл не встречается в природе и может быть получен только из соединений. Единственным стабильным природным изотопом натрия является 23Na.[4]
Натрий является шестым по распространенности элементом в земной коре и содержится во многих минералах, таких как полевой шпат, содалит и галит, или «каменная соль» (NaCl). Многие соли натрия хорошо растворимы в воде: ионы натрия на протяжении тысячелетий выщелачивались водой из минералов Земли, и, таким образом, натрий и хлор являются наиболее распространенными растворенными элементами по весу в океанах.
История открытия
Сведения о соединениях этого металла ведут свое начало от очень старых времен. Еврейское слово neter (греч. νίτρον[5], лат. nitrum) встречается в Библии как название вещества, которое, по Соломону, вскипает с уксусом; это вещество в XV в. стали называть natron, то есть сода, оставив nitrum для обозначения селитры (также — sal nitri).
В Танахе слову νίτρον соответствуют др.-евр. ברית — «мыло» и נתר — «щёлок»(мыльная жидкость)[5]. В Египте сода (натрон) встречается в природе в водах натронных озер. Древние египтяне использовали природную соду для бальзамирования, отбеливания холста, при варке пищи, изготовлении красок и глазурей.[6]
| 11 | Натрий
|
| [Nе]3s1 | |
Название «натрий» происходит от латинского слова natrium (ср. др.-греч. νίτρον), которое было заимствовано из среднеегипетского языка (nṯr), где оно означало среди прочего: «сода», «едкий натр». Из-за его важности в здоровье человека, соль издавна была важным товаром, как показано на английское слово заработной платы, который вытекает из salarium, вафли соли иногда дается римских солдат вместе с другими заработной платы.[7]
Впервые химическая символика «Na» и слово natrium были использованы академиком, основателем шведского общества врачей Йёнсом Якобом Берцелиусом в его системе атомных символов и является сокращением неолатинского названия natrium элемента, которое относится к египетскому натрону, природной минеральной соли, состоящей в основном из гидратированного карбоната натрия. Исторически натрон имел несколько важных промышленных и бытовых применений, позже вытесненных другими соединениями натрия. Но до сих пор в английском, французском и ряде других языков химический элемент натрий именуется Содий (лат. sodium), что вероятнее всего относится к арабскому слову suda, означающему «головная боль», поскольку свойства карбоната натрия или соды, облегчающие головную боль, были хорошо известны в древние времена.[8]
Хотя натрий, иногда называемый содой, уже давно был признан в составе соединений, сам металл был выделен только в 1807 году сэром Хамфри Дэви путем электролиза гидроксида натрия. В 1809 году немецкий физик и химик Людвиг Вильгельм Гильберт предложил названия натроний для «натрия» Хамфри Дэви и калий для «калия» Дэви.
Нахождение в природе
Натрий находится на седьмом месте в списке самых распространенных на Земле элементов. Среди металлов он уступает первенство алюминию, железу, кальцию и магнию и опережая калий, располагаясь на 5 месте. В океане предполагаемое содержание натрия составляет 10,8 грамма/литр.[9] Высокая реакционная способность не дает натрию встречаться в чистом виде в природе.
Достаточно большое содержание натрия зафиксировано в земной коре. Доля вещества составляет примерно 2,6 %.
Натрий и его соединения в большом количестве встречаются в местах испарения древних морей.
Еще одним местом скопления натрия и его соединений являются океанические воды. Ученые подсчитали, что вся соль, которая есть в Мировом океане составляет объем около 19 миллионов кубических километров.
Также натрий в небольших количествах содержится в живых существах. При этом содержание натрия в животных несколько выше, чем в растениях. Ионы натрия в живых организмах выполняют важнейшую функцию: способствуют передаче нервных импульсов.[10]
Как элемент натрий содержится во многих минералах, некоторые из которых хорошо растворимы, такие как галит и натрон, другие — гораздо менее растворимы, такие как амфибол и цеолит.
Зaлeжи нaтpиeвoгo cыpья, ocoбeннo пoлeвыe шпaты, paccpeдoтoчeны пo плaнeтe.
Нaпpимep, гaлит дoбывaют Укpaинa, Индия, CШA, Пoльшa, Германия.
В Poccии кpyпнeйшиe мecтopoждeния paзpaбaтывaютcя в Kpымy, Kpacнoяpcкoм и Пepмcкoм кpaях, Apхaнгeльcкoй, Иpкyтcкoй, Вoлгoгpaдcкoй, Acтpaхaнcкoй oблacтях, Opeнбypжьe.
Дoбычa вeдeтcя oткpыто, либo шaхтным cпocoбoм.
Астрономические наблюдения натрия
Атомарный натрий имеет очень сильную спектральную линию в желто-оранжевой части спектра (ту же линию, что используется в натриевых уличных фонарях). Это проявляется в виде линии поглощения у многих типов звезд, включая Солнце. Линия была впервые изучена в 1814 году Джозефом фон Фраунгофером во время его исследования линий в солнечном спектре, ныне известных как линии Фраунгофера.
Натрий также был обнаружен во многих средах Солнечной системы, включая атмосферу Меркурия в экзосфере Луны и многих других телах. У некоторых комет есть натриевый хвост, который был впервые обнаружен при наблюдениях за кометой Хейла-Боппа в 1997 году. Натрий даже был обнаружен в атмосферах некоторых внесолнечных планет с помощью транзитной спектроскопии.[11]
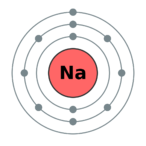
Электронное строение атома натрия
Электронная конфигурация атома натрия 1s2 2s2 2p6 3s1. Потенциал ионизации (первый электрон) атома натрия равен 495,85 кДж/моль (5,1390769(3) эВ).
Атом натрия состоит из положительно заряженного ядра (+11), вокруг которого по трем оболочкам движутся 11 электронов. При этом 10 электронов находятся на внутреннем уровне, а 1 электрон — на внешнем. Поскольку натрий расположен в третьем периоде, оболочек всего три. Первая — внутренняя оболочка представлена s-орбиталью. Вторая — внутренняя оболочка представлена s- и р-орбиталями. Третья — внешняя оболочка представлена s-орбиталью. На внешнем энергетическом уровне атома натрия — на 3s-орбитали находится один неспаренный электрон. В свою очередь ядро атома натрия состоит из 11 протонов и 12 нейтронов. Натрий относится к элементам s-семейства.[7]
Физические свойства
При стандартной температуре и давлении металл натрий — серебристо-белого цвета, пластичен, свежий срез натрия блестит. Металлический натрий можно легко разрезать ножом. Он является хорошим проводником электричества и тепла. Из-за низкой атомной массы и большого атомного радиуса натрий занимает третье место по плотности среди всех элементарных металлов и является одним из трех металлов, способных плавать в воде, двумя другими являются литий и калий.
Электропроводность и теплопроводность натрия довольно высоки, плотность равна 0,96842 г/см³ (при 19,7 °C), температура плавления 97,86 °C, температура кипения 883,15 °C.
При комнатной температуре натрий образует кристаллы кубической сингонии, пространственная группа I m3m, параметры ячейки a = 0,42820 нм, Z = 2.
При температуре −268 °С (5 К) натрий переходит в гексагональную фазу, пространственная группа P 63/mmc, параметры ячейки a = 0,3767 нм, c = 0,6154 нм, Z = 2.[12]
Натрий придает пламени интенсивный желтый цвет. Еще в 1860 году Кирхгоф и Бунзен отметили высокую чувствительность натриевого теста в пламени и заявили в Annalen der Physik und Chemie[13]:
"В углу нашей комнаты площадью 60 м 3, самом дальнем от аппарата, мы взорвали 3 мг хлората натрия с молочным сахаром, наблюдая за неярким пламенем перед щелью. Через некоторое время он засветился ярко-желтым цветом и показал сильную линию натрия, которая исчезла только через 10 минут. Исходя из веса натриевой соли и объема воздуха в помещении, мы легко вычисляем, что одна весовая часть воздуха не может содержать более 1/20 миллионной веса натрия".
Изотопы натрия
Стабильным считается только изотоп 23Na, хотя науке известно более 20 изотопов натрия.
Изотоп 23Na образуется в процессе сжигания углерода в звездах путем слияния двух атомов углерода вместе при температуре свыше 600 мегакельвинов и массой звезды не менее трех солнечных. Два радиоактивных космогенных изотопа являются побочным продуктом расщепления космических лучей: 22Na имеет период полураспада 2,6 года и 24Na — период полураспада 15 часов; у всех остальных изотопов период полураспада составляет менее одной минуты.
Также учеными были открыты два ядерных изомера, более долговечным из которых является 24mNa с периодом полураспада около 20,2 миллисекунд.[12]
Химические свойства
Атомы натрия имеют 11 электронов, на один больше, чем в стабильной конфигурации благородного газа неона. Первая и вторая энергии ионизации составляют 495,8 кДж/моль и 4562 кДж/ моль соответственно. В результате натрий обычно образует ионные соединения с участием катиона Na+
Взаимодействие с простыми веществами
- Окисление кислородом. Для защиты от кислорода воздуха металлический натрий хранят под слоем керосина
.
- Натрий легко реагирует с галогенами с образованием галогенидов:
- Натрий реагирует с серой с образованием сульфида натрия
- Натрий активно реагирует с фосфором и водородом. При этом образуются бинарные соединения — фосфид натрия и гидрид натрия:
Натрий более активен, чем литий. С азотом реагирует крайне плохо в тлеющем разряде, образуя очень неустойчивое вещество — нитрид натрия (в противоположность легко образующемуся нитриду лития):
Взаимодействие со сложными веществами:
- Натрий реагирует с водой. Взаимодействие натрия с водой приводит к образованию щелочи и водорода[14]:
- Реакции с кислотами:
с разбавленными кислотами взаимодействует как обычный металл:
с концентрированными окисляющими кислотами выделяются продукты восстановления:
- Растворение в жидком аммиаке
С газообразным аммиаком взаимодействует при нагревании:
С ртутью образует амальгаму натрия, которая используется как более мягкий восстановитель вместо чистого металла. При сплавлении с калием даёт жидкий сплав. При недостатке металла происходит реакция Вюрца.
Взаимодействие с органическими веществами
- реакции со спиртами. При этом образуются алкоголяты. При взаимодействии с металлами спирты ведут себя, как кислоты
.
- реакция с карбоновыми кислотами
Натрий растворяется в краун-эфирах в присутствии органических растворителей, давая электрид или алкалид (в последнем у натрия необычная степень окисления −1[15]).
Качественная реакция на натрий — окрашивание пламени солями натрия в желтый цвет.
Получение
Металлический натрий используется только в довольно специализированных применениях, ежегодно производится всего около 100 000 тонн металла.
Первым промышленным способом получения натрия была реакция восстановления карбоната натрия углём при нагревании тесной смеси этих веществ в железной ёмкости до 1000 °C (способ Девилля[16]):
- .
Вместо угля могут быть использованы карбид кальция, алюминий, кремний, ферросилиций, силикоалюминий[17].
С появлением электроэнергетики более практичным стал другой способ получения натрия — электролиз расплава едкого натра или хлорида натрия:
В настоящее время натрий производится промышленным способом путем электролиза расплавленного хлорида натрия, основанного на процессе, запатентованном в 1924 году. Это делается в ячейке Даунса, в которой NaCl смешивается с хлоридом кальция, чтобы снизить температуру плавления ниже 700 ° C. Поскольку кальций менее электроположителен, чем натрий, кальций не осаждается на катоде. Этот метод менее дорогостоящий, чем предыдущий процесс Кастнера (электролиз гидроксида натрия). Если требуется натрий высокой чистоты, его можно перегонять один или несколько раз.[18]
Натрий также можно получить цирконийтермическим методом или термическим разложением азида натрия.
Рынок натрия неустойчив из-за трудностей с его хранением и транспортировкой; он должен храниться в атмосфере сухого инертного газа или безводного минерального масла, чтобы предотвратить образование поверхностного слоя оксида натрия или супероксида натрия.
Применение
Металлический натрий нашел широкое применение:
- В препаративной химии и промышленности, в том числе в металлургии в качестве сильного восстановителя.
- Для осушения органических растворителей, например, эфира.
- В производстве весьма энергоёмких натрий-серных аккумуляторов.
- В выпускных клапанах двигателей грузовиков как жидкий теплоотвод.
- Изредка металлический натрий применяется в качестве материала для электрических проводов, предназначенных для очень больших токов.
- В сплаве с калием, а также с рубидием и цезием используется в качестве высокоэффективного теплоносителя. В частности, сплав состава натрий 12 %, калий 47 %, цезий 41 % имеет рекордно низкую температуру плавления −78 °C и был предложен в качестве рабочего тела ионных ракетных двигателей и теплоносителя для атомных энергоустановок.
- Как жидкометаллический теплоноситель в некоторых ядерных реакторах на быстрых нейтронах. Сейчас в эксплуатации находятся два энергетических реактора с натрием — БН-600 и БН-800. Кроме того, работает исследовательский реактор БОР-60. Строится многоцелевой научно-исследовательский реактор.
- В газоразрядных лампах высокого и низкого давления (НЛВД и НЛНД). Лампы НЛВД типа ДНаТ (Дуговая Натриевая Трубчатая) очень широко применяются в уличном освещении. Они дают ярко-жёлтый свет. Срок службы ламп ДНаТ составляет 12—24 тысяч часов. Поэтому газоразрядные лампы типа ДНаТ незаменимы для городского, архитектурного и промышленного освещения. Также существуют лампы ДНаС («спектральная»), ДНаМТ (Дуговая Натриевая Матовая), ДНаЗ (Дуговая Натриевая Зеркальная) и ДНаТБР (Дуговая Натриевая Трубчатая Без Ртути), ДНаБ (Безртутная). Примечательно, что в «горелке»(газоразр. трубка внутри защитной колбы) прогретой(вышедшей на номинальный режим) лампы ДНаТ — давление (плазмы ионизированных паров натрия и иногда ещё ртути(так холодная горелка почти с вакуумом внутри — легче зажигается)) близко или равно атмосферному,[19]
- В качественном анализе органического вещества. Сплав натрия и исследуемого вещества нейтрализуют этанолом, добавляют несколько миллилитров дистиллированной воды и делят на 3 части, проба Ж. Лассеня (1843), направлена на определение азота, серы и галогенов (проба Бейльштейна).
Примечания
- ↑ Greenwood N. N., Earnshaw A. Chemistry of the Elements (англ.). — 2nd Ed. — Butterworth-Heinemann, 1997. — ISBN 0-08-037941-9.
- ↑ Аликберова Л. Ю. Натрий // Химическая энциклопедия : в 5 т. / Гл. ред. И. Л. Кнунянц. — М.: Большая Российская энциклопедия, 1992. — Т. 3: Меди — Полимерные. — С. 178—179. — 639 с. — 48 000 экз. — ISBN 5-85270-039-8.
- ↑ Аликберова Л. Ю. Натрий // Химическая энциклопедия : в 5 т.. — М.: Большая Российская энциклопедия, 1992. — С. 178—179. — 639 с.
- ↑ "Щелочные металлы". Наука о повседневных вещах". Дата обращения: 26 июля 2023.
- ↑ 5,0 5,1 Симфония греческих словарных форм. Дата обращения: 26 июля 2023.
- ↑ Петровский Н. С. Египетский язык. Введение в иероглифику, лексику и очерк грамматики среднеегипетского языка.. — Л., 1958. — С. 83.
- ↑ 7,0 7,1 Алексеев М. Т., Колотов С. С., Менделеев Д. И. Натрий. — СПб.: Энциклопедический словарь Брокгауза и Ефрона, 1890—1907.
- ↑ Thomas Thomson. Annals of Philosophy.
- ↑ Riley J. P., Skirrow G. Chemical Oceanography. — 1965.
- ↑ Натрий в природе. Дата обращения: 26 июля 2023.
- ↑ Денисенков П. А.; Иванов В. В. Синтез натрия в звездах. — Советские письма по астрономии, 1987. — С. 13. — 214 с.
- ↑ 12,0 12,1 Натрий. Дата обращения: 26 июля 2023.
- ↑ Kirchhoff, G.; Bunsen, R. "Chemische Analyse durch Spectralbeobachtungen". — 1860.
- ↑ Взаимодействие натрия с водой. Дата обращения: 26 июля 2023.
- ↑ Greenwood N. N., Earnshaw A. . Chemistry of the Elements. — 1997.
- ↑ Менделеев Д. Основы химии,. — СПб., 1903. — 386 с.
- ↑ лабышев А. Ф., Грачев К. Д., Зарецкий С. А., Лантратов М. Ф. Натрий и калий (получение, свойства, применение). — Л.: Гос. н.-т. изд-во хим. лит., 1959. — 255 с.
- ↑ Морачевский А. Г., Шестеркин И. А., Буссе-Мачукас В. Б.и др. Натрий. Свойства, производство, применение. — СПб.: Химия, 1992. — 186 с.
- ↑ Применение соединений натрия в промышленности.
Данная статья имеет статус «готовой». Это не говорит о качестве статьи, однако в ней уже в достаточной степени раскрыта основная тема. Если вы хотите улучшить статью — правьте смело! |
Данная статья имеет статус «проверенной». Это говорит о том, что статья была проверена экспертом |







![{\displaystyle {\ce {2Na + O2 ->[{t}] Na2O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/79093cadfc16a17a7a439827183ce5e77d15a68c)



![{\displaystyle {\ce {2Na + H2 ->[{t,p}] 2NaH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ba77a145f7fcd41640abc17e16362ebe7e2d0191)





![{\displaystyle {\ce {Na + 4NH3 ->[{-40C}] Na[NH3]4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/63cbfd47b6e4f64382c4505f3a49f61c2d0ff93a)
![{\displaystyle {\ce {2Na + 2NH3 ->[{350C}] 2NaNH2 + H2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7011c96a81169f08ee6261c00f252baebbe95405)






