Этанол
| Этанол | |
|---|---|
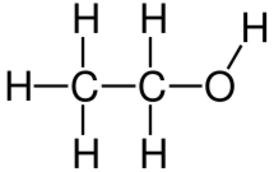 Файл:Скелетная формула этанола.svg | |
 | |
| Общие | |
| Систематическое наименование |
Этанол, эти́лгидрат, мети́лкарбино́л |
| Сокращения | Спи́рт |
| Традиционные названия | Эти́ловый спи́рт |
| Хим. формула | |
| Рац. формула | |
| Физические свойства | |
| Состояние | Жидкость |
| Молярная масса | 46,069 г/моль |
| Плотность | (20 °C) 789,3 кг/м3 г/см³ |
| Динамическая вязкость | 1,2 мПа·с (при 20 °C) |
| Термические свойства | |
| Температура | |
| • плавления | −114,3 °C |
| • кипения | +78,39[1] °C |
| • самовоспламенения | +363 °C |
| Пределы взрываемости | 3,28—18,95 % |
| Тройная точка | −114,3 °C; 0,43 мПа |
| Критическая точка | +241 °C; 6,137 МПа |
| Мол. теплоёмк. | 112,4 Дж/(моль·К) |
| Энтальпия | |
| • образования | −234,8 кДж/моль |
| Давление пара |
5,95 кПа (при 20 °С) |
| Химические свойства | |
| Растворимость | |
| • в воде | Неограниченно |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Не следует путать с метанолом — другим веществом класса одноатомных спиртов, опасным ядом.
У этого термина существуют и другие значения, см. Спирт (значения).
Этано́л (эти́ловый спирт, ви́нный спирт, спирт, алкого́ль) — представляет собой одноатомный первичный алифатический спирт с химической формулой . Это бесцветная и гигроскопичная жидкость, обладающая характерным запахом и жгучим вкусом. Этанол широко используется в различных отраслях, а также применяется в качестве топлива. В медицине этиловый спирт находит применение в качестве дезинфицирующего средства и для консервирования биопрепаратов. Кроме того, значительная часть этанола используется для производства крепких алкогольных напитков. Этиловый спирт обладает наркотическим действием: при употреблении внутрь он вызывает опьянение, а при регулярном употреблении может приводить к развитию алкогольной зависимости и болезней у человека (цирроз печени, рак молочной железы и другие заболевания), а также к смертельным случаям взрослых и детей[2][3][4][5][6][7][8][9][10][11][12].
История открытия
С древних времен этанол известен как алкогольный напиток, обладающий свойством вызывать опьянение. В России этанол традиционно получали методом брожения ржаных или пшеничных зёрен. Данный спирт, хотя и используется в производстве алкогольных напитков, может соответствовать стандартам, установленным для топлива. Для превращения этанола в топливный продукт его денатурируют, добавляя небольшое количество бензина или других нефтехимических веществ, что делает его непригодным для употребления в пищу[13].
В конце XIX века этанол в Соединённых Штатах использовался в качестве источника питания для ламп, и объём его продаж превышал 25 миллионов галлонов в год. По инициативе крупных нефтяных компаний в ходе Гражданской войны правительство США ввело налог на этанол, что в значительной степени привело к сворачиванию его промышленного производства. В 1906 году этот налог был отменен, и производство спиртового топлива получило новое развитие до тех пор, пока конкуренция между нефтяными компаниями не привела к значительному сокращению его потребления[13].
Первоначальное крупномасштабное потребление этанола в качестве топлива начало проявляться в начале 1900-х годов в условиях нехватки запасов нефти в Европе. В Соединённых Штатах автомобиль Генри Форда «Модель Т» и другие автомобили, произведённые в начале 1920-х годов, проектировались для работы на спиртовом топливе. На протяжении нескольких десятилетий этанол оставался известным топливом. Генри Форд, разрабатывая «Модель Т», предполагал, что этанол, получаемый из возобновляемой биомассы, станет основным источником автомобильного топлива[13].
В период Второй мировой войны как Германия, так и США использовали этанол в качестве топлива для военного транспорта. Однако после окончания войны цены на нефть значительно снизились, что привело к уменьшению потребления этанола. Этот спад продолжался до нефтяного кризиса 1970-х годов, после которого использование этанола как топлива возросло в конце 1970-х годов. В этот период этанол стали применять в качестве добавки к бензину, что было связано с дефицитом нефти. Тем не менее, к началу двадцатого века бензин стал основным видом транспортного топлива благодаря простоте эксплуатации бензиновых двигателей и увеличению поставок более дешёвой нефти из новых нефтяных месторождений[13].
Свойства вещества
Химическое строение
Физические свойства
Этанол представляет собой органическое соединение с температурой кипения 78,39 °C и плотностью 789,3 кг/м³ при температуре 20 °C. Это вещество характеризуется хорошей растворимостью в воде, спиртах, эфире, хлороформе и других растворителях.
| Молекулярная масса | 46,069 а. е. м. |
| Температура замерзания | −114,15 °C |
| Температура кипения | 78,39 °C |
| Критическая точка | 241 °C (при давлении 6,3 МПа) |
| Растворимость | Смешивается в произвольных отношениях с бензолом, водой, глицерином, диэтиловым эфиром, ацетоном, метанолом, уксусной кислотой, хлороформом |
| Показатель преломления | Показатель преломления (для D-линии натрия) 1,3611 (при 20 °C) (температурный коэффициент показателя преломления −4,0⋅10−4/°C, почти постоянный в интервале температур 10—30 °C) |
| Стандартная энтальпия образования ΔH | −234,8 кДж/моль (г) (при 298 К) |
| Стандартная энтропия образования S | 281,38 Дж/моль·K (г) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 1,197 Дж/моль·K (г) (при 298 К) |
| Энтальпия плавления ΔHплав | 4,81 кДж/моль |
| Энтальпия кипения ΔHкип | 839,3 кДж/моль |
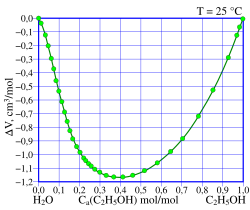 Уменьшение объёма смеси при смешивании этанола с водой при разных мольных долях этанола в растворе. При мольной доле в 40 % снижение объёма максимально. |
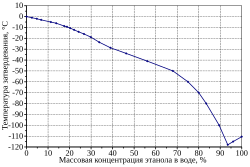 Фазовая диаграмма состояния смеси этанол—вода (диаграмма затвердевания)[14] |
| t | 10°С | 20°С | 30°С | 40°С | 50°С | 60°С | 70°С | 80°С | 90°С | 100°С | 110°С | 120°С | 130°С | 140°С |
| P, мм рт.ст. | 23,6 | 43,9 | 79,2 | 135,3 | 222,2 | 352,7 | 543,6 | 809,7 | 1170,4 | 1651,5 | 2280,2 | 3087,5 | 4107,9 | 5380,2 |
| P, 105 Па | 0,0315 | 0,0585 | 0,1056 | 0,1804 | 0,2962 | 0,4702 | 0,7247 | 1,0795 | 1,5604 | 2,2018 | 3,04 | 4,1163 | 5,4767 | 7,173 |
| P, атм | 0,0311 | 0,0578 | 0,1042 | 0,1780 | 0,2924 | 0,4641 | 0,7153 | 1,0654 | 1,5400 | 2,1730 | 3,0003 | 4,0625 | 5,4051 | 7,0792 |
Химические свойства
Этиловый спирт характеризуется высокой воспламеняемостью и горит голубым пламенем. Смеси этилового спирта с воздухом, в концентрациях от 3,28 % до 18,95 % по объёму, являются взрывоопасными[2].
Взаимодействуя с металлами, этиловый спирт создаёт этилаты, такие как натриевый этилат . При реакции с неорганическими и органическими кислотами, а также их ангидридами и галогенангидридами, образуются сложные эфиры, например, этилацетат при взаимодействии с уксусной кислотой [2].
Дегидратация этилового спирта приводит к образованию этилена или диэтилового эфира, в то время как дегидрирование этого соединения приводит к образованию ацетальдегида. Реакция с аммиаком приводит к образованию этиламинов, а взаимодействие с альдегидами и кетонами — к образованию ацеталей. Также этиловый спирт может реагировать с гипохлоритом натрия , образуя хлороформ, а хлорирование приводит к образованию хлораля[2]. Типичный представитель одноатомных спиртов.
Горюч. Легко воспламеняется. При достаточном доступе воздуха горит (за счёт его кислорода) светлым голубоватым пламенем, образуя конечные продукты окисления — диоксид углерода и воду:
- .
Ещё энергичнее данная реакция протекает в атмосфере чистого кислорода.
При определённых условиях (температура, давление, катализаторы) возможно и контролируемое окисление (как элементарным кислородом, так и многими другими окислителями) до ацетальдегида, уксусной кислоты, щавелевой кислоты и некоторых других продуктов, например:
- .
Обладает слабо выраженными кислотными свойствами, в частности, подобно кислотам взаимодействует со щелочными металлами, а также магнием, алюминием и их гидридами, выделяя при этом водород и образуя солеподобные этилаты, являющиеся типичными представителями алкоголятов:
- .
Обратимо реагирует с карбоновыми и некоторыми неорганическими кислородсодержащими кислотами с образованием сложных эфиров:
- .
С галогеноводородами (HCl, HBr, HI) вступает в обратимые реакции нуклеофильного замещения:
- .
Без катализаторов реакция с HCl идёт относительно медленно; значительно быстрее — в присутствии хлорида цинка и некоторых других кислот Льюиса.
Вместо галогеноводородов для замещения гидроксильной группы на галоген могут быть использованы галогениды и галогеноксиды фосфора, тионилхлорид и некоторые другие реагенты, например:
- .
Сам этанол также обладает нуклеофильными свойствами. В частности, он относительно легко присоединяется по активированным кратным связям, например:
- .
Реагирует с альдегидами с образованием полуацеталей и ацеталей:
- .
При умеренном (не выше 120 °C) нагревании с концентрированной серной кислотой или другими водоотнимающими средствами кислотного характера образует диэтиловый эфир:
- .
При более сильном нагревании с серной кислотой, а также при пропускании паров над нагретым до 350—500°C оксидом алюминия происходит более глубокая дегидратация. При этом образуется этилен:
- .
При использовании катализаторов, содержащих наряду с оксидом алюминия высокодисперсное серебро и другие компоненты, процесс дегидратации может быть совмещён с контролируемым окислением этилена элементным кислородом, в результате чего с удовлетворительным выходом удаётся реализовать одностадийный процесс получения окиси этилена:
- .
В присутствии катализатора, содержащего оксиды алюминия, кремния, цинка и магния, претерпевает серию сложных превращений с образованием в качестве основного продукта бутадиена (реакция С. В. Лебедева):
- .
В 1932 году на основе этой реакции в СССР было организовано первое в мире крупнотоннажное производство синтетического каучука.
В слабощелочной среде образует иодоформ:
- .
Эта реакция имеет некоторое значение для качественного и количественного определения этанола в отсутствие других веществ, дающих подобную реакцию.
Способы получения
Этанол может быть получен как микробиологическим способом, так и синтетическим путем. Микробиологический метод включает спиртовое брожение растительного сырья, содержащего углеводы, таких как сок винограда и других плодово-ягодных культур, зерно, картофель и меласса. В процессе брожения активируются ферменты дрожжей, преимущественно штаммов Saccharomyces cerevisiae, а также некоторых видов бактерий[2].
Полученный в результате брожения раствор, известный как брага, содержит менее 15 % этилового спирта. Для очистки и концентрации браги используется процесс ректификации. На выходе получается спирт-ректификат, представляющий собой азеотропную смесь этилового спирта (95,6 % по массе) и воды, с температурой кипения 78,15 °C[2].
В процессе бродильного производства образуются отходы, среди которых можно выделить эфиро-альдегидную фракцию, метанол, сивушное масло и барду[2].
Гидролизный этиловый спирт представляет собой продукт, получаемый в результате брожения углеводов, которые извлекаются из целлюлозы, содержащейся в отходах деревообрабатывающей промышленности. В современных промышленных условиях основным методом синтетического производства этилового спирта является прямая гидратация этилена. Этот процесс осуществляется при температуре 300 °C и давлении 7 МПа с использованием катализатора, которым чаще всего является ортофосфорная кислота, нанесённая на пористый носитель, например, силикагель[2].
В ходе данного процесса образуются побочные продукты, включая диэтиловый эфир, ацетальдегид, кротоновый альдегид, спирты с числом углеродов C3-C4, а также ацетон и метилэтилкетон. Для очистки получаемого этилового спирта применяется метод ректификации[2].
Абсолютный этиловый спирт, представляющий собой спирт с концентрацией 99,9 %, получают посредством перегонки азеотропной смеси, состоящей из этилового спирта, воды и бензола. Существуют различные методы абсолютирования этилового спирта, включая использование молекулярных сит, полупроницаемых мембран, а также абсорбцию с помощью жидкого углекислого газа [2].
Применение
В промышленности
Исследования показали, что российские производители спиртовой продукции преимущественно используют в качестве сырья зерновые культуры, такие как пшеница и рожь, а также побочный продукт сахарного производства — мелассу. В историческом контексте проанализирован процесс совершенствования стандартов качества этилового спирта[10].
Этанол широко используется в различных отраслях промышленности в качестве растворителя. Он находит применение в лакокрасочной, фармацевтической, парфюмерной и других сферах. Этиловый спирт служит сырьём для производства таких веществ, как диэтиловый эфир, ацетальдегид, уксусная кислота, этилацетат, этиламины и других химических соединений. Для технических нужд применяется денатурированный этиловый спирт, известный как денатурат, который содержит добавки, препятствующие его употреблению в пищу[2].
Этанол - как автомобильное топливо
Основная статья: Биоэтанол
В некоторых странах этиловый спирт используется в качестве компонента автомобильного топлива, где его содержание варьируется от 10 % в Соединённых Штатах Америки до полной замены бензина этиловым спиртом в Бразилии[2][16].
Медицина
Этанол находит широкое применение в области медицины. Он используется в качестве дезинфицирующего средства для обработки поверхностей и инструментов, что способствует снижению риска инфекций. Кроме того, этиловый спирт применяется для консервирования биопрепаратов, что позволяет сохранять их активность и стабильность на протяжении длительного времени[2].
Токсикология этанола
Токсичность
Международное агентство по изучению рака (МАИР) классифицировало этанол как канцероген, представляющий опасность для здоровья человека[3]. Крайняя форма тяжёлой интоксикации представляется отравлением. Алкоголь, опиоиды, снотворные и седативные средства, а также летучие органические растворители могут вызывать глубокое помрачение сознания, вплоть до комы, и приводить к значительному угнетению гемодинамики и дыхательной функции. В случае отравления стимуляторами и галлюциногенами наблюдаются выраженное психомоторное возбуждение, нарушения сердечного ритма и ишемия жизненно важных органов, таких как мозг, сердце и почки. Пациенты, подвергшиеся отравлениям психоактивными веществами (ПАВ), требуют специализированной токсикологической помощи, в связи с чем могут применяться различные коды Международной классификации болезней десятого пересмотра (МКБ-10).Тяжёлая степень острой интоксикации алкоголем диагностируется при концентрации алкоголя в крови 3-5 г/л[8].
Изучение активности этанолокисляющих ферментов в головном мозге способствует углублению понимания патогенеза алкогольной кардиомиопатии (АКМП) и повышению объективности судебно-медицинской диагностики данного состояния. Исследование распределения этанола подтвердило, что летальный исход при АКМП может происходить на этапе элиминации в условиях лёгкой и средней степени алкогольной интоксикации. Важно отметить, что в ликворе были зафиксированы относительно высокие концентрации алкоголя, что имеет значительное патогенетическое и диагностическое значение[7].
Алкогольдегидрогеназа была выявлена в нейронах ядра голубоватого места и магноцитах ретикулярной формации, в то время как её отсутствие было отмечено в нейронах ганглионарного слоя лимбической коры переднего мозга. Активность альдегиддегидрогеназы была установлена в нейронах поясной извилины и гигантоклеточной ретикулярной формации, отсутствие этой активности в нейронах голубоватого места также было задокументировано. В капиллярах всех исследованных участков мозга была зарегистрирована активность альдегиддегидрогеназы, причём эта активность коррелировала со степенью и стадией алкогольной интоксикации[7].
Было отмечено статистически значимое снижение активности алкогольдегидрогеназы при наличии АКМП, причину чего следует искать в накоплении ацетальдегида. Данный показатель может быть использован в судебно-медицинской практике в качестве диагностического маркера АКМП. Оценка гистохимически определяемой энзиматической активности алкогольдегидрогеназы в мозге должна проводиться с учётом установленных закономерностей, связанных с токсикокинетикой и токсикодинамикой этанола[7].
Исследования показывают, что мужчины, потребляющие 9 и более стандартных доз алкоголя в день, имеют в 2,4 раза больший риск инфаркта миокарда по сравнению с абстинентами, то есть людьми, почти не употребляющими алкоголь. Для женщин, которые употребляют 5 и более стандартных доз алкоголя в день, риск инфаркта миокарда возрастает в 2,8 раза[17].
Другое исследование указывает на то, что употребление 6-7 бутылок пива (более 72 граммов алкоголя) за одну выпивку увеличивает риск фатального инфаркта миокарда у мужчин в 7 раз. Данные ангиографических исследований свидетельствуют о том, что спорадическое потребление алкоголя приводит к увеличению окклюзии коронарных сосудов примерно на 25 %. В литературе фиксируются случаи инфаркта миокарда у молодых людей с нормальными коронарными ангиограммами, наблюдавшиеся через час после острой алкогольной интоксикации[17].
Такое воздействие также замечено у пациентов со стабильной стенокардией, у которых острая алкогольная интоксикация провоцирует ишемию. Эти результаты свидетельствуют о том, что эпизодическое употребление больших доз алкоголя ассоциируется с повышенным риском сердечно-сосудистой смертности, как через спазм коронарных сосудов у практически здоровых лиц, так и через провокацию ишемии у пациентов с ишемической болезнью сердца. Результаты анализа подтверждают наличие тесной взаимосвязи между потреблением алкоголя и сердечно-сосудистой смертностью у населения. Данное исследование также указывает на то, что резкие колебания сердечно-сосудистой смертности в России, наблюдавшиеся в последние десятилетия, в значительной степени связаны с изменениями уровня потребления алкоголя. Полученные данные косвенно свидетельствуют о том, что паттерн потребления алкоголя, ориентированный на интоксикацию, является фактором риска сердечно-сосудистой смертности[17].
Меры предосторожности
Производство этилового спирта в России регулируется Приказом Федеральной службы по регулированию алкогольного рынка от 17 декабря 2020 г. № 395 “Об утверждении перечня пищевого и непищевого сырья, используемого для производства этилового спирта”. В нём указан перечень непищевого и пищевого сырья, используемого для производства этилового спирта[12].
См. также
Литература
- Химия и токсикология этилового спирта и напитков, изготовленных на его основе [Текст]: хроматографический анализ спиртных напитков / С. А. Савчук, В. П. Нужный, В. В. Рожанец. - Москва: URSS, 2010. - 181 с.: ил., табл.; 22 см.; ISBN 978-5-397-01624-7.
- Винаров, А. Ю. Безотходная биотехнология этилового спирта / А. Ю. Винаров, А. А. Кухаренко, Н. Е. Николайкина. - 2-е изд., перераб. и доп. - Москва : Юрайт, 2022. - 215, [2] с. : ил. - (Высшее образование). - Библиогр.: с. 203-217. - ISBN 978-5-534-15582-2.
Примечания
- ↑ 1,0 1,1 Этиловый спирт: химические и физические свойства. Дата обращения: 28 сентября 2012. Архивировано 6 декабря 2012 года.
- ↑ 2,00 2,01 2,02 2,03 2,04 2,05 2,06 2,07 2,08 2,09 2,10 2,11 2,12 Рудаков О. Б. Этиловый спирт. БРЭ (17 июня 2022). Дата обращения: 3 сентября 2024.
- ↑ 3,0 3,1 Последние глобальные данные о бремени рака и потреблении алкоголя: Более 740 000 новых случаев рака в 2020 году связаны с алкоголем. Международное агенство по изучению рака. Дата обращения: 3 сентября 2024.
- ↑ Клевно В. А., Максимов А. В. Анализ случаев смертельных исходов у детей с наличием этанола в крови // Медико-социальная экспертиза и реабилитация : журнал. — 2018. — № 1—2.
- ↑ Межгосударственный стандарт спирт этиловый. Правила приёмки и методы анализа. Ethanol. Acceptance rules and test methods. Электронный фонд правовых и нормативно-технических документов. АО «Кодекс» (1 января 1995). Дата обращения: 8 сентября 2024.
- ↑ Межгосударственный стандарт. Растворы водно-спиртовые. Методы определения концентрации этилового спирта Water-alcohol solutions. Methods for the determination of the ethyl alcohol content. АО «Кодекс» (1 января 1982). Дата обращения: 8 сентября 2024.
- ↑ 7,0 7,1 7,2 7,3 Морозов Ю. Е., Охотин В. Е., Калиниченко С. Г. Значение этанолокисляющих ферментов мозга для судебно-медицинской диагностики алкогольной кардиомиопатии // Проблемы экспертизы в медицине : журнал. — 2001.
- ↑ 8,0 8,1 Клинические рекомендации. Острая интоксикация психоактивными веществами. Министерство здравоохранения Российской Федерации (1 января 2020). Дата обращения: 8 сентября 2024.
- ↑ Всероссийский научно-исследовательский институт пищевой биотехнологии Россельхозакадемии (ГНУ ВНИИПБТ Россельхозакадемия). Межгосударственный стандарт. Спирт этиловый.Спектрофотометрический метод определения содержания денатурирующих добавок (битрекса, керосина, бензина) Ethanol. Spectrophotometryc method for determination of denaturant additives (bitrex, kerosene, gasoline) content. АО «Кодекс» (1 июля 2013). Дата обращения: 8 сентября 2024.
- ↑ 10,0 10,1 Олефир Ю. В., Хубиева А. Ю., Ковалева Е. Л., Митькина Л.И., Стружкова А. А., Савин Е. В. Обеспечение качества этилового спирта как лекарственного средства // Ведомости Научного центра экспертизы средств медицинского применения : журнал. — 2020. — 1 октября. — С. 6—18.
- ↑ Маркизова Н. Ф., Гребенюк А. Н., Башарин В. А., Бонитенко Е. Ю. Спирты. Серия: Токсикология для врачей. — СПб.,: Фолиант, 2004. — 110 с. — ISBN 5-93929-089-2 : 2000.
- ↑ 12,0 12,1 Приказ Федеральной службы по регулированию алкогольного рынка от 17 декабря 2020 г. № 395 “Об утверждении перечня пищевого и непищевого сырья, используемого для производства этилового спирта”. Федеральная служба по регулированию алкогольного рынка (12 января 2021). Дата обращения: 9 сентября 2024.
- ↑ 13,0 13,1 13,2 13,3 Карпов С. А. Развитие производства этанола как альтернативного источника автомобильного топлива // Альтернативная энергетика и экология : журнал. — 2006.
- ↑ Ernest W. Flick Industrial Solvents Handbook, Fifth Edition, Noyes Data Corporation (ndc), Westwood, NJ/USA, 1998, S. 252
- ↑ Давление насыщенного пара в мм рт.ст. над органической жидкостью при температуре (°С) Анилин, Ацетон, Бензол, Бромбензол, Бутанол, Гексан, Гептан, Дихлорэтан, Изопропанол... 10-140°С - Инженерный справочник DPVA.ru / Технический справочник ДПВА / Таблицы для инженеров (ex DPVA-info). dpva.ru. Дата обращения: 19 мая 2022.
- ↑ Вильданов Ф. Ш., Латыпова Ф. Н., Чанышев Р. Р., Николаева С. В. Современные методы получения биоэтанола // Башкирский химический журнал : журнал. — 2011. — Т. 18, № 2. — С. 128-133.
- ↑ 17,0 17,1 17,2 Разводовский Ю. Е. Алкоголь и сердечно-сосудистая смертность: популяционный уровень взаимосвязи // Проблемы здоровья и экологии : журнал. — 2007. — С. 123.
Данная статья имеет статус «готовой». Это не говорит о качестве статьи, однако в ней уже в достаточной степени раскрыта основная тема. Если вы хотите улучшить статью — правьте смело! |
Ссылки
- Знание.Вики:Cite web (не указан язык)
- Страницы, использующие волшебные ссылки ISBN
- Страницы с неработающими файловыми ссылками
- Химические вещества по алфавиту
- Знание.Вики:Готовые статьи по химии
- Знание.Вики:Готовые статьи по алфавиту
- Алкоголь
- Топливо
- Биотопливо
- Растворители
- Парфюмерия
- Канцероген
- Спирты
- Алкогольная продукция
- Производство
- Химия
- Отклонённая статья
- Страницы, использующие химические теги в устаревшем формате