Глицерин
| Глицерин | |
|---|---|
  | |
 | |
| Общие | |
| Традиционные названия | глицерин |
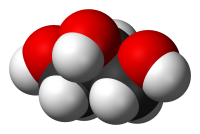
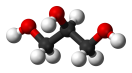
| Хим. формула | C3H8O3 |
| Рац. формула | HOCH2-CH(OH)-CH2OH |
| Физические свойства | |
| Молярная масса | 92,09 г/моль |
| Плотность | 1,261 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 17,9 °C |
| • кипения | 290 °C |
| • разложения | 290 °C |
| • вспышки | 160 °C |
| Оптические свойства | |
| Показатель преломления | 1,4740 |
| Классификация | |
| Рег. номер CAS | 56-81-5 |
| SMILES | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Глицери́н — органическое соединение, простейший представитель трёхатомных спиртов , для человека не токсичен. При стандартных условиях 25 °C, 100 кПа представляет собой бесцветную, маслянистую жидкость[1].
История открытия
Глицерин был открыт Карлом Вильгельмом Шееле, когда тот омылял жиры в присутствии оксидов свинца. По большей части глицерин получают вторичным продуктом при омылении жиров[1].
Физические свойства
Вязкая жидкость, не имеющая запаха и цвета, имеет сладковатый привкус, из-за чего и был назван от (греч.γλυκερός — сладкий). Молярная масса 92,09 г/моль, температура плавления 17,9 °C, кипения 290 °C. Является растворителем множества органических соединений: солей, щелочей, сахаров[1].
Химические свойства
Трёхатомный спирт, получаемый при гидролизе или омылении растительных масел и (или) животных жиров без применения методов синтеза.
Глицерин реагирует с активными металлами (калием, натрием и др.), которые замещают водород во всех гидроксильных группах, вступают в реакции с галогеноводородами (, и др.), в реакции дегидратации, образуя различные эфиры[1].
Качественные методы анализа
Акролеиновая проба[2] — глицерин смешивают с сернокислым калием и нагревают. Так как при быстром нагревании глицерина, особенно в присутствии гидроотнимающих средств образуется акролеин, то при наличии глицерина в испытуемом растворе и его быстром нагреве выделяется акролеин, его определяют по запаху.
Фенольная проба[3] — в пробирку помещают 2-3 капли глицерина, столько же расплавленного фенола и 2-3 капли серной кислоты, после чего нагревают до 120 °C, получая буровато-жёлтую массу, растворяемую при охлаждении в воде. Этот раствор окрашивается в карминово-красный цвет при добавлении аммиака.
Глицерин имеет и специфические свойства, отличающие его от одноатомных спиртов: он вступает в реакцию не только со щелочными металлами, но и с некоторыми основаниями, в том числе нерастворимыми.
Получение
В настоящее время известны 3 синтетических способов получения[4] глицерина — хлорный, бесхлорный и комбинированный, но наиболее рациональным из них является способ получения через акролеин. Изопропиловый спирт, используемый для восстановления акролеина, получают из пропилена, а перекись водорода — при окислении изопропилового спирта, побочным продуктом является ацетон.
Но основную массу производимого на данный момент глицерина получают как побочный продукт мыловарения — при омылении[5] растительных и животных жиров и масел.
Также при производстве биотоплива глицерин получают в качестве побочного продукта.
Область применения
Глицерин широко используется во множестве отраслях[6]:
- Военное дело — из глицерина путем нитрования получают нитроглицерин, который используется для получения динамита, так же получают бездымный порох и другие взрывчатые вещества.
- В пищевой промышленности глицерин зарегистрирован как пищевая добавка Е422, применяется в качестве регулятора вязкости.
- В медицине глицерин применяют в качестве антисептика при лечении множества заболеваний, например кожных (способствует заживлению ран, препятствует заражению и гноению), а также как слабительное средство для взрослых при запорах.
- В косметологии глицерин это дерматопротекторное средство. Смягчает кожу и слизистые оболочки. Глицерин применяется для устранения сухости, покраснений кожи. Также используется для создания мыла.
- В настоящее время глицерин используется вместе с пропиленгликолем в качестве жидкости для электронных парогенераторов.
Токсичность
При небольшом количестве употребления не токсичен[7] для человека, но при больших дозах может вызвать отравление с появлением таких симптомов как: тошнота, головокружение, боли в животе.
Литература
- Неволин Ф. В. Химия и технология производства глицерина / канд. техн. наук Ф. В. Неволин. — Москва: Пищепромиздат, 1954. — 204 с.
- Лещенко Н. Ф. Технология производства глицерина из жиров и масел и его применение / Н. Ф. Лещенко. — М.: Пищепромиздат, 1998. — 190 с.
Примечания
- ↑ 1,0 1,1 1,2 1,3 The National Institute for Occupational Safety and Health. Glycerin. The National Institute for Occupational Safety and Health. Дата обращения: 7 декабря 2023.
- ↑ Неволин Ф. В. Химия и технология производства глицерина. Справочник химика 21. Дата обращения: 12 декабря 2023.
- ↑ ГОСТ Р 54948-2012. Консорциум Кодекс. Дата обращения: 7 декабря 2023.
- ↑ Методы получения глицерина. Справочник химика 21. Дата обращения: 7 декабря 2023.
- ↑ Лещенко Н. Ф. Технология производства глицерина из жиров и масел и его применение. — Москва: Пищепромиздат, 1998. — 189 с. — ISBN ISBN 5-89703-005-7.
- ↑ Области применения глицерина. Алхимгрупп. Дата обращения: 7 декабря 2023.
- ↑ ГОСТ 6823-2017 Глицерин натуральный сырой. Общие технические условия. https://b.twirpx.link/.+Дата обращения: 7 декабря 2023.
Данная статья имеет статус «готовой». Это не говорит о качестве статьи, однако в ней уже в достаточной степени раскрыта основная тема. Если вы хотите улучшить статью — правьте смело! |
- Знание.Вики:Cite web (не указан язык)
- Страницы, использующие волшебные ссылки ISBN
- Химические вещества по алфавиту
- Знание.Вики:Готовые статьи по науке
- Знание.Вики:Готовые статьи по химии
- Знание.Вики:Готовые статьи по медицине
- Знание.Вики:Готовые статьи по алфавиту
- Многоатомные спирты
- Эмульгаторы
- Продукция основного органического синтеза
- Косметические вещества



