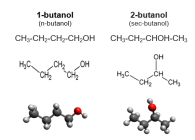
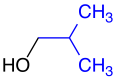
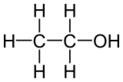
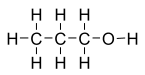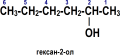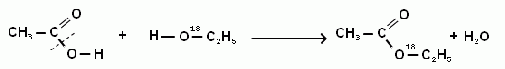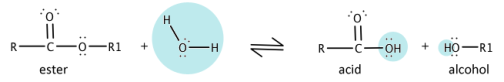Спирты
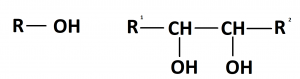
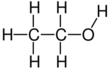
Спирты́ (от лат. spiritus — дух, душа), (алкого́ли) — функциональные производные углеводородов, кислородсодержащие органические соединения, гидроксисоединения, содержащие одну или более гидроксильных групп (−OH), непосредственно связанных с насыщенным атомом углерода, находящимся в состоянии sp³-гибридизации. Многие спирты имеют тривиальные названия. Например, метанол — древесный спирт, этанол — винный спирт, цис-3-гексен-1-ол — спирт листьев. На человеческий организм спирты оказывают токсичное воздействие, являясь ксенобиотиками, обладают наркотическими свойствами, раздражают нервную систему. Метанол, этанол — опасные для человека яды, контаминанты. Этиленгликоль — ядовитое вещество, образующее при попадании в организм человека токсичные метаболиты[1].
История открытия
По мнению историков, уже за 8 веков до нашей эры человек употреблял напитки, содержащие этиловый спирт, полученный при брожении фруктов и мёда. Примерно в VI — VII веках арабы выделили этанол в чистом виде из вина, европейцы получили этанол в XII веке. В XVII веке метанол перегонкой древесины, а в XIX веке химики установили, что спирты образуют целый класс органических веществ[2][3].
В Западной Азии люди делали вино уже в 5400—5000 годах до нашей эры. При этом китайцы изготавливали крепкие напитки на основе мёда, риса и винограда. Они делали это еще в 7000—6500 годах до нашей эры. Выделить чистый спирт из вина впервые удалось арабам в VI веке, описанные исследователем Абу Бакром Мухаммадом ар-Рази[4][5].
Получение спирта методом дистилляции жидкостей первым описал Аристотель (384—320 годы до нашей эры). Многие учёные того периода занимались усовершенствованием процесса перегонки. Алхимик Джабир ибн Хайян Абу Муса из Египта и александрийский учёный Зосим де Панополис подробно описали принцип действия дистилляционного аппарата и были уверены, что путём дистилляции смогли выделить душу вина. В IX веке итальянские учёные сконструировали дистилляционный аппарат, на котором получили этанол из продуктов брожения. Пар и конденсат, образующиеся при нагревании в дистилляционном аппарате, назвали «Spiritus Vini», что в переводе с латынского языка означало «дух вина» или — спирты[2][5].
В 1334 году врач Арно де Вилльгер первым произвёл винный спирт, названный «водой жизни». Уже в 1360 году его стали изготавливать в монастырях Франции и Италии. В 1386 году генуэзское посольство привезло винный спирт в Россию в подарок царскому двору. В 1661 году английский химик Роберт Бойль первым получил метанол из древесины. В 1761 году российский учёный Иоганн Тобиас Ловиц изобрёл этанол абсолютированный. Английский учёный Александр Уильям Уильямсон в 1850 году вывел формулу этанола. В 1856 году французский исследователь Шарль Адольф Вирц получил этиленгликоль, в составе которого были две гидроксильные группы и который был отнесён к классу двухатомных спиртов[2][5].
В 1842 году немецкий химик Якоб Генрих Вильгельм Шиль установил закономерность спиртов формировать гомологический ряд, в котором каждый последующий спирт отличался от предыдущего на определённую группу атомов, являющейся постоянной, с формулой С2Н2. Это было ошибкой. В 1844 году химик Шарль Фредерик Жерар установил правильную гомологическую разность — (-СН2)[2].
Строение и физические свойства
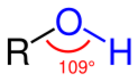
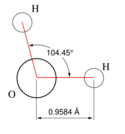
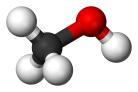
Cпирты рассматривают как производные углеводородов, в молекулах которых один атом водорода замещён на органическую функциональную группу R—O—H. Спирты геометрически подобны молекуле воды: угол в молекуле метанола равен 109 °С, при этом кислород в гидроксильной группе находится в состоянии sp³-гибридизации[6][7][8].
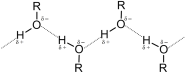
Молекула спирта, в отличие от молекул углеводородов, полярна. Кислород — это неметалл с высокой электроотрицательностью (ЭО = 3,5). Он оттягивает на себя общую электронную пару и от атома углерода и водорода. За счёт близости общих электронных пар атом кислорода приобретает некоторый избыточный отрицательный заряд (δ-), а обделённые электронами углерод и водород приобретают некоторый положительный заряд (δ+). Разница между полюсами отрицательными и положительными областями молекулы называется полярностью молекулы. Если связи между этими атомами слабополярны, такие молекулы называют неполярными. Полярность молекул спиртов объясняет их физические свойства[9][10].
Так как в спиртах имеются межмолекулярные водородные связи, температуры плавления и кипения высокие. Наличие в молекуле спиртов гидроксильной группы (— ОН) оказывает влияние на физические свойства спиртов: растворимость в воде, плотность, температуру кипения. Среди спиртов, в отличие от углеводородов, нет газов. Это объясняется образованием прочных водородных связей между атомом кислорода молекулы спирта и атомами водорода гидроксильных групп соседних молекул. По этой же причине спирты хорошо растворимы в воде[11].
Метанол, этанол и пропанол как соединения с небольшой длиной углеводородной цепи смешиваются с водой в любых соотношениях неограниченно и имеют высокую плотность и температуру кипения для своей молекулярной массы[12].
Высшие спирты с водой не смешиваются, то есть гидрофобны, и мало отличаются по свойствам от соответствующих углеводородов. Растворимость спиртов в воде уменьшается с увеличением молекулярной массы, так, начиная с гексилового спирта, одноатомные спирты практически нерастворимы. Высшие спирты в воде не растворяются. Растворимость спиртов с разветвленной структурой выше, чем у спиртов с имеющих неразветвленное, нормальное строение[6][8][9][11].
Предельные неразветвленные спирты с числом атомов углерода С1 — С11 при нормальных условиях — жидкости, являются хорошими растворителями. Спирты с числом атомов углерода более С12 — твёрдые вещества. Температуры плавления и кипения спиртов выше, чем у соответствующих им алканов и альдегидов. Положительно заряженный водород гидроксильной группы электростатически притягивается к отрицательно заряженному кислороду соседней молекулы. Эти водородные связи препятствуют испарению вещества. Все спирты легче воды, так как их плотность меньше единицы. Низшие спирты (С1 — С3) неограниченно смешиваются с водой, имеют специфический «спиртовый» запах. Спирты с содержанием атомов углерода С4 — С5 обладают удушливым (сивушным) запахом, начиная со спиртов, в которых атомов углерода С6 и более запаха не имеют. Арилалифатические спирты и терпеноиды, содержащие ОН-группу, имеют фруктово-цветочный запах. Многоатомные спирты не имеют неприятного запаха и даже сладковатые на вкус.[6][8][9]. Спирты с числом атомов углерода С1 — С11 ядовиты или вредны для здоровья.
Классификация
Все спирты делят по следующим признакам: по числу гидроксильных групп, по строению углеводородного радикала, типу атома углерода, с которым связана гидроксильная группа. Классификация спиртов приведена в таблицах 1, 2, 3[6][8][9].
| Название | Пример представителя спирта | Химическая формула (сокращённая, полная) | Структурная формула | Шаростержневая модель (по Бриглебу) |
|---|---|---|---|---|
| Одноатомные спирты | Метанол | СН4О, CH3OH | ||
| Двухатомные спирты | Этиленгликоль | C2H6О2, C2H4(ОН)2 | ||
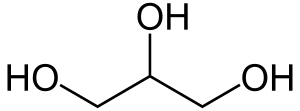
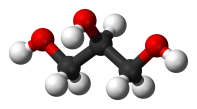
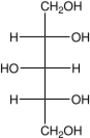
| Трёхатомные спирты | Глицерин | C3H8О3, HOCH2 — CH(OH) — СH2OH | ||
| Многоатомные спирты | Ксилит | C5H12О5 |
| Название,
общая формула |
Пример представителя спитра | Химическая формула (сокращённая, полная) | Структурная формула | Шаростержневая модель |
|---|---|---|---|---|
| Алифатические (ациклические) предельные (насыщенные) спирты,
CnH2n+1OН, группа (- ОН) соединена с предельным углеводородным радикалом |
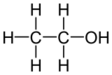
Этанол (этиловый спирт) | C2H6О, C2H5ОН | ||
| Пропанол-1 (пропиловый спирт) | C3H8О, C3H7ОН | |||
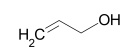
| Алифатические непредельные (ненасыщенные) спирты, группа (- ОН) соединена с непредельным углеводородным радикалом | Аллиловый спирт (проп-2-ен-1-ол) | C3H6О, C3H5ОН | ||
| Непредельные спирты, группа (- ОН) соединена с атомов углерода при двойной связи, содержат в радикале ароматическое кольцо, не связанное непосредственно с группой (- ОН) | Бензиловый спирт (фенилкарбинол, фенилметанол, гидроксиметилбензол) | C7H8О,
C6H5CH2ОН |
| Графическое изображение | Название, общая формула | Пример представителя спиртов | Химическая формула | Структтурная формула |
|---|---|---|---|---|
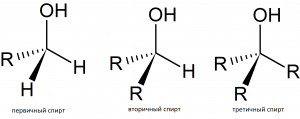
| Первичные спирты, содержат одновалентную спиртовую группировку атомов, R — CH2OH | этанол, этиловый спирт | C2H6О, C2H5ОН | ||
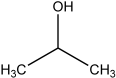
| Вторичные спирты, содержат двухвалентную спиртовую группировку атомов, R — CHOHR¹ | пропанол–2 | C3H8О | ||
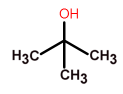
| Третичные спирты, содержат трёхвалентную спиртовую группировку атомов, R — CHOH — CH2R¹ | 2–метилпропанол–2,
третичный бутиловый спирт |
(СН3)3С-ОН |
Номенклатура
Спирты называют по систематической номенклатуре ИЮПАК (IUPAC — Международный союз теоретической и прикладной химии) по названию соответствующего углеводорода с добавлением суффикса «-ол» и цифры, которая указывает положение гидроксильной группы (- ОН). Названия углеводородов составляют в соответствии со следующими правилами[9]:
- для установления названия выбирают саму длинную углеродную цепь, установив число атомов углерода, в состав которой входит гидроксогруппа (- ОН);
- нумеруют атомы углерода в длинной углеродной цепи с того края, к которому ближе расположена гидроксильная группа;
- местоположение гидроксильной группы в названии определяют написанием цифры после суффикса «-ол»;
- если в составе спирта присутствуют другие функциональные группы, то нумерация углеродного скелета начинается с того края, где расположена старшая функциональная группа, её название указывают перед названием спирта цифрой. Например[6]:
- CH3 — CH2 — СН2 — CH2 — ОН, пропанол-1;
- CH3 — CH (ОН) — СН2 — CH3, пропанол–2,
- CH3 — CH(CH3) — СН2 — СН2ОН, 2-метилбутанол-1[6].
По радикально-функциональной номенклатуре название спиртов формируется от названия углеводородного радикала с добавлением слова «спирт», например[14]:
- СH3 — OH — метанол или метиловый спирт;
- C2H5OH — этанол или этиловый спирт;
Тривиальные названия были даны спиртам по природному источнику получения. Например, метанол называют древесным спиртом, а этанол — винным спиртом. Тривиальные названия некоторых спиртов приведены в таблице 4.
| Химическая формула спирта | Название по номенклатуре ИЮПАК | тривиальное название |
|---|---|---|
| Предельные одноатомные спирты | ||
| CH3OH | метанол | древесный спирт |
| C2H5OH | этанол | винный спирт |
| C5H11OH | пентан-1-ол | амиловый спирт |
| C16H33OH | гексадекан-1-ол | цетиловый спирт |
| Предельные многоатомные спирты | ||
| C2H4(ОН)2 | этан-1,2-диол | этиленгликоль |
| C3H5(ОН)3 | пропан-1,2,3-триол | глицерин |
| C5H7(ОН)5 | пентан-1,2,3,4,5-пентол | ксилит |
| C6H8(ОН)6 | гексан-1,2,3,4,5,6-гексол | сорбит |
| Непредельные алифатические спирты | ||
| C3H5OH | проп-2-ен-1-ол | аллиловый спирт |
| C10H17OH | 3,7-диметилокта-2,7-диен-1-ол | гераниол |
| Алициклические спирты | ||
| C6H6(OH)6 | циклогексан-1,2,3,4,5,6-гексол | инозит |
| C10H19OH | 2-(2-пропил)-5-метилциклогексанол-1 | ментол |
Изомерия
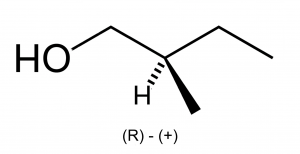
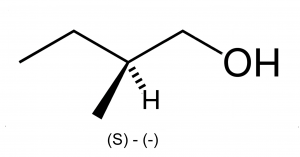
Для спиртов характерны структурная, межклассовая, пространственная (оптическая) изомерия и изомерия положения гидроксильной группы. Особенности различных видов изомерии спиртов приведены в таблице 5[6][9][14].
| Структурная изомерия
(характерна для спиртов с числом атомов углерода ≥С4) |
Межклассовая изомерия | Изомерия положения группы (-OH) | Пространственная (оптическая) изомерия |
|---|---|---|---|
| ии | и |
Нахождение в природе
В свободном состоянии спирты встречаются в природе достаточно часто, входят в состав сложных эфиров. Метанол содержится в небольших количествах в борщевике. Этанол содержится в тканях и крови животных и человека как продукт спиртового брожения органических продуктов (ягоды, фрукты), содержащих углеводы. 3-Гексен-1-ол содержится в эфирных маслах зелёных частей многих растений и придаёт им характерный запах. Фенилэтиловый спирт — душистый компонент розового эфирного масла. Терпеновые спирты, многие из которых являются душистыми веществами, также можно встретить в растительном мире[8].
Ментол содержится в эфирном масле мяты и герани
Бисаболол входит в состав эфирного масла ромашки, тополя
Фенхол содержится в смоле хвойных деревьев и плодах фенхеля
Сабинол содержится в эфирном масле тысячелистника
Туйол содержится в эфирном масле шалфея
В животном и растительном мире распространены конденсированные тетрациклические спирты, обладающие высокой биологической активностью и входящие в класс стероидов, нахождение в природе которых приведено в таблице 6[8].
| Холестерол | Эргостерол | Сорбитол | Маннит |
|---|---|---|---|
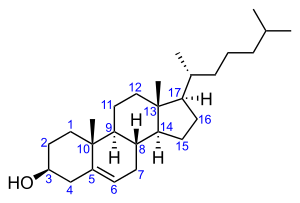 Холестерол содержится в клетках растительных и животных организмов |
 Эргостерол содержится в некоторых водорослях и грибах |
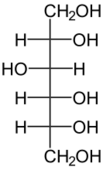 Сорбитол содержится в ягодах вишни и рябины |
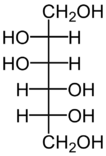 Маннитол содержится в морских водорослях, грибах |
Химические свойства
Общая формула одноатомных предельных спиртов: C2nH2n+1OH. В одноатомных и многоатомных спиртах имеют место водородная и ковалентная полярная связи. При протекании химических реакций в спиртах происходит разрыв одной из этих химических связей. Метанол, этанол, пропанол, изопропанол, этиленгликоль и глицерин смешиваются с водой в любых соотношениях. Спирты, содержащие две гидроксильные группы при одном и том же атоме углерода, не являются устойчивыми, в результате перегруппировки атомов они превращаются в альдегиды или кетоны с отщеплением молекулы воды. Спирты, содержащие двойную связь в молекуле у атома углерода, связанного с гидроксильной группой (- ОН), называют енолами, которые в результате перегруппировки атомов (кетоно-енольная таутомерия) также превращаются в альдегиды или кетоны. Спирты относят к неэлектролитам, в водных расворах они не диссоциирруют на ионы, поэтому их кислотные свойства выражены слабее, чем у воды[6][9].
Кислотно-основные свойства
Взаимодействие с металлами
За счет полярности связи гидроксильной группы (-OH) водород в спиртах достаточно легко замещается, что объясняет их кислотные свойства. При взаимодействии с активными металлами (натрий, калий) в безводном состоянии спирты проявляют слабые кислотные свойства, при этом образуются алкоголяты (этилат натрия)[9][14]:
2C2H5OH + 2Na ⇔ 2C2H5ONa + Н2↑
2C2H5OH + 2K ⇔ 2C2H5OK + Н2↑
Многоатомные спирты (этиленгликоль, глицерин) также реагируют с активными металлами[9]:
HOCH2 — СH2OH + 2Na ⇔ NaOCH2 — СH2ONa + Н2↑
Взаимодействие со щелочами
С водными растворами щелочей одноатомные спирты практически не взаимодействуют (идёт необратимый процесс гидролиза алкоголятов), так как являются слабыми кислотами по отношению к воде. С твёрдыми щелочами спирты взаимодействуют, реакция обратимая со смещением равновесия влево. С увеличением углеродного скелета основность спиртов увеличивается[10][15]:
C2H5OH + NaОН(тв) ⇔ C2H5ONa + Н2О
У многоатомных спиртов кислотные свойства выражены сильнее, чем у одноатомных, поэтому такие реакции возможны. Реакция идет в основном только по одной группе (-ОН), реакция обратимая со смещением равновесия в сторону исходных веществ[15][11]:
HOCH2 — СH2OH + NaОН ⇔ HOCH2 — СH2ONa + Н2О
Многоатомные спирты (этиленгликоль, глицерин) реагируют с гидрооксидом меди (II), Cu(OH)2 в присутствии щёлочи с образованием комплексной соли (качественная реакция на многоатомные спирты). При взаимодействии этиленгликоля со свежеосажденным гидроксидом меди (II) Cu(OH)2 образуется раствор гликолята меди ярко-синего цвета, причём реакция идет по одной гидроксильной группе (—ОН)[14]:
HOCH2 — СH2OH + Cu(OH)2 + HOCH2 — СH2OH → HOCH2 — СH2O — Cu — OCH2 — СH2OH + Н2О
Реакции замещения гидроксильной группы (—ОН)
Взаимодействие с галогеноводородами
В сильнокислой среде в присутствии концентрированной серной кислоты H2SO4 или с избытком галогеноводорода (хлорводорода НCl или бромводорода НBr) реакция замещения спиртовой группы на галоген протекает с образованием галогеналканов (хлорэтан C2H5Cl и бромэтан C2H5Br)[10][14]:
C2H5OH + НCl → C2H5Cl + H2O — в присутствии концентрированной серной кислоты H2SO4
C2H5OH + НBr → C2H5Br + H2O — избыток НBr
HOCH2 — СH2OH + 2НBr → BrCH2 — СH2Br + Н2О
Внутримолекулярная дегидратация
Так как серная кислота H2SO4 обладает водоотнимающими свойствами, то при температуре 180 °С происходит отщепление молекулы воды (дегидратация) от спирта (пропанол–2) с образованием двойной связи между атомами углерода в том месте, где вода отщепилась. В реакции образуются алкены (пропен–2)[9][14]:
CH3 — CH(ОН) — СН2 — СН2 — CH3 → CH3 — CH = СН2 — СН2 — CH3 + H2O
Межмолекулярная дегидратация
При щадящем нагреве до температуры около 140°С (при температуре выше происходит преимущественно отщепление с образованием алкена) в присутствии концентрированной серной кислоты H2SO4 происходит отщепление воды и объединение двух молекул спирта (этанола) в простой эфир (диэтиловый эфир)[14]:
CH3 — CH2 —OH + OH — CH2 — CH3 → CH3 — CH2 —O — CH2 — CH3
Данная реакция имеет практическое значение только для получения симметричных простых эфиров, если провести дегидратацию в смеси двух спиртов, получится смесь трех продуктов:
CH3—CH2—OH + CH3—CH2—CH2—OH CH2 → CH3—O—CH3 + CH3—CH2—CH2—O—CH3 + CH3—CH2—CH2—O—CH2—CH2—CH3
метанол + пропанол → диметиловый эфир + метилпропиловый эфир + дипропиловый эфир
Этерификация
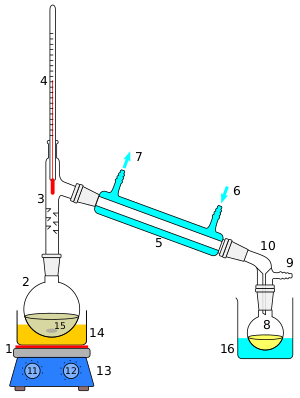
В присутствии концентрированной серной кислоты H2SO4 при реакции этерификации (рисунок 1) происходит конденсация молекул спирта (этанол) и карбоновой кислоты (этановая или уксусная кислота) с отщеплением воды, при этом образуется сложный эфир (этиловый эфир уксусной кислоты или этилацетат)[9].
Реакция этерификации обратимая — гидролиз сложных эфиров, протекает с образованием спирта и карбоновой кислоты (рисунок 2)[10].
Взаимодействие с аммиаком
Реакция протекает при нагревании спирта (этанол), гидроксильная группа (—OH) замещается на аминогруппу (—NH2), образуются амины (этиламин)[9][14]:
CH3 — CH2 —OH + NH3 → CH3 — CH2 — NH2 + H2O
Дегидрирование
Пары спирта (метанол) пропускают над медьсодержащим катализатором при температуре 300 °C. При этом отщепляется молекула водорода и образуется альдегиды (формальдегид или метаналь). Образование альдегидов характерно для дегидрирования первичных спиртов[14]:
CH3OH → CH2O + H2
При дегидрировании вторичных спиртов образуются кетоны[7][10]:пропанол–2 → ацетон
CH3 — CH(OH) — CH3 → CH3 — CH(O) — CH3
Третичные спирты в реакции дегидрирования не вступают[7][10].
Окисление
Горение спиртов
C2H5OH + 3O2 → 2CO2 + 3H2O.
Жидкофазное окисление с применением хромовой смеси
3C2H5OH + K2Cr2O7 + 4H2SO4 → 3CH3COOH + K2SO4 + Cr2(SO4)3 + H2O.
этанол + хромовая смесь (K2Cr2O7 + 4H2SO) → этановая кислота (карбоновая кислота) + сульфат калия + сульфат хрома + вода
Окисление оксидом меди (II) при нагревании
CH3— CH2 — OH + CuO → 2CH3 — CHO + Cu + H2O.
При каталитическом (медь-содержащий катализатор) окислении кислородом и при нагревании первичные спирты образуют альдегиды, вторичные спирты превращаются в кетоны, третичные окисляются с разрушением углеродного скелета[14]:
2CH3—OH + О2 → НСОН + 2H2O
метанол (первичный спирт) + кислород → метаналь (альдегид) + вода
2CH3—СНОН—CH2—CH3 + О2 → 2CH3 — СН(О)—CH2—CH3 + 2H2O
бутанол-2 (вторичный спирт) + кислород → 2-бутанон(кетон) + вода
Окисление спиртов перманганатом калия
В кислой среде окисление спиртов продолжается до угольной кислоты, при этом степень окисления углерода меняется от −2 до +4. Однако угольная кислота неустойчива, поэтому результатом реакции является углекислый газ + вода (СО2 + H2O)[14]:
5CH3—OH + 6KMnO4 + 9H2SO4 → 5СО2 + 5H2O + 3K2SO4 + 6MnSO4 + 14H2O
метанол + перманганат калия + серная кислота → угольная кислота (СО2 + H2O) + сульфат калия + сульфат магния + вода
При окислении первичных спиртов образуется карбоновая кислота, при этом окраска раствора изменяется с фиолетовой до бесцветной[14]:
5C2H5OH + 4KMnO4 + 12НСl → 5CH3—СOОН + 4MnCl2 + 4KCl + 11H2O
этанол + перманганат калия + соляная кислота → этановая кислота (карбоновая кислота) + хлорид магния + хлорид калия + вода.
Вторичные спирты окисляются до кетонов[13][16]:
5СН3-СНОН-СН3 + 2KMnO4 + 6HCl → 5CH3—CO—CH3 + 2MnCl2 + 8H2O + 2KCl
пропанол-2 (вторичный спирт) + перманганат калия + соляная кислота → ацетон (кетон) + хлорид магния + хлорид калия + вода.
Третичные спирты более устойчивые соединения к окислению. Реакция окисления возможна в кислой среде и при нагревании. При этом разрушается углеродный скелет спирта и образуется смесь карбоных кислот и кетонов с меньшим числом атомов углерода. Процесс окисления идёт через стадию дегидратации с последующим деструктивным окислением алкена. Схематично данный процесс можно записать следующим образом[9][16][17]:
CH3—(CH3)СН(ОН)—CH2—CH3 → CH3—С(CH3)=CH2—CH3 → CH3—CO-CH3 + CH3—COОН
2-метил-бутанол-2 + окислитель →(t, H+) 2-метил-бутен-2 →(t, KMnO4) ацетон (кетон) + этановая кислота (карбоновая кислота).
Многоатомные спирты при окислении образуют различные продукты. Состав продуктов зависит от взаимного положения гидроксильных групп в молекуле многоатомного спирта и природы окислителя. Спирты с гидроксогруппами у соседних атомов в зависимости от условий окисляются с сохранением С—С-связей углеродного скелета или с их разрывом. Окисление этиленгликоля в кислой среде под действием оксида хрома (III) CrO3 и азотной кислоты HNO3 происходит с образованием щавелевой кислоты как продукта по схеме[17]:
этиленгликоль → гликолевый ангидрид → гликолевая кислота → глиоксиловая кислота → щавелевая кислота
При нагревании в кислой среде многоатомные спирты (с соседними гидроксогруппами —ОН) окисляются перманганатом калия до кетона и карбоновой кислоты по схеме[17][16]:
R2C(OH)—(OH)CHR′ → R2C=O + R′COOH
При наличии первично-спиртовой группы СН2—ОН процесс окисления расвором перманганата калия происходит с образованием оксида углерода (IV) — СО2 по схеме[16]:
R2C(OH)—CH2(OH) → R2C=O + СО2 + H2O
Реакция окисления глицерина измельчённым перманганатом калия начинается самопроизвольно и протекает с выделением тепла (Q). Глицерин полностью окисляется до углекислого газа и воды по схеме:
2С3Н8О3 + 7О2 → 6СО2 + 8H2O + Q
Получение
Щелочной гидролиз галогеналканов (в водном растворе щелочей)
При протекании этой реакции атом галогена в галогеналкане замещается на гидроксильную группу (—OH)[14]:
C2H5Cl + NaOH → C2H5OH + NaCl
CH3 — СН(Cl) — CH3 + NaOH → CH3 — CH2 — OH + NaCl
Гидратация алкенов
Присоединения молекулы воды (HOH) (реакция гидратации) протекает по правилу В. В. Марковникова. Согласно правилу В. В. Марковникова, атом водорода присоединяется к наиболее гидрированному атому углерода, а гидроксильная группа присоединяется к наименее гидрированному атому углерода. Процесс гидратации протекает в кислой среде[14].
CH2 = СН2 — СН2 — CH3 + H2O (H+) → CH3 —СН2(ОН)
Восстановление карбонильных соединений (альдегидов, кетонов)
В присутствии катализатора и при нагревании протекает присоединение водорода (гидрирование) к альдегидам и кетонам. При гидрировании альдегидов образуются первичные спирты, при гидрировании кетонов — вторичные спирты, при восстановлении формальдегида образуется метанол[7][14].
CH3 — СOH + Н2 → CH3 — CH2 — OH
CH3 — СO — CH3 + Н2 → CH3 — СН(OН) — CH3
(ОН)C — С(ОН) + Н2 → HOCH2 — СH2OH
Окисление алкенов холодным водным раствором перманганата калия
Реакция окисления возможна при температуре 0°С (реакция Вагнера)[9][14]:
3CH3 — СН = CH3 + 2KMnO4 + 4H2O → 3CH3 — СН(OH) — CH2(OH) + KOH + MnO2
Спиртовое брожение глюкозы
Спиртовое брожение (распад молекулы на части) происходит под действием ферментов[14]:
С6Н12О6 → 2C2H5OH + 2H2O
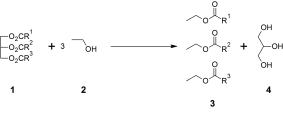
Способ получения многоатомных спиртов — гидролиз жиров
При нагревании тристеарата глицерина образуется глицерин и стеариновая кислота. Механизм гидролиза жиров представлен на рисунке 2. При щелочном гидролизе жиров образуется глицерин и соли карбоновых кислот, входивших в состав жира[14].
Присоединение реактива Гриньяра к альдегидам и кетонам
Присоединение реактива Гриньяра (R—MgHal) к альдегидам позволяет получить первичные спирты по схеме[16]:
СН2О + СН3—MgBr →СН3—СН2—О—MgBr + Н2О → C2H5OH + Mg(ОН)Br
метаналь (альдегид) + метилмагнийбромид (реакив Гриньяра) → алкоголят → этанол
Вторичные спирты образуются при окислении альдегидов по схеме:
R—CH=O + R′—СН2—MgBr → СН2R′—C(R)H —О—MgBr + Н2О → Н2R′—C(R)H —ОH + Mg(ОН)Br
При окислении кетонов реактивом Гриньяра образуются третичные спирты по схеме:
R—(R)C=O + R′—СН2—MgBr → (R)2(R′)—CО—MgBr + Н2О → (R)2—C(R′)—ОH + Mg(ОН)Br
Промышленный способ получения метанола
Метанол получают в результате конверсии (риформинга) углеводородного сырья: природного газа, коксового газа, жидких углеводородов (нефти, мазута) и твёрдого топлива (угля, сланцев)[18]:
СО + Н2 ↔ СН3ОН + 90,8 кДж
СО2 + 3Н2 ↔ СН3ОН + Н2О — 49,6 кДж
Применение
Область применения спиртов достаточно широкая. Спирты — хорошие растворители. Их используют как сырьё в органическом синтезе для получения биотоплива, гидравлических жидкостей, добавок к биотопливам к тормозной жидкости. Спирты также являются сырьём для производств поверхностно-активных веществ, полимеров, антифризов, пестицидов, бытовой химии, взрывчатых и отравляющих веществ. Спирты используют в парфюмерии для изготовления душистых веществ. В состав косметических и медицинских средств также входят спирты. Составляют основу алкогольных напитков, служат растворителем для эссенций, играют роли заменителей сахара (маннит, ксилит), красителей (лютеин), ароматизаторов (ментол)[19]
Бутиловый спирт (CH3 — CH2 — OH) при изготовлении полимеров используется как пластификатора, в производстве формальдегидных смол является модификатором, в парфюмерии используется для получения душистых веществ, служит добавкой к топливу[19].
Пропанол–2 (CH3 — CH(OH) — CH3) применяют в качестве сырья в медицине, металлургии, химической промышленности. Как вторичный одноатомный спирт пропанол-2 является заменителем в парфюмерных, дезинфицирующих и косметических продуктах. Используется в средствах бытовой химии, в производствах антифризов и очистителях различного назначения[19].
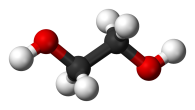
Глицерин (HOCH2 — СH(OH) — СH2OH) применяют в медицине, косметологии. Как сырьё глицерин применяют для получения нитроглицерина — взрывчатого вещества. Также трёхатомный спирт, глицерин, находит применение в сельском хозяйстве, пищевой, текстильной, бумажной, табачной и лакокрасочной промышленности. Используется для получения различных пластиков и средств бытовой химии[19].
Литература
- Артёменко А. И. Органическая химия. — М.: Высшая школа, 1987. — 430 с.
- Грандберг И. И. Органическая химия. — М.: Дрофа, 2001. — 672 с.
- Габриелян О. С., Остроумов И. Г. Химия: учеб для студ. сред. проф. учеб. заведений. — М.: Издательский центр «Академия», 2009. — 336 с.
- Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей технического профиля: учебник. — М.: Издательский центр «Академия», 2009. — 256 с.
- Кузьменко Н. Е., Ерёмин В. В., Попков В. А., Начала химии. — М.: Бином. Лаборатория знаний, 2023. — 704 с.
- Травень В. Ф., Органическая химия. — М.: Бином. Лаборатория знаний, 2015. — Т. 1 — 399 с.
- Юровская М. А., Куркин А. В., Основы органической химии. — М.: Бином. Лаборатория знаний, 2010. — 236 с.
Примечания
- ↑ Маркизова Н.Ф., Гребенюк А.Н., Башарин В.А., Бонитенко Е.Ю. Спирты. — СПб.,: Фолиант, 2004. — 112 с.
- ↑ 2,0 2,1 2,2 2,3 Кто и в каком году придумал спирт – история изобретения. История России. Дата обращения: 25 ноября 2023.
- ↑ Леенсон, И. А. Язык химии: спирты // Язык химии : журнал. — 2016. — 16 октября.
- ↑ Учёный-энциклопедист Абу Бакр Мухаммад ар-Рази. Ummet.kz (09.11.2020). Дата обращения: 4 декабря 2023.
- ↑ 5,0 5,1 5,2 Романютенко П. «Вода жизни»: как алхимики изобрели спирт // Travelask : журнал. — 2019.
- ↑ 6,00 6,01 6,02 6,03 6,04 6,05 6,06 6,07 6,08 6,09 6,10 6,11 Строение, классификация и номенклатура спиртов. Фоксфорд. Дата обращения: 26 ноября 2023.
- ↑ 7,0 7,1 7,2 7,3 7,4 7,5 Спирты. Студариум. Дата обращения: 26 ноября 0202.
- ↑ 8,0 8,1 8,2 8,3 8,4 8,5 8,6 Спирты. Большая Российская энциклопедия (10 января 2023). Дата обращения: 25 ноября 2023.
- ↑ 9,00 9,01 9,02 9,03 9,04 9,05 9,06 9,07 9,08 9,09 9,10 9,11 9,12 9,13 9,14 9,15 9,16 9,17 9,18 Спирты. Skysmart (25.10.2022). Дата обращения: 25 ноября 2023.
- ↑ 10,0 10,1 10,2 10,3 10,4 10,5 Абрамов В. А. Спирты (алкоголи). Химический справочник. Дата обращения: 26 ноября 2023.
- ↑ 11,0 11,1 11,2 Ерёмин, В. В., Кузьменко, Теренин, В. И., Дроздов, А. А., Лунин, В. В. Химия. — М.: Дрофа, 2019. — С. 229—230. — 409 с.
- ↑ Справочник Химика 21 века. Растворимость спиртов. Дата обращения: 10 декабря 2023.
- ↑ 13,0 13,1 13,2 13,3 Антипин Р. Л. Лекция 11. Спирты. Дата обращения: 28 ноября 2023.
- ↑ 14,00 14,01 14,02 14,03 14,04 14,05 14,06 14,07 14,08 14,09 14,10 14,11 14,12 14,13 14,14 14,15 14,16 14,17 14,18 14,19 Спирты и фенолы. Подготовка к ЕГЭ, ОГЭ и олимпиадам. Дата обращения: 26 ноября 2023.
- ↑ 15,0 15,1 Ерёмин, В. В.,. Химия (углубленный уровень) 10 класс. — М.: Дрофа, 2019. — С. 232—233. — 409 с.
- ↑ 16,0 16,1 16,2 16,3 16,4 Органическая химия. Интерактивный учебник. Дата обращения: 10 декабря 2023.
- ↑ 17,0 17,1 17,2 Еремин, В. В., Кузьменко, Н. Е. Учебник по химии углубленный уровень. Дрофа (2019). Дата обращения: 10 декабря 2023.
- ↑ Ваганова, Светлана. Метанол. База.Знание.Россия (10 октября 2023). Дата обращения: 27 ноября 0202.
- ↑ 19,0 19,1 19,2 19,3 Применение спиртов. Мир науки. Дата обращения: 28 ноября 2023.
Данная статья имеет статус «готовой». Это не говорит о качестве статьи, однако в ней уже в достаточной степени раскрыта основная тема. Если вы хотите улучшить статью — правьте смело! |