Алканы
| Алканы | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
Метан |
| Традиционные названия | Метан (Алканы) |
| Хим. формула | CH4 |
| Физические свойства | |
| Состояние | газ |
| Молярная масса | 16,04 г/моль |
| Плотность | 0,415 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 182,48 °C |
| • кипения | 161,49 °C |
| • самовоспламенения | 537,8 °C |
| Энтальпия | |
| • образования | −487 кДж/моль |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Алка́ны (парафины) — органические соединения, ациклические углеводороды линейного или разветвлённого строения, относятся к классу насыщенных (предельных) алифатических углеводородов, в молекулах которых атомы углерода соединены между собой в открытые цепи простыми (ординарными) σ-связями связями углерод-углерод (C-C) и углерод-водород (C-H). Общая формула гомологического ряда алканов выражается как CnH2n+2[1][2]. В молекулах алканов атомы углерода sp3-гибридизированы[3].
Алканы с длиной углеродной цепи C1 —C4 являются газами, тогда, как углеводороды с длиной цепи C5 — C19 находятся в жидком состоянии с температурами кипения от +36 °С до +300 °C. Углеводороды с длиной цепи более C19 имеют твёрдое агрегатное состояние[4].
В истории эта группа веществ известна под названием парафины[1]. Алканы представляют собой наиболее инертные в химическом отношении углеводороды при нормальных условиях, что и послужило основанием для их названия «парафины», происходящего от лат. parum — «мало» и лат. affinitas — «сродство»[3]. Алканы являются химически инертными соединениями, но могут вступать в реакции радикального замещения при сообщении им достаточно высокой энергии. Основные реакции, характерные для алканов — галогенирование, нитрование, изомеризация, крекинг и окисление. Эти реакции имеют важное значение в промышленности и химической технологии[2].
Основным источником алканов в природе служат месторождения нефти и газа, а также продукты жизнедеятельности травоядных животных и бактерий[2]. Метан представляет собой один из газов, создающих парниковый эффект на Земле[5].
История изучения алканов
Алканы представляют собой один из ключевых компонентов нефти. Люди с древнейших времён использовали сырую нефть в своих бытовых нуждах. В древности различные народы по-разному называли маслянистую жидкость, просачивающуюся из горных пород[6].
В государстве Мидия, существовавшем в VII—VI веках до нашей эры на части территорий современных Ирана, Азербайджана, Ирака, Сирии и Турции, вязкую жидкость называли словом «нафата», от которого, возможно, произошло современное слово «нефть». В Персидском государстве словом «нефт» обозначали колодцы, из которых добывали нефть. Древние греки превратили слова «нафата» и «нефт» в греческое слово «нафта»[6].
Невозможно точно определить, когда люди впервые начали использовать природную нефть и её производные, такие как природные битумы и асфальты. Археологических данных об использовании нефти в те далёкие времена не обнаружено. Можно лишь предположить, что человечество познакомилось с этой жидкостью не ранее, чем 35-40 тысяч лет назад, когда люди начали использовать огонь. Однако есть сведения, что в древности индейские племена использовали вязкие асфальты в качестве скрепляющего материала для укрепления наконечников стрел и копий, а также как водонепроницаемый материал для обмазывания плетёных сосудов и лодок[6].
Ситуация начала меняться с IV—III тысячелетия до нашей эры, когда начали возникать и расширяться первые города и государства. В этот исторический период «каменное масло» и «каменная смола» начали находить более широкое применение: в медицине, для освещения и отопления жилищ, в строительстве и судостроении[6].
В 1785 году французский химик Клод Луи Бертолле исследовал метан, известный также как болотный газ, и установил, что он состоит исключительно из углерода и водорода. Позднее была определена его молекулярная формула — CH4[1].
Название «парафин» происходит от латинского «parum affinis», что означает «не обладающий сродством», так как парафин устойчив к воздействию кислот и щелочей в обычных условиях. В начале 1830-х годов немецкий химик Карл Райхенбах выделил парафин из буковой смолы и установил, что он представляет собой смесь высших насыщенных углеводородов[1].
В 1985 году была синтезирована самая длинная молекула алкана — нонаконтатриктан, имеющая формулу C390H782[1].
Номенклатура
Гомологический ряд
Гомологический ряд алканов представляет собой последовательность органических соединений, в которой каждый последующий член отличается от предыдущего на группу атомов (—CH2). Формула гомологического ряда алканов имеет вид CnH2n+2[7].
Для названия алканов используются две системы номенклатуры: тривиальная (историческая) и международная (систематическая) в соответствии с правилами IUPAC (Международной комиссии по номенклатуре органических соединений при Международном союзе теоретической и прикладной химии)[7].
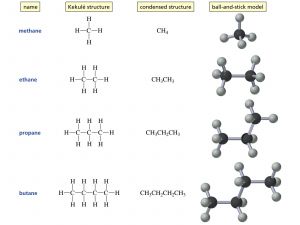
Названия первых четырёх членов гомологического ряда исторически сложились. Начиная с пятого члена, гомологи называются в соответствии с греческими числительными, например, «пента» — пять, «гекса» — шесть, «гепта» — семь и так далее, с прибавлением суффикса «-ан»[7].
Гомологи метана[7]:
| Формула | Название | |
|---|---|---|
| СН4 | CH₄ | Метан |
| С2Н6 | CH₃−CH₃ | Этан |
| С3Н8 | CH₃−CH₂−CH₃ | Пропан |
| С4Н10 | CH₃−CH₂−CH₂−CH₃ | Бутан |
| С5Н12 | CH₃−CH₂−CH₂−CH₂−CH₃ | Пентан |
| С6Н14 | CH₃−CH₂−CH₂−CH₂−CH₂−CH₃ | Гексан |
| С7Н16 | CH₃−CH₂−CH₂−CH₂−CH₂−CH₂−CH₃ | Гептан |
| С8Н18 | CH₃−CH₂−CH₂−CH₂−CH₂−CH₂−CH₂−CH₃ | Октан |
| С9Н20 | CH₃−CH₂−CH₂−CH₂−CH₂−CH₂−CH₂−CH₂−CH₃ | Нонан |
| С10Н22 | CH₃−CH₂−CH₂−CH₂−CH₂−CH₂−CH₂−CH₂−CH₂−CH₃ | Декан |
Алканы, не имеющие разветвлений в своей структуре, называются нормальными алканами, что позволяет отличать их от разветвлённых алканов. Гомологический ряд алканов включает в себя бесконечное множество гомологов, что делает его потенциально весьма протяжённым. Полиэтилен, полученный из этилена с использованием катализаторов Циглера-Натта, демонстрирует, что углеродные цепи могут достигать значительной длины[7].
Принципы международной номенклатуры IUPAC
В рамках международной номенклатуры IUPAC (ИЮПАК) существует ряд принципов, которые определяют структуру и наименование химических соединений[7].
- Основой для названия соединения служит название углеводорода, соответствующее числу атомов углерода в его основной цепи. Основной цепью углеводорода считается либо наиболее длинная, либо наиболее сложная, то есть имеющая наибольшее количество разветвлений.
- В названиях алканов используются названия углеводородных радикалов — алкилов, остатков молекул углеводородов без одного атома водорода: (—CH3 ) — метил; (CH3—CH2 —) —этил; (CH₃—CH₂—CH₂—) — пропил.
- Атомы углерода основной цепи нумеруются, начиная с того конца, где находится ближайшее разветвление или радикал.
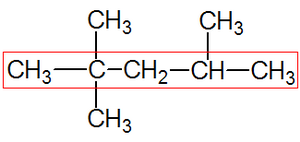
- При наименовании соединения сначала перечисляются радикалы, находящиеся в боковой цепи, с указанием номера атомов углерода основной цепи, при которых они расположены. Одинаковые радикалы обозначаются умножающим префиксом, например, «ди» (два), «три» (три), «тетра» (четыре), «пента» (пять) и так далее. В конце ставится название алкана, соответствующее числу атомов углерода основной цепи[7].
2-метилбутан
2,3-диметилбутан
Физические свойства
Формулы и названия углеводородов, температуры кипения и плавления[4]:
| Формула | Название | Номенклатура IUPAC | Температура кипения (°C) | Температура плавления (°C) |
|---|---|---|---|---|
| CH₄ | Метан | Метан | -161.5 | -182.5 |
| CH₃−CH₃ | Этан | Этан | -88.6 | -172 |
| CH₃−CH₂−CH₃ | Пропан | Пропан | -42.1 | -187.7 |
| CH₃−CH₂−CH₂−CH₃ | Бутан | Бутан | -0.5 | -138.3 |
| CH₃−CH₂−CH₂−CH₂−CH₃ | Пентан | Пентан | 36 | -130 |
| CH₃−CH(CH₃)−CH₂−CH₃ | Изопентан | 2-метилбутан | 28 | -160 |
| C(CH₃)₄ | Неопентан | 2,2-диметилпропан | 9 | -20 |
Физические свойства некоторых групп алканов[4]:
- Все неароматические углеводороды с длиной углеродной цепи C1−C4 являются газами.
- Углеводороды с длиной углеродной цепи C5−C19 являются жидкостями с температурами кипения от +36 до +300 °C.
- Углеводороды с длиной углеродной цепи после C19 находятся в твёрдом агрегатном состоянии.
- Углеводороды с разветвлённой цепью имеют более низкие температуры кипения. Силы сцепления между молекулами больше у нормальных цепей, что делает отрыв молекул от поверхности жидкости сложнее у нормальных цепей, чем у разветвлённых изомеров.
- В твёрдых углеводородах фазовый переход твёрдое тело — жидкость определяется плотностью упаковки молекул, которая компактнее у неразветвлённых углеводородов, поэтому они плавятся при более высокой температуре.
- Неопентан ведёт себя аномально, так как его температура плавления намного выше, чем у изопентана[4].
Алканы характеризуются крайне низкой растворимостью в воде, однако демонстрируют высокую растворимость в неполярных растворителях, таких как бензол и другие[8].
Строение алканов
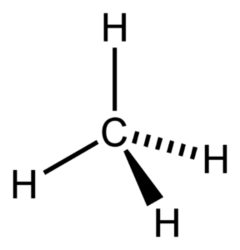
Строение метана
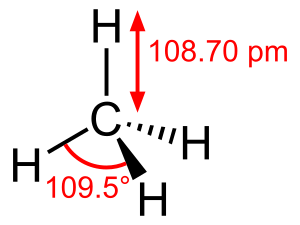
Метан (CH4) — простейший представитель класса алканов. В молекуле метана каждый из четырёх атомов водорода соединён с атомом углерода посредством ковалентной связи, которая формируется за счёт общей электронной пары. В насыщенных углеводородах атомы углерода характеризуются типом гибридизации sp3, это означает, что связывающие орбитали атома углерода направлены к вершинам тетраэдра. Такое расположение орбиталей обеспечивает максимальное расстояние между ними. Для формирования наиболее прочной связи с атомами водорода необходимо, чтобы ядра атомов водорода находились в вершинах тетраэдра. Углы между связями в молекуле метана составляют 109°5°[9][10]. Длина связи углерод — водород (С—Н) равна 108, 70 pm.
Строение гомологов метана
Алканы, вне зависимости от количества атомов углерода в их цепи, всегда сохраняют тетраэдрическую ориентацию связей. Это означает, что атомы углерода в молекуле алкана образуют углы примерно 109,5° друг с другом. В результате, реальная цепь углеродных атомов никогда не может быть линейной; она всегда имеет зигзагообразную форму[8].
В реальных молекулах атомы и группы атомов свободно вращаются вокруг σ-связей. Это вращение позволяет углеродной цепи принимать различные пространственные конфигурации. Например, при вращении вокруг σ-связей в молекуле пентана могут образовываться две формы молекулы: одна более изогнутая, чем исходный зигзаг, а вторая имеет почти кольцеобразную структуру[8].
При вращении фрагментов молекулы вокруг σ-связи порядок соединения атомов друг с другом не меняется. Подобное вращение атомов в молекулах является результатом теплового движения, если нет факторов, препятствующих этому. Наиболее энергетически выгодной является вытянутая форма молекулы, в которой фрагменты максимально удалены друг от друга и испытывают минимальное отталкивание групп и связей[8].
Алканы обладают гибкой пространственной структурой благодаря свободному вращению вокруг σ-связей. Это вращение позволяет молекулам принимать различные конформации, которые легко переходят одна в другую. Наиболее энергетически выгодной является вытянутая форма молекулы, в которой фрагменты максимально удалены друг от друга и испытывают минимальное отталкивание групп и связей[8].
Изомерия алканов
Для алканов возможны три вида изомерии: структурная, оптическая и конформационная[9].
Структурная изомерия
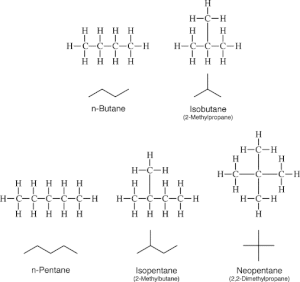
Структурная изомерия, или изомерия углеродного скелета, для алканов начинается с бутана (C4H10). Для бутана известны два изомера[9]:
- Нормальный бутан — соединение с неразветвлённой углеродной цепью: СН3-СН2-СН2-СН3
- Изобутан (2-метилпропан) — соединение с разветвлённой углеродной цепью: СН3-СН(СН3)-СН3
Для вещества состава C5H12 известны три изомера[9]:
- Нормальный пентан: CH3−CH2−CH2−CH2−CH3
- Изопентан (2-метилбутан): CH3−CH(CH3)−CH2−CH3
- Неопентан (2,2-диметилпропан): C(CH3)4
С увеличением числа углеродных атомов в молекуле возрастает и число теоретически возможных изомеров. Так, для гексана (C6H14) оно составляет 5, для гептана (C7H16) — 9, для октана (C8H18) — 18, для нонана (C9H20) — 35, для декана (C10H22) — 75, а для эйкозана (C20H42) — 366319[9].
Таблица структурных изомеров алканов[9]:
| Алкан | Число углеродных атомов | Число изомеров |
|---|---|---|
| Бутан | 4 | 2 |
| Пентан | 5 | 3 |
| Гексан | 6 | 5 |
| Гептан | 7 | 9 |
| Октан | 8 | 18 |
| Нонан | 9 | 35 |
| Декан | 10 | 75 |
| Эйкозан | 20 | 366319 |
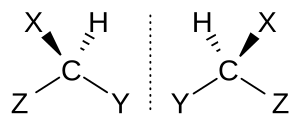
Оптическая изомерия
Оптическая изомерия представляет собой уникальное явление, при котором молекулы обладают идентичной структурой, но различаются по способности вращать плоскость поляризованного света. Это явление тесно связано с хиральностью, которая подразумевает невозможность совмещения объекта с его зеркальным отражением. Хиральные объекты, такие как правая и левая руки или винты с правой и левой резьбой, не могут быть совмещены в пространстве и представляют собой зеркальные отражения друг друга[11].
В качестве алкана с хиральным (асимметрическим) атомом, существующего в виде двух зеркальных изомеров (энантиомеров), можно предложить 3-метилгексан[9].
Конформации
Строение других алканов определяется типом гибридизации орбиталей атома углерода. Связи углерод — углерод образованы перекрыванием sp3-орбиталей. Длина связи составляет 0,154 нм. Цепочка углеродных атомов не линейна, а зигзагообразна из-за угла между связями 109°5°, причём вокруг связи С-С возможно относительно свободное вращение, что приводит к существованию поворотных изомеров (конформеров)[9].
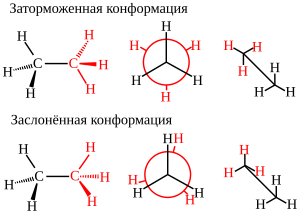
Конформеры, или конформации, — это различные положения атомов одной молекулы в пространстве, которые могут взаимно превращаться друг в друга путем вращения вокруг простых углерод-углеродных связей. Эти конформации могут быть изображены разными способами — с помощью перспективных формул и с помощью так называемых проекций, или формул Ньюмена[9].
В заслоненной конформации молекулы этана расстояния между водородными атомами минимальны, а в заторможенной — максимальны. В заслонённой конформации потенциальная энергия отталкивания будет больше, однако разница энергии составляет всего 12 кДж/моль, поэтому переход из одной конформации в другую осуществляется легко, и выделить их в качестве отдельных устойчивых изомеров нельзя[9].
| Конформация | Расстояние между водородными атомами | Потенциальная энергия отталкивания | Энергетический барьер (кДж/моль) |
|---|---|---|---|
| Заторможенная | Максимальное | Меньше | 12 |
| Заслонённая | Минимальное | Больше | 12 |
Для бутана энергетический барьер для перехода из одной конформации в другую может составлять от 18 до 26 кДж/моль. При обычных температурах различные поворотные изомеры алканов свободно переходят друг в друга за счет вращения относительно связей С-С[9].
| Конформация | Энергетический барьер (кДж/моль) |
|---|---|
| Заторможенная | 18-26 |
| Заслонённая | 18-26 |
Конформации алканов играют важную роль в их физических и химических свойствах. Вращение вокруг связей углерод — углерод (С—С) позволяет молекулам принимать различные пространственные положения, что влияет на их взаимодействие с другими молекулами и окружающей средой[9].
Химические свойства
Химическая инертность алканов
Алканы характеризуются химической инертностью в стандартных условиях, что обусловлено исключительной прочностью σ-связей «углерод — углерод (C—C) и углерод — водород (C-H). Эти связи обладают высокой энергией, составляющей 415—420 кДж/моль для связи углерод―водород (C―H) и 350 кДж/моль для химической связи углерод―углерод (C―C), что обеспечивает их устойчивость к разрыву. Именно поэтому алканы не вступают в реакции присоединения и получили наименование парафинов[8].
Основные химические трансформации алканов осуществляются при сообщении им значительного количества энергии. Ковалентные связи, образующие структуру алканов, не подвержены ионному разрыву, однако они могут расщепляться гомолитически под воздействием активных свободных радикалов. В результате этого процесса может произойти разрыв связи «C-H» с последующим замещением атома водорода на другой атом или группу атомов. Также возможно расщепление молекулы по связи углерод―углерод (C―C)[8]. Алканы вступают в реакции, протекающие по механизму радикального замещения[8].
Алканы являются химически инертными соединениями, но могут вступать в реакции радикального замещения при сообщении им достаточно высокой энергии. Основные реакции включают галогенирование, нитрование, изомеризацию, крекинг и окисление. Эти реакции имеют важное значение в промышленности и химической технологии[8].
Галогенирование
Механизм реакции
Алканы реагируют с хлором и бромом под действием УФ излучения или высокой температуры. Реакция протекает по цепному механизму[8]:
Инициирование цепи[8]:
Рост цепи[8]:
Обрыв цепи[8]:
Суммарное уравнение реакции[8]:
Если галогена избыток, то реакция не останавливается на образовании моногалогенпроизводного. Происходит постепенное замещение атомов водорода в алкане на атомы галогена. Например, если взять избыток хлора, то в результате реакции образуются следующие продукты[8]:
хлорметан, дихлорметан, трихлорметан, тетрахлорметан (хлорид углерода (IV))
Реакция иода с алканами является равновесной со значительным смещением равновесия в сторону реагентов. Практического значения эта реакция не имеет в виду малого выхода продукта реакции[9]:
метан + иод → иодметан + иодоводород
Реакция со фтором протекает очень энергично со взрывом и полным разрушением связей «С-С»[9]:
этан + фтор → тетрафторметан + фтороводород
Для того, чтобы снизить скорость реакции, её проводят в атмосфере инертного газа. В этом случае удаётся получить соединения содержание длинные углеродные цепочки и фтор[9].
Селективность реакции
Пропан представляет собой молекулу, состоящую из трех атомов углерода и восьми атомов водорода. Не все атомы водорода в пропане одинаковы. Шесть из них связаны с двумя первыми атомами углерода (это называется первичными связями), а два других — со средним атомом углерода (вторичные связи)[12].
При добавлении хлора к пропану можно получить два разных продукта: 1-хлорпропан и 2-хлорпропан[12]:
пропан + хлор → 1-хлорпропан + хлороводород;
пропан + хлор → 2-хлорпропан + хлороводород
По статистике, если рассматривать количество атомов водорода, можно было бы ожидать, что продукты будут образовываться в пропорции 3:1 (так как первичных атомов водорода больше). И действительно, при высоких температурах (например, 500 °C) эта пропорция соблюдается. Однако при более низких температурах ситуация меняется. Например, при комнатной температуре (25 °C) получается другая пропорция: 43 % 1-хлорпропана и 57 % 2-хлорпропана[12].
Связи между атомами углерода и водородом имеют разную прочность. Связи вторичных атомов углерода с водородом менее прочные, чем у первичных. Это означает, что при замене водорода на хлор в случае вторичных связей требуется меньше энергии, и реакция проходит быстрее. Таким образом, несмотря на меньшее количество вторичных водородов, замена происходит активнее[12].
Этот принцип также применим к другим молекулам. Например, в 2-метилпропане (другое название — изобутан) при хлорировании образуются два продукта: 2-хлор-2-метилпропан и 1-хлор-2-метилпропан. Здесь пропорция продуктов составляет соответственно 36 % и 64 %. Поскольку количество атомов водорода на первичных атомах в девять раз больше, чем у третичного атома, можно сделать вывод, что водород у третичного атома углерода в пять раз более реакционноспособен, чем у первичных[12].
2-метилпропан + хлор → 2-метил-2-хлорпропан + хлороводород;
- (реакция протекает при температуре 140 °C)
2-метилпропан + хлор → 2-метил-1-хлорпропан + хлороводород.
Бромирование алканов представляет собой гораздо более избирательный процесс по сравнению с хлорированием. В частности, при бромировании н-пропана в газовой фазе при температуре 150 °C получается 97 % 2-бромпропана и лишь 3 % 1-бромпропана[12].
Нитрование (реакция Коновалова)
При воздействии разбавленной азотной кислоты на алканы при температуре 140 оС и давлении происходит реакция в результате которой происходит замещение атомов водорода на нитрогруппу. В ходе радикальных реакций в первую очередь происходит замещение атомов водорода у третичных атомов углерода, затем у вторичных, и в последнюю очередь — у первичных атомов углерода. Реакция Коновалова[2]:
СН4 + НNO3 → CH3NO2 + H2O
метан + азотная кислота, разбавленная → нитрометан + вода
Сульфоокисление
Процесс сульфоокисления алканов при ультрафиолетовом облучении представляет собой радикально-цепную реакцию, включающую в себя стадии инициирования, роста цепи и обрыва цепи. Этот процесс аналогичен другим радикально-цепным реакциям, таким как галогенирование алканов, и также требует сообщения молекулам алканов достаточного количества энергии для начала реакции[2].
этан + оксид серы (IV) + кислород → (этансульфокислота)
Сульфохлорирование
Сульфохлорирование алканов при ультрафиолетовом облучении и комнатной температуре представляет собой цепной радикальный процесс, включающий стадии инициирования, роста и обрыва цепи. В результате этой реакции образуются хлорангидриды алкансульфокислот. Этот процесс аналогичен другим радикально-цепным реакциям и требует сообщения молекулам достаточной энергии для начала реакции. В результате сульфохлорирования алканов образуются хлорангидриды алкансульфокислот. Например, для метана это будет метансульфохлорид[2].
Окисление
Окисление протекает по радикальному механизму. В зависимости от условий может приводить к образованию разных продуктов[2].
Полное окисление
Частичное окисление
Мягкое окисление
При мягком окислении метана кислородом воздуха при температуре в 200 °C и в присутствии катализатора могут быть получены такие вещества, как метанол, формальдегид и муравьиная кислота. Аналогичным образом, мягкое окисление бутана в присутствии катализаторов приводит к образованию уксусной кислоты[8].
бутан + кислород → уксусная кислота + вода
Окисление при нагревании в присутствии воды
Процесс окисления метана на поверхности катализатора при высоких температурах в присутствии воды и катализатора называется паровым риформингом. В результате этой реакции образуется синтез-газ, который представляет собой смесь угарного газа и водорода. Реакция парового риформинга метана может быть описана следующим уравнением[2]:
Изомеризация
В определённых условиях нормальные алканы способны трансформироваться в алканы с разветвлённой цепью[8]:
пентан → 2–метил–бутан
Крекинг
Это процесс, который происходит при нагревании и под воздействием катализаторов, в результате чего связи «C-C» разрываются. При крекинге высших алканов образуются алкены и низшие алканы[8]:
гексан → этан + бутен-2
Пиролиз алканов
Пиролиз — это процесс разрушения соединений при нагревании без доступа кислорода воздуха[13].
Разложение на углерод и водород
При нагревании алканов в условиях отсутствия доступа воздуха до температуры в 1000 оС происходит их разложение на углерод и водород[9].
Процесс пиролиза природного газа позволяет получить два ценных продукта — сажу и водород. Метан является наиболее устойчивым к термическому воздействию из всех алканов. Это обусловлено тем, что энергия, затрачиваемая на образование связи «C-H» (98,5 ккал), превышает энергию, необходимую для образования связи «C-C» (81 ккал). Вследствие этого высшие парафины менее стабильны, и их термическое разложение начинается при температуре около 450 оС[9].
Частичное отщепление водорода (дегидрирование)
этан → этен + водород
Пиролиз метана с образованием ацетилена
Пиролиз метана представляет собой процесс, протекающий при высоких температурах в диапазоне от 1200 до 1500 оС, с последующим быстрым охлаждением продуктов реакции. В результате этого процесса образуется ацетилен. Ацетилен, получаемый при температуре 1500 оС, является термодинамически нестабильным веществом и в течение короткого промежутка времени может разложиться на водород и углерод, известный как сажа. Чтобы предотвратить разложение ацетилена, образовавшегося в результате пиролиза метана, время пребывания метана в реакционной зоне должно быть минимальным и составлять не более сотой доли секунды[14].
метан → этин (ацетилен) + водород
Дегидрирование с образованием циклоалканов и аренов (дегидроцилизация)
Получение циклогексана и водорода из гексана[15]:
Получение бензола и водорода из гексана[16]:
Способы получения
Способы получения алканов можно разделить на три основные группы[9]:
Реакции, не сопровождающиеся изменением числа углеродных атомов в молекуле.
Гидрирование непредельных углеводородов:
Алкены под действием водорода и катализатора (например, никеля) превращаются в алканы[9].
этен + водород → этан
Восстановление алкилгалогенидов:
Алкилгалогениды могут быть восстановлены до алканов с помощью водорода образующегося в реакции металла с кислотой (уксусной или минеральной) и катализатора (например, палладия)[2][9].
Гидролиз металлорганических соединений:
Реакция Гриньяра и гидролиз карбида алюминия используются для получения алканов[9].
Восстановление кетонов:
Кетоны могут быть восстановлены до алканов по методам Кижнера и Клемменсена[9].
По Кижнеру (восстановление гидразином)[9]:
По Клемменсену (восстановление амальгамой цинка)[9]:
Реакции, сопровождающиеся уменьшением числа углеродных атомов в молекуле.
Крекинг нефти:
При высоких температурах и в присутствии катализаторов высшие алканы разрушаются, образуя смеси низших алканов и непредельных углеводородов (содержащих кратные связи)[9].
гексан → бутан + этен (этилен)
Сплавление солей одноосновных карбоновых кислот со щелочами:
При нагревании солей карбоновых кислот со щелочами происходит декарбоксилирование, образуя алканы[7].
Реакции, сопровождающиеся удлинением углеродного скелета.
Синтез из оксида углерода (метод Фишера — Тропша):
При пропускании смеси оксида углерода (II) с водородом через катализатор образуется смесь алканов[9].
Реакция Вюрца — Шорыгина:
Взаимодействие алкилгалогенидов с металлическим натрием приводит к образованию новых углерод-углеродных связей[9].
хлорэтан + натрий металлический → бутан + хлорид натрия
Реакции диалкилкупратов лития с алкилгалогенидами:
Диалкилкупраты лития реагируют с алкилгалогенидами, образуя алканы[9].
Прямой синтез из простых веществ:
Метан образуется в вольтовой дуге между угольными электродами в присутствии водорода[9].
Электролиз солей карбоновых кислот (синтез Кольбе):
При электролизе водных растворов солей карбоновых кислот на аноде выделяется CO2 и образуются алканы[9].
Эти методы позволяют синтезировать алканы различными способами, в зависимости от исходных веществ и условий реакции.
Применение алканов
Алканы представляют собой не только доступное и экономически выгодное топливо, но и ценный источник сырья для крупнотоннажного производства[9].
Метан широко используется в качестве топлива благодаря своей высокой энергией сгорания (50 000 кДж/кг). Метан также служит важным сырьём для химической промышленности, особенно для получения синтез-газа (смесь CO и H₂), который используется для производства метанола и других продуктов[9].
Вазелин — смесь жидких и твёрдых предельных углеводородов с числом углеродных атомов до 25 — применяется для приготовления мазей в медицине[9].
Парафин — смесь твёрдых алканов с числом атомов углерода от 19 до 35 — представляет собой белую твёрдую массу без запаха и вкуса, температура плавления которой составляет от 50 до 70 °C. Парафин используется для изготовления свечей, пропитки спичек и упаковочной бумаги, а также в тепловых процедурах в медицине[9].
Нормальные предельные углеводороды средней молекулярной массы применяются в микробиологическом синтезе белка из нефти[9].
Алканы играют важную роль как в качестве топлива, так и в качестве сырья для химической промышленности. Они используются для производства различных продуктов, таких как моторное топливо, смазочные масла, вазелин, парафин и синтез-газ[9].
Также алканы применяют[17]:
- Энергетическая промышленность — использует в качестве топлива бензин, керосин, мазут, входящих в состав жидких алканов, газообразные алканы применяются для производства аэрозолей и в быту.
- Химическая промышленность — алканы используют для производства растворителей, красок, лаков, мыла, свечей, мазей, асфальта, для пропитки спичек, в производстве органических кислот, спиртов и альдегидов.
- Медицина и косметология — для приготовления мазей и увлажняющих косметических средств используют вазелин и вазелиновое масло.
- Строительство —используется для изготовления асфальтовых дорог конечный продукт переработки нефти — гудрон (дёготь), содержащий смесь алканов.
- Бумажно-целлюлозная промышленность — применяют как пропитку упаковочной бумаги.
- Пищевая промышленность — используют в производстве жевательных резинок.
Нахождение в природе
В настоящее время основными промышленными источниками алканов являются природный газ и нефть. Природный газ отличается высоким содержанием метана, доля которого может достигать до 98 %. Газообразные алканы также обнаруживаются в местах залегания нефти, где они известны как попутный газ. В попутном газе содержание метана может варьироваться от 75 % до 85 %, а также в значительных количествах содержатся этан и пропан. Нефть представляет собой жидкую смесь, включающую несколько сотен углеводородов, из которых половину составляют алканы и циклоалканы[2].
Гомологи, имеющие в своём составе от двадцати до тридцати атомов углерода, являются компонентами восковых оболочек семян и листьев, а также компонентом пчелиного воска[7].
На газовых планетах, таких как Юпитер, Сатурн, Уран и Нептун, метан содержится в значительных количествах. Эти планеты обладают восстановительной атмосферой, насыщенной водородом, в результате чего углерод и азот находятся в форме метана и аммиака соответственно. Из-за высокого содержания метана на этих планетах возникали фантастические проекты по его возможной транспортировке на Землю в будущем[2].
На Земле сила притяжения сравнительно слабее, что приводит к утечке водорода и наличию окислительной атмосферы. На Земле присутствует значительное количество метана. Ежегодно образуется приблизительно 2 миллиарда тонн метана благодаря деятельности метаногенных бактерий, разлагающих растительные и животные остатки в условиях отсутствия кислорода. Например, болотный газ на 99 % состоит из метана[2].
Фракции нефти, получаемые в процессе её перегонки, включают в себя различные углеводороды, которые находят применение в качестве моторного топлива для двигателей внутреннего сгорания и реактивных двигателей[9].
Разгонка нефти позволяет получить несколько фракций, в составе которых содержатся предельные углеводороды[9]:
- Бензин — углеводороды с числом атомов углерода от 6 до 10, температура кипения составляет от 40 до 180 °С.
- Керосин — углеводороды с числом атомов углерода от 11 до 12, температура кипения составляет от 180 до 230 °С.
- Дизельное топливо — углеводороды с числом атомов углерода от 13 до 17, температура кипения составляет от 230 до 305 °С.
- Мазут — углеводороды с числом атомов углерода от 18 до 25, из которых получают солярное масло и смазочные масла, а также вазелин и твёрдый парафин.
Высшие фракции нефти подвергаются крекингу для получения высокосортных бензинов. В результате этого процесса также образуются алкены, такие как этилен, пропен и бутены, которые являются важным сырьём для химической промышленности[9].
Литература
- Артёменко А. И. Органическая химия. — М.: Высшая школа, 1987. — 430 с.
- Грандберг И. И. Органическая химия. — М.: Дрофа, 2001. — 672 с.
- Габриелян О. С., Остроумов И. Г. Химия: учеб для студ. сред. проф. учеб. заведений. — М.: Издательский центр «Академия», 2009. — 336 с.
- Габриелян О. С., Остроумов И. Г. Химия для профессий и специальностей технического профиля: учебник. — М.: Издательский центр «Академия», 2009. — 256 с.
- Кузьменко Н. Е., Ерёмин В. В., Попков В. А., Начала химии. — М.: Бином. Лаборатория знаний, 2023. — 704 с.
- Травень В. Ф., Органическая химия. — М.: Бином. Лаборатория знаний, 2015. — Т. 1 — 399 с.
- Юровская М. А., Куркин А. В., Основы органической химии. — М.: Бином. Лаборатория знаний, 2010. — 236 с.
Примечания
- ↑ 1,0 1,1 1,2 1,3 1,4 Краснов И., Геращенко И. Алканы: формула, реакции, свойства, гомологический ряд, строение, номенклатура, изомерия для 10 класса, задачи с ответами по химии для 10 класса. Kp.ru. Дата обращения: 11 ноября 2024. Архивировано 11 ноября 2024 года.
- ↑ 2,00 2,01 2,02 2,03 2,04 2,05 2,06 2,07 2,08 2,09 2,10 2,11 Травень В. Ф. Органическая химия : учебное пособие для вузов : в 3 т. Т. I. — М.: Бином. Лаборатория знаний, 2013. — 368 с. — ISBN 978-5-9963-0406-6.
- ↑ 3,0 3,1 Фросин В. Н. Насыщенные углеводороды. БСЭ. Дата обращения: 13 ноября 2024. Архивировано 8 ноября 2024 года.
- ↑ 4,0 4,1 4,2 4,3 Березин Б. Д. Курс современной органической химии: Учеб. пособие для вузов. — М.: Высшая школа, 2003. — 768 с. — ISBN 5-06-003630-8.
- ↑ Аниськов Евгений. Парниковый эффект: что надо знать о влиянии парниковых газов на Землю. РБК Тренды (15 июня 2021). Дата обращения: 12 декабря 2024.
- ↑ 6,0 6,1 6,2 6,3 Линник Ю. Н., Линник В. Ю. Добыча углеводородного сырья. Институт ресурсной эффективности. Дата обращения: 16 ноября 2024. Архивировано 15 мая 2024 года.
- ↑ 7,0 7,1 7,2 7,3 7,4 7,5 7,6 7,7 7,8 Фролова В.В., Дьяконова О.В. Органическая химия: учебное пособие для бакалавров агрономических факультетов сельскохозяйственных вузов. — Воронеж: ФГБОУ ВО Воронежский ГАУ, 2016. — С. 26—28. — 235 с.
- ↑ 8,00 8,01 8,02 8,03 8,04 8,05 8,06 8,07 8,08 8,09 8,10 8,11 8,12 8,13 8,14 8,15 8,16 8,17 Карманова О. Г. Алканы. Заочная физико-техническая школа (ЗФТШ) Московского физико-технического института (национального исследовательского университета) (МФТИ). Дата обращения: 12 ноября 2024. Архивировано 12 ноября 2024 года.
- ↑ 9,00 9,01 9,02 9,03 9,04 9,05 9,06 9,07 9,08 9,09 9,10 9,11 9,12 9,13 9,14 9,15 9,16 9,17 9,18 9,19 9,20 9,21 9,22 9,23 9,24 9,25 9,26 9,27 9,28 9,29 9,30 9,31 9,32 9,33 9,34 9,35 9,36 9,37 9,38 Куксёнок В. Ю. Лекция 4. Алканы.pdf. Томский политехнический университет. Дата обращения: 12 ноября 2024. Архивировано 12 ноября 2024 года.
- ↑ Алканы: гомологический ряд, формулы и свойства. Skysmart. Дата обращения: 14 ноября 2024.
- ↑ Реутова Т. О., Курц А. Л., Бутин К. П.,. Органическая химия [Электронный ресурс] : в 4 ч. Ч.2. — М.: Бином. Лаборатория знаний, 2012. — С. 8—18. — 623 с. — ISBN 5-94774-111-3.
- ↑ 12,0 12,1 12,2 12,3 12,4 12,5 Реутов О. А. Органическая химия. В 4-х частях. Ч. 1: Учеб. для студентов вузов, обучающихся по направлению и специальности «Химия». — М.: Бином. Лаборатория знаний, 2004. — 567 с. — ISBN 5-94774-110-5.
- ↑ Редакция химических наук. Пиролиз. Большая российская энциклопедия (24 октября 2023). Дата обращения: 12 декабря 2024.
- ↑ Пиролиз метана. Chemege.ru. Дата обращения: 15 ноября 2024.
- ↑ дегидроциклизация гексана до циклогексана. Chemege.ru. Дата обращения: 15 ноября 2024.
- ↑ Получение бензола из гексана. Acetyl.ru. Дата обращения: 15 ноября 2024.
- ↑ Современные направления использования предельных углеводородов. Студенческий научный форум - 2019. Дата обращения: 17 декабря 2024.
Ссылки
Данная статья имеет статус «готовой». Это не говорит о качестве статьи, однако в ней уже в достаточной степени раскрыта основная тема. Если вы хотите улучшить статью — правьте смело! |







![{\displaystyle {\ce {Cl_2 ->[hv] 2Cl*}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/39041f288efcbdb260daaf154f72d851f5c82d6e)





![{\displaystyle {\ce {CH4 + Cl2 ->[hv] CH3Cl + HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9e53b849e6abec8b7034a5946016a6fb45b4da71)







![{\displaystyle {\ce {2CH3-CH3 + 2SO2 + O2 ->[hv] 2CH3-CH2SO3H}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/862df5069e9c9afd5f3fcfadb295dfaa2f169957)
![{\displaystyle {\ce {CH3-CH3 + Cl2 + SO2 ->[hv] CH3-CH2-SO2Cl + HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/897e904c55cb02dbac7975e212f941145c63e076)



![{\displaystyle {\ce {2C4H10 + 5O2 ->[t] 4CH3-COOH + 2H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/467073d4a31e37f0aebfe257443d1c70f937e7ec)
![{\displaystyle {\ce {CH4 + H2O ->[Ni, 850^0C] CO + 3H2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6324cdbc35e7fedf128771967780aa8341cb80c9)
![{\displaystyle {\ce {CH3-CH2-CH2-CH2-CH3 ->[AlCl3][t] CH3-CH(CH3)-CH2-CH3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8eae992b5241ed25396c48d70d03792580708cce)
![{\displaystyle {\ce {CH3-(CH2)4-CH3 ->[t] CH3-CH3 + CH3-CH=CH-CH3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/672b18f395b6c849e52e37337360126d935e7f89)
![{\displaystyle {\ce {CH4 ->[1400^0C] C + 2H2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/fac1ecd2873ed6242071a15e5acdfd84b0dee4fa)
![{\displaystyle {\ce {C12H26 ->[450^0C] 12C + 13H2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/63d94d7d002def495fc1a603a5ff2807b985b392)
![{\displaystyle {\ce {C2H6 ->[650^0C] CH2=CH2 + H2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c5adfb902aa930ebf101df1a01c9793a06f9cae7)
![{\displaystyle {\ce {2CH4 ->[1500^0C] C2H2 + 3H2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0de81d001bbe04233db0345ffbbfd4a8587e5f7b)
![{\displaystyle {\ce {C6H14 ->[Pt, t] C6H12 + H2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d416a5136ae971a3167165bfc94a2396f4483186)
![{\displaystyle {\ce {C6H14 ->[Ni,t] C6H6 + 4H2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0b8c7e06169406a09dd90a0b182e8d47f9d255db)
![{\displaystyle {\ce {CH2=CH2 + H2 ->[Ni] CH3-CH3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/bc35c369f577898decdadd9f6a4ea631cd1bcdab)
![{\displaystyle {\ce {CH3-CH2-CH2-CH2Br + Zn + HBr ->[Pd] 2CH3-CH2-CH2-CH3 + ZnBr2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d21a71ca1cf56f219e96ca69ca4b9b2c38798692)




![{\displaystyle {\ce {CH3-CH2-CH2-CH2-CH2-CH3 ->[Pt][t] CH3-CH2-CH2-CH3 + CH2=CH2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/04ab0aa9e9b1844e20ac1881365400483bf58e64)
![{\displaystyle {\ce {CH3-CH2-COONa + NaOH ->[t] CH3-CH3 + Na2CO3}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/98c29d7eff2270df98c20005ed885731f813ce72)





