Хлор
| |||||
| Внешний вид простого вещества | |||||
|---|---|---|---|---|---|
 Жидкий хлор в запаянном сосуде под давлением |
|||||
| Свойства атома | |||||
| Имя, символ, номер | Хлор / Chlorum (Cl), 17 | ||||
| Группа, период, блок |
17 (устар. 7), 3, p-элемент |
||||
| Атомная масса (молярная масса) |
[35,446; 35,457] а. е. м. (г/моль) | ||||
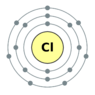
| Электронная конфигурация |
[Ne] 3s23p5 1s22s22p63s23p5 |
||||
| Радиус атома | 99 пм | ||||
| Химические свойства | |||||
| Ковалентный радиус | 102±4 пм | ||||
| Радиус иона | (+7e)27 (-1e)181 пм | ||||
| Электроотрицательность | 3,16 (шкала Полинга) | ||||
| Электродный потенциал | +1,3595 | ||||
| Степени окисления | -1, 0, +1, +3, +4, +5, +6, +7 | ||||
| Энергия ионизации (первый электрон) |
1254,9(13,01) кДж/моль (эВ) | ||||
| Термодинамические свойства простого вещества | |||||
| Плотность (при н. у.) |
3,21 г/л; (жидкая фаза при −35 °C) 1,557 г/см3; (твердая фаза при −105 °C) 1,9 г/см³ |
||||
| Температура плавления | 172,2К; −100,95 °C | ||||
| Температура кипения | 238,6К; −34,55 °C | ||||
| Критическая точка | 416,9 К, 7,991 МПа | ||||
| Теплота плавления | 6,41 кДж/моль | ||||
| Теплота испарения | 20,41 кДж/моль | ||||
| Молярная теплоёмкость | 21,838 Дж/(K·моль) | ||||
| Молярный объём | (ж) 18,7 см³/моль | ||||
| Кристаллическая решётка простого вещества | |||||
| Структура решётки | Орторомбическая | ||||
| Параметры решётки | a=6,29 b=4,50 c=8,21 Å | ||||
| Прочие характеристики | |||||
| Теплопроводность | (300 K) 0,009 Вт/(м·К) | ||||
| Эмиссионный спектр | |||||
|
|
|||||
Хлор — химический элемент VII группы Периодической системы химических элементов Дмитрия Ивановича Менделеева. Название происходит от греческого слова «χλωρóς», что означает «зелёный». Это связано с тем, что хлор при обычных условиях — газ желто-зелёного цвета, с резким удушливым запахом, в 2,5 раза тяжелее воздуха, ядовит. Простое вещество хлор образовано двухатомной молекулой (Cl2). В природе встречается только в виде соединений, преимущественно хлоридов — солей соляной кислоты. В промышленности хлор получают электролизом раствора поваренной соли. Хлор убивает болезнетворные бактерии, применяют для обеззараживания питьевой воды. Кроме этого он обладает отбеливающим действием и является компонентом для получения поливинил хлорида[1].
История открытия элемента
Газообразный хлор был получен шведским химиком Карлом Шееле в 1774 году. Учёный исследовал чёрную магнезию (Magnesia nigra — пиролюзит) и обнаружил, что она растворяется в холодной соляной кислоте с образованием раствора темно-коричневого цвета. Шееле собрал газ в пузырь и, наблюдая за ним, заметил, что газ разъедает пробки, обесцвечивает живые цветы, действует на все, кроме золота, металлов, образует дым, смешанный с аммиаком, а при соединении с содой — обычную соль[2]. В 1809 году Луи Гей-Люссак и Жак Тенар пропускали соляную кислоту над углем в раскаленной фарфоровой трубке. На выходе из трубы газ остался неизменным, как и уголь. Дэви повторил эти опыты и попытался электролитически разложить окисленную соляную кислоту, но в обоих случаях «кислота» не показала никаких изменений. Исследуя действие «кислоты» на металлы и их окислы металлов, Дэви установил образование хлористых солей. Отсюда следовало, что окисленная соляная кислота является элементарным веществом, и Дэви решил дать ей новое название: хлор или газообразный хлор. Газ имел желто-зелёный цвет, отсюда и его название от греч. — желто-зелёный. Аргументы Дэви были приняты большинством химиков. В 1812 году Гей-Люссак предложил изменить название газа на «хлор», что было общепринято во всех странах, кроме Англии и США. Свойство хлора легко соединяться с щелочными металлами с образованием хлоридов дало повод Швейгеру предложить в 1811 году название галоген (солеобразователь, раствор соли)[3].
Положение элемента в Периодической системе химических элементов Д. И. Менделеева, строение атома
В Периодической системе химических элементов Дмитрия Ивановича Менделеева хлор находится в главной подгруппе VII группы. Элнектронная структура хлора 1s2 2s22p6 3s23p5. В соединениях проявляет степень окисления: −1; +1; +3; +4; +5; +7. Хлор наиболее устойчив в степени окисления −1 и +7. Атомная масса хлора составляет 35,453. Хлор имеет два стабильных изотопа с массовыми числами 35 и 37[4].
Нахождение в природе
Содержание хлора в земной коре составляет 4,5*10−2%. Вследствие высокой реакционной способности хлор в чистом виде встречается только в вулканических газах. В связанном виде он находится в горных породах, морской, речной и озерной водах, в растительных и животных организмах. Связанный хлор является составной частью многих минералов, например таких, как галит NaCl, сильвин KCl, сильвинит KCl*NaCl, карналит KCl*MgCl2*6H2O[5].
Физические свойства
При обычных условиях хлор — желто-зелёный газ, обладающий резким, специфическим запахом. В 2,5 раза тяжелее воздуха. Хлор обладает сильным удушливым запахом. Вдыхание его даже в небольших количествах может привести к воспалению со смертельным исходом. В качестве противоядия при острых отравлениях применяют вдыхание паров смеси спирта с эфиром. Полезно также вдыхание чистого кислорода или паров нашатырного спирта[2].
Химические свойства
Хлор является очень активным химическим элементом. Взаимодействует с большинством элементов периодической системы, за исключением кислорода, азота, углерода и иридия[1].
| 1. | Взаимодействие хлора с водородом | |
| Cl2 + H2 = (hv) 2HCl + Q | ||
| 2. | Взаимодействие хлора с серой | |
| Cl2 + S = SCl2 или (S2Cl2) | ||
| 3. | Взаимодействие хлора с фосфором | |
| 5Cl2 (изб) + 2P = 2PCl5 | ||
| 3Cl2 (нед) + 2P = 2PCl3 | ||
| 4. | Взаимодействие хлора с элементами IV А группы происходит по схеме: | |
| Hal + C, N2, O2 = | ||
| 2Hal2 + Si = SiHal4 (Hal = F, Cl, Br, I) | ||
| CH4 + 4Cl2 = (hv) CCl4 + 4HCl | ||
| 5. | Взаимодействие галогенов между собой | |
| F2 + Cl2 = 2ClF | ||
| 6. | Бинарные соединения, полученные в реакциях выше — неустойчивы
по отношению к воде. Исключение: CHal4 и SF6 — устойчивы к гидролизу! | |
| SiCl4 + 3H2O = H2SiO3 + 4HCl | ||
| ClF + H2O = HClO + HF | ||
| PCl5 + 4H2O = H3PO4 + 5HCl | ||
| 7. | Взаимодействие хлора с металлами. | |
| Cl2 + Ca = CaCl2 | ||
| Cl2 + Fe = 2FeCl3 | ||
| Cl2 + Cu = CuCl2 | ||
| 8. | Галогены не реагируют с кислородом — O2. Оксиды галогенов — кислотные оксиды. | |
| Cl2O + H2O = 2HClO | ||
| ClO2 + H2O = HClO2 + HClO3 | ||
| Cl2O6 + 2NaOH = NaClO3 + NaClO4 + H2O | ||
| Cl2O7 + 2NaOH = 2NaClO4 + H2O | ||
| 9. | Взаимодействие хлора со сложными веществами | |
| без нагревания | t | |
| Cl2 + H2O = HClO + HCl | 3Cl2 + 3H2O = (t) HClO3 + 5HCl | |
| Cl2 + 2KOH = KClO + KCl + H2O | 3Cl2 + 6KOH = (t) KClO3 + 5KCl + 3H2O | |
| 2Cl2 + 2Ca(OH)2охл = CaCl2 + Ca(OCl)2+ 2H2O | ||
| 10. | Хлор вытесняет из растворов кислоты или соли менее активный галоген | |
| Cl2 + 2HBr = Br2 + 2HCl Cl2 + 2NaBr = Br2 + 2NaCl | ||
| Cl2 + H2S = 2HCl + S / Br2 + H2S = 2HBr + S | ||
| 4Cl2 + H2S + H2O = 8HCl + H2SO4 | ||
| 11. | Хлор — окислитель | |
| Cl2 + Na3SO3 + H2O = 2HCl + Na2SO4 | ||
| 2Cl2 + MnSO4 + 8KOH = K2MnO4 + 4KCl + K2SO4 + 4H2O | ||
| 3Cl2 + 2CrCl3 + 16KOH = 12KCl + 2K2CrO4 + 8H2O | ||
| 6FeSO4 + 3Cl2 (р-р) = 2Fe(SO4)3 +2FeCl3 | ||
| 13. | Взаимодействие между галогенами в водном растворе | |
| 5Сl2 + Br2 + H2O = 10HCl + 2HBrO3 | ||
| 5Сl2 + I2 + H2O = 10HCl + 2HIO3 | ||
| 5Сl2 + Br2 + 12KOH = 10KCl + 2KBrO3 + 6H2O | ||
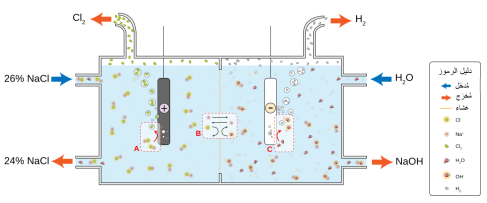
Получение хлора
В промышленности хлор получают в больших количествах путем электролиза как расплавов, так и растворов хлоридов. При электролизе водного раствора с применением инертных электродов на аноде выделяется Cl2, на катоде — H2, в растворе в катодном пространстве образуется щелочь NaOH. Хранят хлор и перевозят в стальных баллонах под давлением 6 атм[5].
| 4HCl + MnO2 = (t) Cl2 + MnCl2 + 2H2O |
| 2KMnO4 + 16HCl = (t) 2KCl + 2MnCl2 + 5Cl2 + 8H2O |
| KClO3 + 6HCl = (t) KCl + 3Cl2 + 3H2O |
| 14HCl + K2Cr2O7 = (t) 3Cl2 + 2CrCl3 + 2KCl + 7H2O |
| 2NaCl (расплав) = (электролиз) 2Na + Cl2 |
| 2NaCl + 2H2O = (электролиз) NaOH + H2 + Cl2 |
Применение хлора
Хлор используют для получения ряда продуктов в различных отраслях химической промышленности, и прежде всего хлорной извести, которую применяют для отбеливания. Большие количества хлора используют в качестве дезинфицирующего средства, например, для питьевой воды. Хлор необходим для синтеза хлорсодержащих органических растворителей, а также может быть применён при получении брома[6].
Примечания
- ↑ 1,0 1,1 Еремин, В.В. Химия: Углубленный уровень. — Москва: Дрофа, 2019. — 471 с.
- ↑ 2,0 2,1 Ершов, Ю. А., Попков, В. А., Берлянд, А. С. Общая химия. Биофизическая химия. Химия биогенных элементов: учеб. для вузов/ Ю. А. Ершов, В. А. Попков, А. С. Берлянд и др: Под ред. Ю. А. Ершова. - 2-е изд., испр. и доп.. — Москва: Высшая школа, 2000. — 553 с.
- ↑ Хлор: история открытия элемента. Химический факультет МГУ. Дата обращения: 21 августа 2023.
- ↑ Галогены. Химия галогенов. Дата обращения: 22 августа 2023.
- ↑ 5,0 5,1 Фрумниа, Н. С., Лисенко, Н. Ф., Чернова, М. А. Аналитическая химия элементов. — Москва: Наука, 1983. — 101 с.
- ↑ Распространение хлора: как и где хлор используется в нашей жизни?. Гермес-газ. Дата обращения: 22 августа 2023.
Данная статья имеет статус «готовой». Это не говорит о качестве статьи, однако в ней уже в достаточной степени раскрыта основная тема. Если вы хотите улучшить статью — правьте смело! |
Данная статья имеет статус «проверенной». Это говорит о том, что статья была проверена экспертом |