Азот
| |||||
| Внешний вид простого вещества | |||||
|---|---|---|---|---|---|
 |
|||||
| Свойства атома | |||||
| Имя, символ, номер | Азо́т / Nitrogenium (N), 7 | ||||
| Группа, период, блок |
15 (устар. 5), 2, p-элемент |
||||
| Атомная масса (молярная масса) |
[14,00643; 14,00728] Указан диапазон значений атомной массы в связи с неоднородностью распространения изотопов в природе.[1] а. е. м. (г/моль) | ||||
| Электронная конфигурация |
[He] 2s22p3 1s22s22p3 |
||||
| Радиус атома | 75 пм | ||||
| Химические свойства | |||||
| Ковалентный радиус | 75 пм | ||||
| Радиус иона | 13 (+5e) 171 (−3e) пм | ||||
| Электроотрицательность | 3,04[2] (шкала Полинга) | ||||
| Степени окисления | -3, -2, -1, 0, +1, +2, +3, +4, +5 | ||||
| Энергия ионизации (первый электрон) |
1401,5 (14,53) кДж/моль (эВ) | ||||
| Термодинамические свойства простого вещества | |||||
| Плотность (при н. у.) | 0,808 г/см³ (-195,8 °C); 1,1649 кг/м³ в стандартных условиях по ГОСТ 2939-63; при н. у. 0,001251 г/см³ | ||||
| Температура плавления | 63,29 K (−209,86 °C) | ||||
| Температура кипения | 77,4 K (−195,75 °C) | ||||
| Теплота плавления | (N2) 0,720 кДж/моль | ||||
| Теплота испарения | (N2) 5,57 кДж/моль | ||||
| Молярная теплоёмкость | 29,125[3] (газ N2) Дж/(K·моль) | ||||
| Молярный объём | 22,4⋅103 см³/моль | ||||
| Кристаллическая решётка простого вещества | |||||
| Структура решётки | Кубическая | ||||
| Параметры решётки | 5,661 Å | ||||
| Прочие характеристики | |||||
| Теплопроводность | (300 K) 0,026 Вт/(м·К) | ||||
| Номер CAS | 7727-37-9 | ||||
| 7 | Азот
|
| 2s22p3 | |
Азо́т (химический символ — N, от греч. ἀ- — не и ζωός — живой; лат. Nitrogenium) — химический элемент с атомным номером 7, атомной массой 14,007; расположен во втором периоде, V-группы периодической системы химических элементов Д. И. Менделеева (15-й группы в длиннопериодном её варианте). Электронная конфигурация атома ― 1s22s22p3. Неметалл, простое вещество N2 представляет собой бесцветный газ без запаха. Объемное содержание азота в воздухе составляет 78 %. Температура кипения азота составляет 195,8 °C, теплоемкость газообразного азота составляет 29, 125 кДж/моль·К. Имеет два природных стабильных изотопа ―14N (99,635 %) и 15N (0,365 %)[4]. Азот относится к так называемым макротрофным элементам, составляющим химическую основу тканей живых организмов. Входит в состав белков.
История открытия
Впервые азот был описан английским учёным Э. Резерфордом в 1772 году. В своей работе Д. Резерфорд описал свойства газообразного азота, обратив внимание на то, что это вещество не поддерживает процессы горения и дыхания. Учёным было дано название азоту как «ядовитый воздух» («удушливый газ»)[4][5]. Также в 1772 году Д. Пристли получил «ядовитый воздух», назвав его «флогистированный воздух». В 1773 году шведский аптекарь из города Штральзунда К. Шееле установил состав воздуха, как газа, состоящего из двух газов, один из которых не поддерживает дыхание и горение. Этот газ получил название — «дурной или испорченный воздух»[6].
В 1776 году французский учёный А. Л. Лавуазье, исследовав все открытые газообразные вещества — «ядовитый воздух», «флогистированный воздух» и «дурной или испорченный воздух», установил, что речь идёт об одном и том же газе. В 1787 году было предложено назвать эту часть воздуха — «азот», что в переводе с греческого языка означает «безжизненный». В настоящее время «безжизненный» азот — это элемент, входящий в состав белков, является элементом жизни[4][6].
В 1784 году Г. Кавендишем было установлено содержание азота в составе селитры. В 1790 году элемент под номером 7 получил латинское название — азот (от позднелат. nitrum — «селитра» и греч. γεννάω — «рождать») и введён как термин Ж. Шапталом в химическую науку. В начале XIX века было обосновано понятие о химической инертности азота, находящегося в свободном состоянии, и важная роль связанного азота[6].
Нахождение в природе
Азот — это четвёртый элемент по распространению в природе после водорода (Н2), гелия (Не) и кислорода (О2), является самым распространённым элементом Солнечной системы. Азот обнаружен в кометах, метеоритах, солнечном ветре, в фотосфере Солнца. Азот входит в состав атмосферы Венеры, Марса. В остальных космических объектах азот находится в восстановленном состоянии[6].
Азот в атмосфере Земли содержится в количестве — около 3,9•1015 т. Азот в атмосфере может находится в свободном и связанном состоянии. Но основная его часть находится в свободном состоянии. В воздухе находится азота — 78,09 % по объёму, 75,6 % по массе. В связанном состоянии азот присутствует в виде незначительного количества аммиака (NH3) и оксидов. В земной коре азота содержится — 1•10-2 % по массе, в том числе, в связанном состоянии азот встречается главным образом в виде селитры (нитратов) и аммониевых соединений[4].
В нижних слоях стратосферы изотоп 14N превращается в радионуклид углерода 14C под воздействием нейтронного космического излучения. Азот принимает участие в углеродно-азотном цикле в термоядерных реакциях в космических звёздах[4].
Также азот в природе может встречаться в виде следующих соединений:
- азот — элемент, входящий в состав нуклеиновых кислот (ДНК и РНК), белков;
- индийская селитра, калиевая селитра KNO3;
- чилийская селитра, натриевая селитра NaNO3[7].
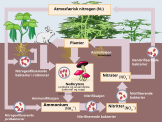
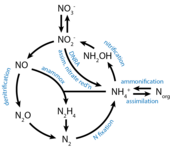
Биохимический цикл азота в природе
Круговорот азота в природе — замкнутый цикл обмена химическими элементами живых организмов с абиотической средой. Биохимический цикл циркуляции азота в природе состоит из следующих стадий[8].
- Азот, содержащийся в атмосфере в форме молекулярного азота N2, доступен лишь для клубеньковых бактерий, почвенных бактерий родов азотобактер и клостридиум, цианобактерий. Эти батерии способны преращать молекулярный азот в в ионы аммония (NH4+). Затем это связанный азот входит в состав аминокислот и белков, образующих живые организмы. После их гибели аминокислоты и белки превращаются в аммиак (NH3).
- С помощью почвенных бактерий в почве происходит процесс окисления аммония в нитриты → нитраты.
- Нитраты и аммоний из почвы с помощью корневой системы попадают в растения, восстановливаются аммония. Аммоний входит в состав аминокислот и белков, которые выполняют функцию пищи для животных. Животные используют эти вещества, синтезируя соственные белки. Частично образовавшиеся белки окисляются, при этом, образовавшиеся аммиак, мочевина, мочевая кислота (в зависимости от группы животных), выводятся в окружающую среду. Часть аммония в почве денитрифицирующими бактериями окисляется до молекулярного N2.
Во время этого цикла азота в природе возможны: потери азота и их компенсация в результате извержения вулканов и других видов геологической активности[8].
Строение
Электронное строение
Азот — химический элемент второго периода главной подгруппы VA — группы периодической системы химических элементов Д. И. Менделеева с электронной конфигурацией атома ― 1s22s22p3. Так как у атома азота нет свободных (вакантных) d-орбиталей), то он может образовывать не более трёх химических связей (быть 3-х валентным атомом) благодаря своим неспаренным электронам. При это его валентность может быть равной трём. Выступая в роли «донора» пары электронов s-оболочки, атом азота способен образовывать по донорно-акцепторному механизму четвёртую химическую связь[9].
Ион N+способен образовывать четыре связи в состоянии положительно заряженного (ионизированного) состояния с четырьмя неспаренными электронами. То есть, азот, как все элементы второго периода, относится к предельно четырёхвалентным элементам. Ион азота N−2 в состоянии отрицательного заряженного ионизированного состояния может быть двухвалентным. Согласно методу валентных связей и молекулярных орбиталей в молекуле азота N2 имеет место тройная химическая связь — N≡N, одна из которой σ-сигма и две π-пи связи. В соответствие с этим, в пространстве взаимно перпендикулярно — по соответствующим осям координат располагаются три p-орбитали каждого атома азота. Орбитали разных атомов азота, оказавшиеся ориентированными по одной и той же оси, образуют σ-связь, а взаимно параллельные расположенные орбитали орбитали образуют π-связь[9][7].
В соединениях атомы азота могут находится:
- в состоянии sp3-гибридизации атомных орбиталей, если образуются только σ-связи;
- в состоянии sp2-гибридизации, если оразуются одна π-связь;
- в состоянии sp-гибридизации, если в имеется две π-связи[9].
Электроотрицательность атома азота достаточно высокая и составляет 3,04 по шкале Полинга. В связях с атомами кислорода O и фтора F, имеющих большую электроотрицательность, атом азота N положительно поляризован. Соединения азота с хлором, бромом и некоторыми другими элементами можно отнести к ковалентным неполярным. В соединениях с остальными элементами атом азота поляризован отрицательно. В своих соединениях азоту характерны степени окисления: от низшей −3 до высшей +5[9][7].
Физические свойства
При нормальных условиях по физическим свойствам азот — двухатомный газ без запаха, вкуса и цвета, обладающий слабой растворимостью в воде — 0,0291 кг на 1 м3 (при 0 °C), в таких углеводородах, как гексан и гептан, его растворимость выше чем в воде, химически инертный. Немного легче воздуха. Не поддерживает горения и дыхания. Температура плавления азота tпл составляет минус 209,86 °C, температура кипения tкип = −195,75 °C, в твёрдом агрегатном состоянии при температуре 252,15 °C плотность равна 1026 кг/м3, в жидком при температуре = −195,75 °C — 808 кг/м3 , в газообразном при 0 °C —1,2506 кг/м3. Критическая параметры состояния азота: температура = −146,95 °C, критическое давление = 3,9 МПа, критическая плотность = 304 кг/м3[4].
Азот с плотностью 1026,5 кг/м3 обладает устойчивой α-формой с кубической кристаллической решёткой, находясь в твёрдом состоянии при нормальном давлении и температуре ниже минус 238,15 °C. β-форма с гексагональной кристаллической решёткой характерна для азота с плотностью 879,2 кг/м3 при температуре выше минус 238,15 °C. Третью модификацию с тетрагональной кристаллической решёткой азот имеет при давлении выше 350 МПа[4].
Химические свойства азота
Азот, обладая прочной внутримолекулярной химической связью, имея небольшой размер и неполярность молекулы, характеризуется слабым межмолекулярным взаимодействием. Это объясняет низкие температуры кипения и плавления. Контактируя с воздухом, азот из него поглощает кислород[4].
Азот переходит в твердое состояние при температуре −209,86 °. По внешнему виду — это снегоподобная масса или белоснежные кристаллы больших размеров. Взаимодействует с воздухом, поглощая кислород, образует раствор кислорода в азоте, при этом плавится[4].
Молекулярный азот обладает очень низкой реакционной способностью, что обусловлено наличием в молекуле N2 тройной связи, а также неполярностью молекулы. Так как молекула азота неполярна и слабо поляризуется, силы взаимодействия между молекулами очень слабые, поэтому в обычных условиях азот газообразен. Азот проявляет свойства окислителя при взаимодействии с элементами, расположенными ниже и левее в Периодической системе элементов Д. И. Менделеева, и может быть восстановителем в реакциях с элементами, расположенными выше и правее в системе элементв. Поэтому азот способен реагировать и с металлами и неметаллами[10].
- В обычных условиях не реагирует с кислотами, щелочами, галогенами, серой. При комнатной температуре азот реагирует лишь с некоторыми сильными восстановителями, например литием[7], являясь окислителем:
6Li + N2 = 2Li3N (в присутствии влаги).
Аналогичным образом азот взаимодействует с цезием.
- При воздействии электрического разряда при температуре выше 1000 °С (например, во время грозы) молекулярный азот взаимодействует с кислородом c поглощением теплоты и образованием оксида азота (II), проявляя свойства восстановителя:
N2 + O2 ↔ 2NO — Q
N2 + 3F2 ↔ 2NF3
- При нагревании до 3000 °С — 5000 °С или действие электрического разряда атомарный азот реагирует с углеродом с образованием бинарных соединений[10]:
2С + N2 → N≡C-C≡N
- Реакция с водородом протекает при повышенной температуре (500 ºС) и давлении (350 атм.) в присутствии катализатора (Fe):
N2 + 3H2 ↔ 2NH3
N2 + 3Mg = Mg3N2 (на воздухе, 700—800 ºС);
N2 + 2Al (порошок) = 2AlN (800—1200 ºС)
Способы получения азота
Промышленный способ
Молекулярный азот в промышленности получают фракционной перегонкой жидкого воздуха. Получают азот методом низкотемпературного фракционного разделения жидкого воздуха. Криогенный процесс называется ректификацией, который основан на разных температурах кипения жидкого азота и кислорода, которые соответственно равны минус 196 °С и минус 183 °С. Так как температура кипения жидкого азота ниже температуры кипения жидкого кислорода, то дистиллятом (продукт), отбираемым с верхней части ректификационной колонны, является жидкий азот, а кубовым остатком — жидкий кислород. Этот метод используется для получения «атмосферного азота». Для получения азота также применяют методы мембранного и адсорбционного газоразделения[7].
Лабораторный способ
В лабораторных условиях чистый азот получают, нагревая до 70 °C концентрированный водный раствор нитрита аммония NH4NO2 или смеси растворов хлорида аммония NH4Cl и нитрита натрия NaNO2[7]:
NH4NO2 → N2↑ + H2O, или суммарно: (NH4)2SO4 + 2NaNO2 → N2↑ + Na2SO4 + H2O.
Эта реакция протекает при следующих условиях[7]:
- насыщенный раствор нитрита натрия по каплям добавляют в насыщенный раствор хлорида (или сульфата) аммония;
- затем полученную смесь нагревают, образующийся в результате обменной реакции нитрит аммония начинает мгновенно разлагаться;
- азот, выделяющийся в ходе реакции, собирают в сосуд с водой с помощью газотводной трубки. Выделяющийся азот, вытесняя воду, заполняет ёмкость. Так как азот не поддерживает горения, то внесённая в сосуд горящяя лучина гаснет, тем самым доказывая образование азота.
Пропуская аммиак NH3 над оксидом меди(II) СиО при нагревании до 700 °С, также выделяется газообразный азот и образуется медь[7]:
NH3 + 3CuO → N2↑ + 3H2O + 3Cu↓
При разложении дихромата аммония при нагревании выделяется газообразный азот и образуется оксид хрома (III) Cr2O3. Эта реакция носит название «Химический вулкан»[7]:
(NH4)2Cr2O7 = N2↑ + Cr2O3 + 4H2O
При горении аммиака выделяется чистый азот[7]:
4NH3 + 3O2 → 2N2↑ + 6H2O
При наревании азида натрия NaN3 до 300 °С, азид разлагается с образованием чистого азота (условия реакции строго контролируюся)[7]:
2NaN3 → 2Na + 3N2
Применение
Широкое применение в промышленности газообразного азота объясняется его инертными свойствами: газообразный азот — взрыво- и пожаробезопасное вещество, препятствующее процессам окисления и гниения.
Газообразный азот применяется:
- является сырьём для получения аммиака, азотной кислоты, азотных удобрений, взрывчатых веществ, красителей;
- в химических и металлургических процессах, при перемещении горючих жидкостей он используется в качестве инертной среды;
- в больших количествах используется в коксохимическом производстве для «сухого тушения кокса» во время выгрузки кокса из коксовых батарей;
- в космической промышленности при помощи азота «передавливают» топливо в ракетах из баков в насосы или двигатели;
- в нефтедобывающей промышленности применяют с целью обеспечения безопасного бурения, капитального и текущего ремонта скважин;
- в нефтехимической промышленности — для продувки резервуаров и трубопроводов, для проверки работы трубопроводов под давлением;
- в горнодобывающей промышленности — для создания взрывобезопасной среды в шахтах, для распирания пластов породы;
- для тушения эндогенных пожаров как газообразным так и жидким азотом;
- в производстве электроники — для продувки с целью удаления кислорода;
- в пищевой промышленности — для упаковки и хранения в качестве газовой среды, пищевая добавка E941.
Жидкий азот применяют:
- в медицине;
- в вакуумных установках, криостатах как хладоагент для глубокого охлаждения;
- при разливе масел и негазированных напитков для создания избыточного давления и инертной среды в мягкой таре.
Уровень опасности и меры предосторожности
При не соблюдении правил техники безопасности, при использовании или хранении, азот может быть опасным для жизнедеятельности человека и окружающей среды. Азот — вредное вещество, оказывающее вредное воздействие на дыхательную систему человека, вызывает удушье, может привести к развитию хронических заболеваний. В определённых условиях азот может стать источником пожара и взрыва[11].
Азот относится ко 2 классу опасности (ГОСТ Р 50597-93) в соответствии с Государственным стандартом России ГОСТ 19433-88 «Единая система определения и классификации опасных веществ». 2 класс опасности указывает, что это вещества, способные вызывать замерзание тканей и при длительном воздействии на организм человека токсически воздействовать на органы дыхания[11].
Поэтому при работе с азотом должны выполняться следующие нормативы безопасности (согласно ГОСТ 19433-88).
- Хранить и транспортировать азот необходимо вдали от источников открытого огня, высоких температур и в хорошо проветриваемом помещении.
- При взаимодействии с азотом работники должны использовать защитное снаряжение, к которым относится специальная спецодежда, защитные очки и противогазы.
- Максимально допустимая концентрация азота в воздухе рабочей зоны не должна быть более 20 %.
- Не допускать случайного выброса азота в атмосферу. Если это произошло, то необходимо принять меры по предотвращению возможности образования взрывоопасных веществ.
- Учитывать особенности конкретных условий для обеспечения безопасной работы с азотом[11].
Литература
- Глинка Н. Л. Общая химия: учебное пособие для СПО. — М.: КноРус, 2019. — 360 c.
- Глинка Н. Л. Общая химия: учебное пособие для вузов / под ред. А. И. Ермакова. — М.: Интеграл-Пресс, 2003. — 728 с.
- Карапетьянц М. Х. Общая и неорганическая химия: учебник / под ред. М. Х. Карапетьянц, С. И. Дракин. — М.: Ленанд, 2018. — 600 c.
- Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 58. — 623 с. — 100 000 экз.
- Общая химия. Учебник / под ред. С. Ф. Дунаева. — М.: Academia, 2017. — 160 c.
- Общая и неорганическая химия: учебное пособие / под ред. В. В. Денисова, В. М. Таланова. — Рн/Д: Феникс, 2018. — 144 c.
Примечания
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02. Архивировано 5 февраля 2014 года.
- ↑ Nitrogen: electronegativities (англ.). WebElements. Дата обращения: 5 августа 2010. Архивировано 29 марта 2016 года.
- ↑ Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1988. — Т. 1. — С. 58. — 623 с. — 100 000 экз.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 4,7 4,8 Азот. Большая Российская энциклопедия. Дата обращения: 18 мая 2024.
- ↑ Азот. Химия азота и его соединений. Дата обращения: 18 мая 2024.
- ↑ 6,0 6,1 6,2 6,3 Азот: история открытия, нахождение в природе, биохимический цикл азота в природе (13 января 2024). Дата обращения: 20 мая 2024.
- ↑ 7,00 7,01 7,02 7,03 7,04 7,05 7,06 7,07 7,08 7,09 7,10 Тарасова А. В., Феофанов Д. А., Финогенко Т. М., Фабинский П. В. Неорганическая химия. Азот и его соединения. — Красноярск: СибГУ им. М. Ф. Решетнева, 2022. — 96 с. — ISBN ББК 24.128я73.
- ↑ 8,0 8,1 Биогеохимические циклы углерода, азота, фосфора. ЯКласс. Дата обращения: 6 августа 2024.
- ↑ 9,0 9,1 9,2 9,3 9,4 Кузнецова И. В., Хмелёв С.С. Химия азота и его важнейших соединений. — Саратовский Государственный университет. — 50 с.
- ↑ 10,0 10,1 Азот. Дата обращения: 8 сентября 2024.
- ↑ 11,0 11,1 11,2 Азот класс опасности по ГОСТ // База ГОСТ, ГОСТ Р — национальные стандарты РФ.
Ссылки
- Азот, химический элемент // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Данная статья имеет статус «готовой». Это не говорит о качестве статьи, однако в ней уже в достаточной степени раскрыта основная тема. Если вы хотите улучшить статью — правьте смело! |
Данная статья имеет статус «проверенной». Это говорит о том, что статья была проверена экспертом |