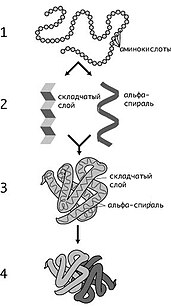
Белки
Белки́ (протеины, полипептиды) — это высокомолекулярные природные полимеры, органические соединения, которые состоят из L-α-аминокислот, соединенных между собой пептидной связью (–CO–NH–). В живых организмах образуются на рибосомах в ходе трансляции. Аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 аминокислот. Характеризуются специфической аминокислотной последовательностью и индивидуальной пространственной структурой (конформацией). Белки являются основным строительным материалом для клеток и тканей нашего тела. Они участвуют в формировании мышц, костей, кожи, волос и других органов и систем[1][2].
Структура
Первичная
Первичная структура — линейная молекула, образованная пептидной связью между остатками аминокислот. Точный порядок соединения аминокислот определяется информацией, хранящейся в генах. Посредством процессов, называемых транскрипцией и трансляцией, ДНК предоставляет клеткам всю необходимую информацию для создания точной первичной структуры тысячи различных белков. Первичная структура определяет вторичную и третичную структуру белков, функции и свойства белка[3].
Вторичная
Вторичная структура образуется за счёт водородных связей между группами атомов —C=O и —NH— разных аминокислотных остатков полипептидной цепи. Белковая цепь может сворачиваться в спираль (α-спираль) или образовывать складки (β-складчатость). Эти структуры обеспечивают стабильность и компактность белковой молекулы[4].
Третичная
Третичная структура формируется в результате взаимодействия радикалов аминокислот, а также благодаря образованию дисульфидных мостиков, водородных и ионных связей. В итоге молекула белка приобретает форму глобулы, то есть шарообразную форму[5].
Четвертичная
Четвертичная структура — это белки, состоящие из нескольких полипептидных цепей, связанных друг с другом. Примером такого белка является гемоглобин, который состоит из четырёх полипептидных цепей, объединённых в одну молекулу. Благодаря своей структуре гемоглобин может выполнять дополнительные функции, такие как кооперативное связывание кислорода, что играет важную роль в процессе переноса кислорода кровью[6].
Свойства
Денатурация и ренатурация — это два важных процесса, характерные для белков.
Денатурация
Потеря белком своей трёхмерной структуры называется денатурацией. Это может произойти из-за изменения температуры, обезвоживания, воздействия рентгеновских лучей и других факторов. Сначала разрушается самая слабая структура — четвертичная, затем третичная, вторичная и при самых жёстких условиях — первичная. Однако если изменение условий среды не приводит к разрушению первичной структуры молекулы, то при восстановлении нормальных условий полностью воссоздаётся и структура белка. Этот процесс называется ренатурацией[7].
Ренатурация
Способность белков восстанавливать утраченную структуру называют ренатурацией. Этот процесс широко используется в медицинской и пищевой промышленности. Например, с помощью этого свойства получают некоторые медицинские препараты, такие как антибиотики, а также пищевые концентраты, сохраняющие питательные вещества даже после высушивания. У некоторых живых организмов частичная обратная денатурация белков связана с их функциями, такими как двигательная, сигнальная и каталитическая. Ренатурация позволяет белкам выполнять свои функции более эффективно[7].
Функции
У человека белки составляют порядка 80 % от сухой массы тела и выполняют огромное количество жизненно важных функций, таких как:
- структурная — белки являются основным строительным материалом клеток, входят в состав межклеточного вещества[8];
- каталитическая — белки-ферменты катализируют (ускоряют) биохимические реакции, протекающие в организме[8];
- сократительная — белки мышечных волокон способны перемещаться относительно друг друга, что делает возможным сокращение мышц[8];
- опорная — белки коллаген и эластин образуют основу костей, хрящей, кожи, связок и сухожилий;
- транспортная — белки-переносчики, входящие в состав клеточных мембран, связывают различные вещества и перемещают их через мембрану. Белки крови связывают кислород, жиры, гормоны, витамины и транспортируют их по организму[8];
- рецепторная — специальные белки рецепторы на поверхности клеточных мембран связывают гормоны и другие биологически активные вещества, благодаря чему те получают возможность влиять на протекающие в клетке процессы[8];
- регуляторная — многие гормоны, контролирующие обмен веществ, являются аминокислотами, пептидами или белками[8];
- защитная — белки иммунной системы уничтожают бактерии, вирусы, раковые клетки. Белки свертывающей системы крови защищают от кровопотери при ранениях[8];
- буферная — белки плазмы крови связывают излишки кислот и оснований, участвуя в поддержании кислотно-щелочного равновесия;
- поддержание водного баланса — белки плазмы крови участвуют в водном обмене, удерживая жидкость в сосудистом русле;
- наследственная — ДНК хранится в клетке в виде комплекса с белками, которые регулируют считывание с нее генетической информации[8];
- энергетическая — организм получает из белков около 5 % энергии в покое и до 10 % во время физической нагрузки[8].
Примечания
- ↑ Кольман Я., Рём К. - Г. Наглядная биохимия. — 2-е изд. — МИР, 2004. — С. 72.
- ↑ Белки (в биологии). Большая Российская энциклопедия. Дата обращения: 28 мая 2024.
- ↑ Структура белка (7 декабря 2023).
- ↑ Структура и свойства белков (26 апреля 2021).
- ↑ Третичная структура белков (3 мая 2015).
- ↑ Четвертичная структура белка. Свойства олигомерных белков. Роль четвертичной структуры в проявлении определенных функций белка (14 декабря 2020).
- ↑ 7,0 7,1 Свойства и функции белков.
- ↑ 8,0 8,1 8,2 8,3 8,4 8,5 8,6 8,7 8,8 Основные функции белков в организме.
Данная статья имеет статус «готовой». Это не говорит о качестве статьи, однако в ней уже в достаточной степени раскрыта основная тема. Если вы хотите улучшить статью — правьте смело! |