Углеводороды
Углеводоро́ды — класс органических соединений, состоящих из атомов углерода и водорода. Углеводороды образуют гомологические ряды, характеризующиеся закономерным изменением физических и химических свойств. Углеводороды являются фундаментальной основой органической химии. Молекулы любых других органических соединений рассматривают как производные углеводородов[1].
Классификация углеводородов
При систематизации (классификации) углеводородов принимают во внимание строение углеродного скелета и тип химических связей, соединяющих атомы углерода. По типу строения углеводороды делят на:
- алифатические (ациклические), молекулы которых представляют собой линейные или разветвлённые открытые цепи атомов углерода (алканы, алкены и алкины)[1];
- циклические углеводороды, молекулы которых представляют собой циклы из трёх и более атомов углерода. Циклические углеводороды включают в себя алициклические (циклоалканы или нафтены, циклоалкены) и ароматические углеводороды (арены), содержащие в составе особую циклическую группировку из шести атомов углерода, которые соединены между собой последовательно чередующимися простыми и двойными связями, образующими бензольное ядро. Ароматические углеводороды, имеющие в своей структуре несколько (два и более) конденсированных бензольных колец, называются полиядерными ароматическими углеводородами. Полиядерные ароматические углеводороды имеют свои тривиальные названия[1][2].
Углеводороды различают по типу химической связи между атомами углерода:
- насыщенные углеводороды состава CnH2n+2, в которых атомы углерода соединены простой связью, и углеводороды, содержащие одну или несколько кратных связей, называемые ненасыщенными углеводородами[2].
- Ненасыщенные углеводороды с одной двойной связью состава CnH2n называют олефинами или алкенами, с двумя двойными связями состава CnH2n-2 ― диолефиновыми углеводородами, или диенами, с одной тройной связью состава CnH2n-2 ― ацетиленовыми углеводородами, или алкинами[1].
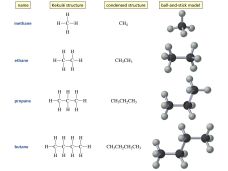
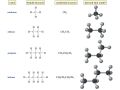
Гомологический ряд алканов представлен в таблице 1.
| Состав алкана | Название алкана | Состав радикала | Название радикала |
|---|---|---|---|
| CH4 | метан | CH3— | метил |
| C2H6 | этан | C2H5— | этил |
| C3H8 | пропан | C3H7— | пропил |
| C4H10 | бутан | C4H9— | бутил |
| C5H12 | пентан | C5H11— | пентил |
| C6H14 | гексан | C6H13— | гексил |
| C7H16 | гептан | C7H15— | гептил |
| C8H18 | октан | C8H17— | октил |
| C9H20 | нонан | C9H19— | нонил |
| C10H22 | декан | C10H21— | децил |
Классификация углеводородов представлена в таблицах 2, 3, 4[1][2].
| Ациклические (алифатические) углеводороды | |||
| Углеводороды (УВ) | Класс УВ | Общая формула | Пример УВ |
| предельные | алканы | CnH2n+2 | метан — СН4 |
| непредельные | алкены | CnH2n | этен (этилен) — С2Н4 |
| алкадиены | CnH2n-2 | Бутадиен — С4Н6 | |
| алкины | CnH2n-2 | Этин (ацетилен) — С2Н2 | |
| Карбоциклические углеводороды | |||
| алициклические | циклоалканы | CnH2n | циклопропан — С3Н6 |
| ароматические | арены | CnH2n-6 | бензол — С6Н6 |
| Углеводороды (УВ) | Класс УВ | Общая формула | |
|---|---|---|---|
| Ациклические (алифатические) | предельные
непредельные |
алканы
алкены, алкадиены, алкины |
CnH2n+2 CnH2n CnH2n-2 |
| Карбоциклические | алициклические
ароматические |
циклоалканы
арены |
CnH2n-2CnH2n-6 |
| Углеводороды | Суффикс | Химические связи | Гибридизация |
|---|---|---|---|
| Ациклические (алифатические) углеводороды | |||
| алканы | -ан | одинарные, сигма-связи | sp³ |
| Непредельные углеводороды | |||
| алкены | -ен | одна двойная, сигма- и пи-связь | sp² |
| алкадиены | -диен | две двойные, сигма- и пи-связь | sp² |
| алкины | -ин | одна тройная, сигма- и две пи-связи | sp |
| Карбоциклические углеводороды | |||
| алициклические — циклоалканы | цикло...-ан | замкнутый цикл из атомов углерода | sp³ |
| ароматические — арены | ...бензол | ароматическая система С6Н5– | sp² |
Физические свойства
Углеводороды (алканы) с числом атомов углерода от 1 до 4 — газы без цвета и запаха, от 5 до 16 включительно — жидкости с запахом бензина, выше — твёрдые вещества белого цвета, жирные на ощупь. Температуры кипения и плавления, а также плотность увеличиваются с ростом числа атомов углерода. Алканы практически нерастворимы в воде, но хорошо растворяются в неполярных органических растворителях. Жидкие и твёрдые алканы хорошо смешиваются друг с другом. Газообразные и жидкие алканы образуют с воздухом взрывоопасные смеси. Все углеводороды, особенно алканы, являются хорошими изоляторами (диэлектрическая проницаемость равна 2–3). Разветвлённые алканы, а также непредельные и ароматические углеводороды с алкильными группами имеют температуры кипения и плавления ниже, чем соединения нормального строения. Температуры кипения циклоалканов выше, чем у соответствующих алканов[1].
Физические свойства ациклических (алифатических) углеводородов приведены в таблице 5.
| Алканы CnH2n+2 | Алкены CnH2n | Алкадиены CnH2n-2 | Алкины CnH2n-2 |
| В гомологическом ряду алканов с ростом числа атомов углерода возрастают:
-температуры кипения; -температуры плавления; -плотность. Метан, этан, пропан и бутан представляют собой бесцветные газы, не имеющие запаха. Пентан и следующие алканы — бесцветные жидкости с характерным запахом. Алканы с числом атомов углерода более 15 — твёрдые легкоплавкие вещества без запаха. Все алканы практически не растворяются в воде[1]. |
Алкены имеют несколько более низкие температуры плавления и кипения, чем соответствующие алканы. Температуры кипения и плавления закономерно повышаются при увеличении молекулярной массы соединений.
Алкены нормального строения кипят при более высокой температуре, чем их изомеры, имеющие изостроение. Температуры кипения цис-изомеров выше, чем транс-изомеров, а температуры плавления — наоборот. Первые три представителя гомологического ряда алкенов — газы, углеводороды состава от C5Н10 до C16Н32 — жидкости, высшие алкены — твердые вещества. Алкены легче воды, практически нерастворимы в ней, но хорошо растворяются в органических неполярных растворителях. Этилен и пропилен горят коптящим пламенем[3]. |
Первый член гомологического ряда алкадиенов пропадиен (аллен) — бесцветный газ, бутадиен-1,3 — легко сжижающийся газ с неприятным запахом, изопрен — жидкость с температурой кипения 34°С.
Высшие алкадиены ― твёрдые вещества. Алкадиены не растворяются в воде, но хорошо растворяются в неполярных органических растворителях[4]. |
Температуры плавления и кипения алкинов возрастают с увеличением их молекулярной массы.
При нормальных условиях этин, пропин, бутин ― газы. Пентин и следующие алкины ― жидкости. Алкины с числом атомов более 16 ― твёрдые вещества. В Воде алкины растворяются плохо, Хорошо растворяются в органических растворителях[5] |
| Циклоалканы CnH2n | Арены CnH2n-6 | ||
| При обычных условиях циклоалканы закипают и плавятся при более высоких температурах, по сравнению с соответствующими алканами.
С увеличением размера цикла, температуры кипения и плавления растут. Циклопропан и циклобутан — газы, циклопентан и циклогексан — жидкости, циклоалканы с числом атомов более 17 и более — твердые вещества. Растворимость циклических алканов в воде очень низка[6]. |
Бензол и толуол — бесцветные жидкости со специфическим запахом. Они легче воды и в ней практически нерастворимы. Хорошо растворяются в органических растворителях и сами являются хорошими растворителями.
Арены являются бесцветными жидкостями со специфическим запахом, легче воды и нерастворимы в ней, легко растворяются в органических растворителях — спирте, эфире, ацетоне. Бензол и его гомологи сами являются хорошими растворителями для многих органических веществ. Все арены горят коптящим пламенем ввиду высокого содержания углерода в их молекулах. Большинство ароматических углеводородов опасны для жизни, токсичны[7]. | ||
Нахождение в природе
Природный газ, попутный нефтяной газ, нефть, каменный уголь — основные природные источники углеводородов, относятся к горючим ископаемым. При сгорании они способны выделять энергию. По количеству выделившейся энергии в виде света и тепла оценивают количественно их теплотворную способность или удельную теплоту сгорания. Теплотворная способность —количество калорий, выделяемых при сжигании 1 кг топлива. Теплотворная способность природного газа составляет 13 175 ккал/кг, нефти — 10 250 ккал/кг, каменного угля — от 7 750 до 8 100 ккал/кг. Выделяемую энергию можно преобразовывать в электрическую энергию и для проведения промышленных процессов или для обогрева жилых домов[8].
Литература
- Артёменко А.И. Органическая химия. — М.: Высшая школа, 1987. — 430 с.
- Грандберг И.И. Органическая химия. — М.: Дрофа, 2001. — 672 с.
- Травень В.Ф. Органическая химия. — М.: Бином. Лаборатория знаний, 2015. т.1 — 399 с.
Примечания
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 Углеводороды. Большая Российская энциклопедия. Дата обращения: 9 ноября 0203.
- ↑ 2,0 2,1 2,2 Классификация углеводородов. Фоксфорд. Дата обращения: 9 ноября 0202.
- ↑ Физические свойства алкенов. Химия онлайн. Дата обращения: 13 ноября 2023.
- ↑ Алкадиены. Гомологический ряд, строение, номенклатура, физические свойства. Фоксфорд. Дата обращения: 13 ноября 2023.
- ↑ Свойства алкинов. Оргхим.ру. Дата обращения: 13 ноября 2023.
- ↑ Свойства циклоалканов. Оргхим.ру. Дата обращения: 13 ноября 2023.
- ↑ Физические и химические свойства аренов. SolverBook. Дата обращения: 13 ноября 2023.
- ↑ Природные источники углеводородов. Фоксфорд. Дата обращения: 13 ноября 2023.
Данная статья имеет статус «готовой». Это не говорит о качестве статьи, однако в ней уже в достаточной степени раскрыта основная тема. Если вы хотите улучшить статью — правьте смело! |
Данная статья имеет статус «проверенной». Это говорит о том, что статья была проверена экспертом |
- Знание.Вики:Готовые статьи по науке
- Знание.Вики:Готовые статьи по химии
- Знание.Вики:Готовые статьи по алфавиту
- Классы органических соединений
- Органическая химия
- Предельные углеводороды
- Непредельные углеводороды
- Ароматические углеводороды
- Ациклические углеводороды
- Алициклические углеводороды
- Проверенная статья