Ферменты
| Наука | |
| Ферменты греч. ζύμη, ἔνζυμον «закваска» | |
|---|---|
 | |
| Предмет изучения | Функции ферментов |
| Основные направления | Ферменты, Органическая химия, Кислородосодержащие органические соединения, Химия, Номенклатура органических веществ, Биологически активные вещества |
| Вспомогат. дисциплины | Биология, Молекулярная биология, Микробиология |
Ферме́нты (от лат. fermentum «закваска»), или энзи́мы (от греч. «закваска») — белки, влияющие на скорость биохимических реакций в живых организмах. Термин «фермент» был предложен голландским учёным Ван Гельмонтом, для веществ, влияющих на спиртовое брожение[1].
История
Учёных Жана Антуана Реомюра и Ладзаро Спалланцани в XVIII веке заинтересовал химический состав пищеварительных соков. В начале XIX века в 1814 году русский учёный Константин Кирхгоф обнаружил фермент амилазу в вытяжке из проросшего ячменя. Этот фермент амилаза способствовал расщеплению крахмалав сахар. 1814 год стал годом появления ферментологии как науки[2].
Голландским учёным Яном Баптистом ван Гельмонтом в процессе изучения процессов брожения был предложен термин «ферменты» (от лат. fermentum — закваска). Позже было введено понятие «энзим» что в переводе с древнегреческого что означает «в дрожжах». В 1836 году Теодором Шванном в желудочном соке был обнаружен фермент пепсин. В 1857 году Жаном-Никола Корвизаром был описал фермент трипсин, участвующий в переваривании белков. В конце XIX века спор Л. Пастера и Ю. Либиха о природе спиртового брожения привел к разделению терминов: «ферменты» стали обозначать биологические живые организмы, а «энзимы» — неорганические ферменты, такие как пепсин[2].
В середине 1850-х годов XIX века разгорелся спор между крупнейшими учёными мира — Луи Пастером и Ю. Либихом о месте нахождения ферментов в клетке. Этот спор — борьба двух мировоззрений в науке: идеализма и материализма, что привело к замедленному развитию учения о ферментах. Луи Пастер утверждал, что деятельность ферментов зависит от структуры клетки и прекращается с её разрушением. Ю. Либих доказывал, что от структуры клетки действие ферментов не зависит. В 1871 году русский исследователь М. М. Манассеина подтвердила правильность точки зрения Ю. Либиха, доказав, что клеточных сок способен сбраживать крахмал. В 1897 году Э. Бухнером была опубликовала работа «Спиртовое брожение без дрожжевых клеток», с доказательством о том, что спиртовое брожение возможно, так как бесклеточный дрожжевой сок представляет собой неразрушимые дрожжевые клетки. Своей работой Э. Бухнер подтвердил химическую природу ферментов[2].
Однако, как это очень часто бывало в царской России, исследования М. М. Манассеиной остались без внимания и пальма первенства в этом вопросе была отдана немецким ученым братьям Бухнер, которые через 26 лет проделали аналогичный опыт (они разрушали клетки путем высокого давления) и получили такие же результаты. В последующем работами А. Н. Лебедева, И. П. Павлова, М. Дюкло, Э. Фишера, Л. Михаэлиса и многих других ученых окончательно была опровергнута точка зрения идеалистов. Именно материалистический подход в научных исследованиях дал возможность Дж. Самнеру в 1927 г. впервые получить фермент уреазу, а Дж. Нортропу в 1931 г.- кристаллические трипсин и пепсин
В ХХ веке продолжили изучать ферменты такие учёные, как А. Н. Лебедев, И. П. Павлов, М. Дюкло, Э. Фишер, Л. Михаэлис, доказали, что процессы брожения являются химической каталитической реакцией[3].
Строение
По строению ферменты делятся на простые (однокомпонентные) и сложные (двукомпонентные). К простым ферментам относятся ферменты, состоящие только из белковой части, сложный фермент состоит из белковой и небелковой частей. Белковая часть называется апоферментом, а небелковая — кофактором (витамины группы B, Q, H и др.) Кофакторы делят на 2 группы:
- кофермент — связан с апоферментом легко, нековалентно и поэтому может отходить от белковой части на некоторое время;
- простетическая группа — связана с апоферментом ковалентно, жестко.
Участок на поверхности фермента, который взаимодействует с молекулой субстрата — активный центр. В его состав входят аминокислотные последовательности и кофактор (у сложных ферментов). Активный центр построен из 2 частей:
- контактная площадка — «выемка» в теле фермента, которая выполняет несколько функций: контакт с субстратом и его удержание; по своей форме идеально сочетается с субстратом, поэтому обеспечивает специфичность;
- каталитический центр — главная часть энзима, которая обеспечивает катализ (ускорение реакции). Если фермент сложный, то его кофактор является каталитическим участком.
Аллостерический центр есть только у аллостерических ферментов и выполняет регуляторную функцию. К нему могут присоединиться особые вещества — эффекторы (модификаторы), которые делятся на 2 группы: активаторы (ускоряют работу фермента) и ингибиторы (замедляют работу)[4].
Функции ферментов
Основная функция ферментов — преобразование одних веществ в другие (превращение субстратов в продукты). Они выступают катализаторами свыше чем 4,000 биохимических реакций в организме. Функции ферментов заключаются в направлении и регуляции метаболических процессов, они могут ускорять прямую или обратную биохимическую реакцию. Эти реакции обеспечивают распад и окисление питательных веществ, попадающих в клетки. Каждая белковая молекула может выполнять огромное множество действий за короткий промежуток времени. При этом белок ферментов, вступая в реакцию с различными веществами, остается неизменным. Энергия, вырабатываемая в процессе окисления питательных веществ, используется клеткой так же, как и продукты расщепления веществ, необходимые для синтеза органических соединений[5].
Классификация
Классификация предложена Международным союзом биохимии и молекулярной биологии. Каждый класс ферментов содержит подклассы, каждый фермент в классификации имеет код, состоящий из совокупности четырех чисел. Например, трипсин имеет название в ЕС 3.4.21.4. Первое число описывает процесс реакции, катализируемый ферментом:
- Оксидоредуктазы — энзимы, выступающие катализаторами в различных окислительно-восстановительных реакциях, происходящих в клетках. В данный класс входит 22 подкласса.
- Трансферазы — класс ферментов с 9 подклассами. В него входят энзимы, обеспечивающие реакции транспорта между разными субстратами, ферменты, принимающие участие в реакциях взаимопревращения веществ, а также обезвреживания различных органических соединений.
- Гидролазы — энзимы, разрывающие внутримолекулярные связи субстрата посредством присоединения к нему молекул воды. В данном классе насчитывается 13 подклассов. К ним относятся пищеварительные ферменты, такие как:
- амилаза. Она относится к ферментам пищеварения и расщепляет крахмал до олигосахаридов. Амилаза секретируется в железах слюны и поджелудочной железы. Активна в слабощелочной среде.
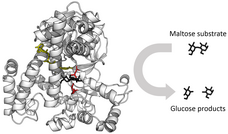
- мальтаза. Пищеварительный фермент мальтаза расщепляет углеводы-мальтозы до глюкозы. Мальтаза синтезируется клетками слизистой оболочки тонкого кишечника. Этот фермент содержится в растениях, бактериях, дрожжах, людях и других позвоночных.
- лактаза. Фермент лактаза расщепляется молочный сахар лактозу, который содержится в молоке и молочных продуктах, до глюкозы и галактозы. Лактаза секретируется и содержится в тонком кишечнике.
- липаза. Липаза отвечает за расщепление жиров и жиросодержащих витаминов А, D, E, K до жирных кислот и липидов. Этот фермент вырабатывается поджелудочной железой и играет ключевую роль в переваривании жирной пищи[6].
- Лиазы — класс, в составе которого находятся только сложные ферменты. В нем насчитывается семь подклассов. Энзимы, относящиеся к данному классу, выступают катализаторами в реакциях разрыва С-О, С-С, С-N и прочих типов органических связей. Также ферменты класса лиазы участвуют в обратимых биохимических реакциях отщепления негидролитическим путем.
- Изомеразы — энзимы, выступающие катализаторами в химических процессах изомерных превращений, происходящих в одной молекуле. Как и к предыдущему классу к ним относятся только сложные ферменты.
- Лигазы (синтетазы) — класс, включающий шесть подклассов и представляющий энзимы, катализирующие процесс соединения двух молекул под воздействием АТФ.
Второе число в наименовании фермента указывает на подкласс, третье — номер подподкласса, четвёртое — порядковый номер фермента в подподклассе[7].
Свойства
Свойства ферментов делятся на 2 группы:
- физические
- химические.
К физическим свойствам ферментов относятся:
- Зависимость активности ферментов от температуры. Чем выше температура, тем быстрее скорость реакции ферментов в организме.
- Ферменты осуществляют трансформацию различных видов энергии.
К химическим свойствам относятся такие, как:
- Зависимость активности ферментов от pH среды. Каждый фермент действует в определённой кислотности среды. Такие ферменты, как амилаза, действуют в слабощелочной среде, а пепсин — в кислой.
- Специфичность действия. Каждый фермент расщепляет только определённую группу питательных веществ — белки, жиры или углеводы.
- Влияние на активность ферментов активаторов и ингибиторов. Действие большинства можно подавить (ингибировать) путём воздействия определёнными химическими реагентами. А также можно увеличить скорость реакций ферментов, то есть активировать различными веществами органической и неорганической природы, которые повышают скорость ферментативных реакций[5].
Литература
- В. В. Пасечник, А. А. Каменский. Биология 8 класс / В. В. Пасечникова. — М.: Просвещение, 2010. — С. 110—128. — 258 с.
- Диксон, М. Ферменты / М. Диксон, Э. Уэбб. — В 3-х т. — Пер. с англ. — Т.1-2. — М.: Мир, 1982. — 808 с.
- Тарханов И. Р.,. Ферменты, в физиологии // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Примечания
- ↑ П. E. Заблудовский. Ван-Гельмонт Йоханнес Баптист // Большая Медицинская Энциклопедия : статья. — Т. 4.
- ↑ 2,0 2,1 2,2 Краткая история учения о ферментах. Библиотека по химии. Дата обращения: 4 июня 2024.
- ↑ Краткая история учения о ферментах [1974 Ермолаев М.В. - Биологическая химия] // статья : сайт.
- ↑ Строение ферментов — Студопедия (31 декабря 2013). Дата обращения: 27 мая 2024.
- ↑ 5,0 5,1 Ферменты (28 апреля 2019). Дата обращения: 26 мая 2024.
- ↑ Алексеева Е.Л., Баранов А.А., Дубровская М.И., Дж. Нью, Шабалов Н.П., Buckley R.H., Boxer L.A., Gedalia А., Miller M.R., Montgomery R.K., Johnston Jr. R.B. Механизмы переваривания и всасывания жиров (липидов) (18 марта 2021). Дата обращения: 24 мая 2024.
- ↑ Chemistry - Queen Mary University of London (англ.). Дата обращения: 2024—05—26.