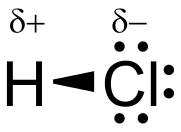
Кислоты
| Серная кислота | |
|---|---|
 | |
| Общие | |
| Систематическое наименование |
тетраоксосульфат (VI) водорода |
| Хим. формула | H2SO4 |
| Внешний вид | маслянистая жидкость, без ярко выраженного цвета и запаха, не содержащая взвешенных частиц |
| Физические свойства | |
| Молярная масса | 98,079 г/моль |
| Плотность | 1,8356 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 10,4 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | растворима |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Кисло́ты — класс сложных неорганических веществ, при электролитической диссоциации которых в качестве катионов образуются только катионы водорода. Имеют общую формулу: Hn Ac, где n — количество атомов водорода Н, Ac — анион кислотного остатка (SO32-, SO42-, NO3- и другие). Атомы в молекулах кислот связаны ковалентной полярной связью. Данный класс неорганических химических соединений способен выделять протоны в растворе, образуя при этом положительные ионы (или катионы) и химически взаимодействовать с основаниями. Кислоты участвуют в химических реакциях и процессах нейтрализации, окисления, восстановления. Применяются в качестве катализаторов в химической промышленности, как сырьё в бытовой химии. Кислоты используют в сельском хозяйстве, энергетике и медицине[1].
История открытия
История возникновения кислот связана с длительным процессом исследований и открытий в области химии, который привел к более глубокому пониманию их свойств, структуры и применения. Еще античным грекам и египтянам была известна серная кислота. Они не имели представления о кислоте, но уже применяли ее в различных аспектах своей жизни[2].
В XVII—XVIII веках, со становлением химии как науки, а также с развитием теории флогистона, кислоты начал изучаться более систематически. Например, химики Роберт Бойль и Генри Кавендиш проводили исследования с уксусной и серной кислотами.
В XVIII—XIX веках, Йёнс Якоб Берцелиус выдвинул теорию о существовании кислот в химических соединениях. Он предложил классификацию кислот на основе их химической структуры и свойств.
В XIX—XX веках, с развитием химической промышленности, кислоты стали получать искусственным путем для различных целей: в медицине, пищевой промышленности, производстве материалов и для разработки технологий[2].
Определение кислоты в теории ученых
Понятие «кислота» в химии трактуется по-разному в зависимости от принятой теории. Рассмотрим три наиболее распространенных подхода к трактованию.
Теория Брёнстеда-Лоури
Кислота — это донор протона, то есть вещество, способное отдавать водородный ион. Соответственно, основание представляет собой акцептор протона — вещество, которое может присоединить водородный ион. При взаимодействии кислоты с основанием происходит обмен протоном. Образуется сопряженная кислота и сопряженное основание. Заряд сопряженной кислоты всегда на единицу меньше, чем заряд сопряженного основания[3].
Теория Льюиса
В 1923 году Льюис Гилберт Ньютон расширил понятие кислоты. Он определил ее как акцептор электронной пары, то есть вещество, способное присоединить к себе пару электронов от другого вещества, образуя ковалентную связь. Такое вещество является электрофилом. Теория Льюиса охватывает более широкий спектр веществ, чем теория Брёнстеда-Лоури[4].
Теория Усановича
Михаил Ильич Усанович предложил более широкую и обобщенную теорию кислотности, включающую в себя как протоны, так и другие частицы. Согласно данной теории, кислота — вещество-донор, способное отдавать катионы (включая протоны) в химических реакциях[5].
Классификация
По наличию атомов кислорода различают:
- кислородосодержащие (например, метакремниевая кислота );
- бескислородные (вещества, в которых водород соединён с неметаллическим элементом, например, сероводородная кислота ).
По количеству содержащихся катионов водорода (H+):
- одноосновные (содержат один катион водорода, например, соляная кислота ;
- многоосновные (содержат два и более катионов водорода, например, серная кислота ).
По силе (степени диссоциации):
- сильные имеют большое содержание катионов водорода, например, азотная кислота ;
- слабые (имеют наименьшее содержание катионов водорода, например, сернистая кислота .
По летучести (способность переходить в газообразное состояние):
- летучие (например, бромоводородная кислота );
- нелетучие (например, ортофосфорная кислота ).
По растворимости в воде:
- растворимые (например, соляная кислота );
- нерастворимые (например, кремниевая кислота ).
По принадлежности к классам химических соединений:
- органические (например, лимонная кислота );
- неорганические или минеральные (например, азотистая кислота ).
По устойчивости:
- устойчивые (не распадаются при реакции на составные элементы, например, серная кислота );
- неустойчивые (не существуют в свободном виде, распадаются на газ и воду, например, угольная кислота Невозможно разобрать выражение (SVG с запасным PNG (MathML можно включить с помощью плагина для браузера): Недопустимый ответ («Math extension cannot connect to Restbase.») от сервера «https://wikimedia.org/api/rest_v1/»:): {\displaystyle \ce{H2CO3}} ).
По содержанию атомов металла:
- металлосодержащие (например, марганцевая кислота );
- не металлосодержащие (например, сероводородная кислота )[6].
Свойства кислот
Физические свойства
По агрегатному состоянию различают твердые (например, ортофосфорная кислота ) и жидкие кислоты (например, серная кислота ).
По запаху кислоты обладают резким и раздражающим запахом (например, сероводородная кислота ).
По окраске — бесцветные (например, азотная кислота ) и имеющие цвет (например, хромовая кислота ).
По растворимости в воде — растворимые (например, азотная кислота ), малорастворимые (например, борная кислота ), нерастворимые (например, кремниевая кислота ).
По способности проводить ток:
- высокая (например, серная кислота );
- низкая (например, уксусная кислота )[7].
Химические свойства
Взаимодействие с индикаторами
Кислоты способны изменить окраску индикаторов. С помощью этого свойства можно отличить кислую среду от щелочной или нейтральной.

Индикаторы представляют собой вещества, способные изменить свой цвет под воздействием определенных веществ[6].
Для идентификации кислоты используют индикаторы:
Цвет индикатора в различных средах меняется.
- в кислой среде — красный,
- в нейтральной среде — фиолетовым,
- в щелочной — синий.
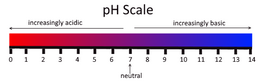
- в кислой и нейтральной среде — обесцвечивается,
- в щелочной становится — малиновый.
- в кислой среде — красный,
- в нейтральной среде — оранжевый,
- в щелочной среде — желтый.
Химические свойства кислот можно разделить на две группы: общие (для всех кислот), и специфические (характерные для определенных кислот)[8].
Общие свойства
1. Взаимодействие с металлами: ↑ с выделением водорода.
2. Взаимодействие с основными и амфотерными оксидами: 3. Взаимодействие с солями: с выпадением осадка BaSO4 .
4. Взаимодействие с основаниями и амфотерными гидроксидами: .
5. Разложение на составляющие элементы:
- при нагревании: ;l
- без нагревания: .
6. Взаимодействие с щёлочью: .
7. Реакция вытеснения более слабых кислот из их солей: с выделением газа СО2.
8. Взаимодействие с нерастворимыми основаниями: [6].
Специфические свойства
1. Кислородосодержащие кислоты[6]:
- взаимодействие с металлами: реагируют лишь с теми металлами, что стоят в ряду активности до кислорода: .
- взаимодействие с основными и амфотерными оксидами: .
- взаимодействие с основаниями и с амфотерными гидроксидами: .
- взаимодействие с солями: с выпадением осадка.
- разложение с образованием кислотного оксида и воды: реакция под воздействием высоких температур[6].
2. Бескислородные кислоты:
- В водных растворах подвергаются электролитической диссоциации, распадаются на ионы: HCl = H+ + Cl-
- Могут проявлять восстановительные свойства: [7].
Способы получения
Кислоты можно получить двумя способами: лабораторным и промышленным.
Лабораторный способ
- Взаимодействие оксида неметалла с водой: .
- Взаимодействие галогеноводородов с оксидами неметаллов: SiO2 + HF → SiF4 + H2O[9].
Промышленный способ
- Получение серной кислоты: на первой стадии обжигом железного колчедана (пирита) получают оксид серы (IV) SO2, затем окисляют оксид серы (IV) SO2 до оксида серы (VI) SO3, абсорбцией оксида серы (VI) SO3 получают серную кислоту H2SO4[10].
- Синтез аммиака: [9].
Применение
Кислоты широко применяются в самых разных сферах человеческой жизни[11].
Промышленность
- Производство удобрений: ортофосфорная () и азотная () кислоты используются для получения удобрений, необходимых для роста растений.
- Производство химикатов: серная (), азотная () и соляная () кислоты являются важными компонентами синтеза различных химических веществ, включая пластмассы, красители, взрывчатые вещества и лекарства.
- Обработка металлов: кислоты используются для очистки металлических поверхностей от оксидных пленок и для электрохимической обработки металлов.
- Производство синтетических материалов: широко применяются в производстве синтетических волокон, полимеров и смол.
- Фармацевтическая промышленность: используются для синтеза лекарственных препаратов, например, аспирина.
- Производство батарей: серная кислота () является электролитом в свинцово-кислотных аккумуляторах[11][12].
Биология и медицина
- Регуляция pH: неорганические кислоты используются в буферных растворах для поддержания определенного pH, что является ключевым аспектом для биологических исследований и медицинских процедур.
- Дезинфекция: соляная кислота () и азотная кислота () обладают антибактериальными свойствами и используются для дезинфекции поверхностей и инструментов.
- Лекарства: некоторые неорганические кислоты, например, соляная кислота (), используется в составе лекарств для лечения заболеваний желудка[11][12].
Другие области:
- Кормление животных: фосфорная кислота () может добавляться в корма для улучшения пищеварения и роста животных.
- Экология: серная () и соляная () кислоты применяются для очистки сточных вод и утилизации отходов[12][11].
Токсичность и меры предосторожности
Кислоты могут быть очень опасными, при неправильном обращении с ними. Уровень опасности зависит от их концентрации, типа кислоты и условий окружающей среды.
Основные риски
- Кислоты могут разъедать различные ткани, металлы (коррозия) и другие материалы.
- Могут вызывать химические ожоги при контакте с концентрированными кислотами — например, серная кислота может вызвать серьезные химические ожоги кожи, которые могут привести к рубцам, инвалидности или даже смерти.
- Токсичность: некоторые кислоты, например, соляная , азотная и ортофосфорная — токсичны и могут вызывать отравление при вдыхании и проглатывании.
- Некоторые кислоты могут реагировать с другими веществами, вызывая взрывы с выделением токсичных газов или образованием опасных соединений[7].
Меры предосторожности при работе с кислотами
1. Всегда используйте средства индивидуальной защиты (СИЗ):
- очки: защищают глаза от брызг кислот;
- перчатки защищают кожу от контакта с кислотами;
- костюм: защищает одежду от кислотных брызг;
- респиратор: защищает органы дыхания от вдыхания ядовитых паров.
2. Работайте в хорошо вентилируемом помещении: кислоты могут выделять токсичные пары, поэтому очень важно работать в пространстве с хорошей вентиляцией.
3. Никогда не смешивайте кислоты с другими веществами, не зная итога реакции (некоторые кислоты могут реагировать бурно).
4. Храните кислоты в герметичных специальных емкостях с маркировкой[13].
Действия в экстренной ситуации
- В случае разлива: немедленно удалите разлитую кислоту с помощью специальных материалов (например, нейтрализующего раствора или абсорбента).
- В случае контакта с кислотой немедленно промойте пораженный участок большим количеством воды в течение нескольких минут и обратитесь к врачу.
- При возникновении ожога немедленно обратитесь за помощью в медицинское учреждение.
- Никогда не пробуйте кислоты на вкус, это может быть смертельно.
- Храните кислоты в темном помещении, недоступном для детей месте[13].
См. также
Литература
- Аболонин Б. Е.,Кузнецова И. М., Харлампиди Х. Э. Основы химических производств:учеб. пособие/ Б. Е. Аболонин, И. М. Кузнецова, Х. Э. Харлампиди.—М.: Химия,2001, ISBN 5-7245-1052-9.-472.-Библиогр.: 471 с.
- Ахметов Т.Г., Бусыгин В.М., Гайсин Л.Г., Ахметова Р.Т. Химическая технология неорганических веществ: Учебное пособие / под ред. Т. Г. Ахметова. — 2-е изд., стер. — СПб.: М.: Издательство «Лань», 2019 — 452 с.
- Земирова О.Н. Краткий курс истории и методологии химии / под ред.акад. Лунина В.В. — М.: Анабасис, 2007. — 140 с.
- Пуховская С.Г., Н.А. Фомина, А.С. Вашурин, Е.В. Румянцев, М.Г. Киселев Общая химия: учеб. пособие / [С.Г. Пуховская, и др.]; Иван. гос. хим. – технол. ун-т. – Иваново, 2017 – 162 с.
- Соловьёва Г. В., О. А. Неволина, Т. С. Берсенёва, И. А. Мустаева Общая химия. Базовый уровень = General chemistry. Basic level: О-28 учеб. пособие; англ. Перевод Т. С. Берсенёвой. – Екатеринбург: Изд-во Урал. ун-та, 2017 – 182 с.
- Хомченко Г. П. Пособие по химии для поступающих в вузы.— 4-е изд., испр. и доп. — М.: ООО «Издательство Новая Волна»: Издатель Умеренков, 2002.— С. 131. — 480 с.
Данная статья имеет статус «готовой». Это не говорит о качестве статьи, однако в ней уже в достаточной степени раскрыта основная тема. Если вы хотите улучшить статью — правьте смело! |
Примечания
- ↑ Кислоты. Большая Российская энциклопедия. Дата обращения: 27 мая 2024.
- ↑ 2,0 2,1 Левченков С.И. Краткий очерк истории химии. — Наука.
- ↑ Протолитическая теория Бренстеда — Лоури // Студопедия : сайт. — 21 января.
- ↑ Врецена Наталия Богдановна. Кислоты и основания Льюиса // spravochnick.ru : сайт. — 2024. — 27 апреля.
- ↑ К.М. Кусанина. Ни кислот, ни оснований // Журнал общей химии : журнал. — С. с.40 - 44.
- ↑ 6,0 6,1 6,2 6,3 6,4 Кислоты — классификация, свойства, получение и применение.. In-chemistry (2024). Дата обращения: 2 июня 2024.
- ↑ 7,0 7,1 7,2 Свойства кислот. Справочник. Химия. Дата обращения: 2 июня 2024.
- ↑ Химические свойства кислот. ЯКласс. Дата обращения: 3 июня 2024.
- ↑ 9,0 9,1 Кислоты. Химические свойства и способы получения. Подготовка к ЕГЭ, ОГЭ и олимпиадам. Дата обращения: 2 июня 2024.
- ↑ Серная кислота. Большая Российская энциклопедия. Дата обращения: 2 июня 2024.
- ↑ 11,0 11,1 11,2 11,3 Применение кислот. ЯКласс. Дата обращения: 3 июня 2024.
- ↑ 12,0 12,1 12,2 Состав и общие свойства кислот. Библиотека InternetUrok.ru. Дата обращения: 3 июня 2024.
- ↑ 13,0 13,1 Техника безопасности при работе с кислотами и щелочами. Правила и меры безопасности. Дата обращения: 3 июня 2024.
Данная статья имеет статус «проверенной». Это говорит о том, что статья была проверена экспертом |