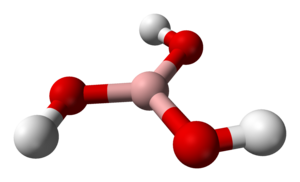
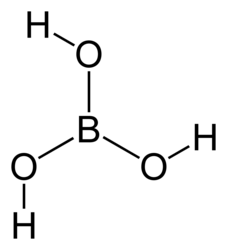
Борная кислота
| Борная кислота | |
|---|---|
 Химическая формула борной кислоты Химическая формула борной кислоты Кристаллы борной кислоты Кристаллы борной кислоты | |
 Пачка борной кислоты в лекарственной форме из сундука корабельного врача начала XX века, поднятая с затонувшего траулера Пачка борной кислоты в лекарственной форме из сундука корабельного врача начала XX века, поднятая с затонувшего траулера | |
| Общие | |
| Систематическое наименование |
Ортоборная кислота |
| Хим. формула | H3BO3 |
| Рац. формула | B(OH)3 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 61,83 г/моль |
| Плотность | 1,435 (+15 °C) г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 170,9 °C, 444 K, 340 °F |
| • кипения | (573 K, 572 °F) 300 °C |
| Химические свойства | |
| Константа диссоциации кислоты | 9,24 (I), 12,74 (II), 13,80 (III) |
| Растворимость | |
| • в воде |
2,52 (0 °C) |
| Классификация | |
| Рег. номер CAS | 10043-35-3 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Бо́рная кислота́ (лат. acidum Boricum, о́ртобо́рная кислота́, H3BO3) — слабая неорганическая кислородсодержащая кислота с молекулярной формулой H3BO3, впервые синтетически полученная в лабораторных условиях в 1702 году[1].
Данное химическое соединение характеризуется уникальной кристаллической структурой и демонстрирует широкий спектр физико-химических свойств, обусловливающих его многоцелевое применение в различных отраслях науки и промышленности.
Исторические аспекты открытия и научного познания
Первые синтетические исследования XVII–XVIII веков
Систематическое изучение борной кислоты берёт начало в эпоху становления экспериментальной химии. Немецкий исследователь Вильгельм Хомберг осуществил первый лабораторный синтез этого соединения путём термической обработки минерала буры с железным купоросом с последующей многократной очисткой методом сублимации. Полученное вещество получило наименование «летучая седативная купоросная соль» вследствие обнаруженных успокоительных свойств[1].
Этимологическое закрепление термина boracic acid в научной номенклатуре произошло в конце XVIII столетия[2]. Исторические свидетельства указывают на использование боратсодержащих соединений в древнегреческой цивилизации для технологических процессов очистки и консервирования пищевых продуктов[3].
Становление научной номенклатуры
Терминологическая систематизация борной кислоты осуществлялась в рамках революционных преобразований химической номенклатуры. Антуан Лавуазье совместно с Гитоном де Морво ввели официальное наименование acide borique в контексте разработки систематической химической терминологии[1]. Это нововведение отражало понимание химического родства данного соединения с натрийсодержащими боратными минералами.
Эпоха элементного анализа и структурных открытий
Научное установление молекулярного состава борной кислоты произошло в 1808 году в результате фундаментальных исследований по выделению элемента бора[4]. Гемфри Дэви параллельно с французскими химиками Жозефом Луи Гей-Люссаком и Луи Жаком Тенаром независимо определили элементный состав соединения.
Последующие экспериментальные работы 1811 года продемонстрировали возможность синтеза борной кислоты непосредственно из элементарного бора через окислительные процессы с последующей гидратацией образующегося оксида[1].
Геологические открытия природных источников
Минералогические исследования XVIII века выявили естественное распространение борной кислоты в геотермальных системах. Хуберт Франц Хофер обнаружил присутствие соединения в термальных водах тосканского региона в 1778 году. Минералогическая характеристика кристаллических форм борной кислоты была систематизирована Паоло Масканьи, описавшим минерал сассолин в 1799 году.
Промышленное освоение природных месторождений инициировал Франсуа де Лардерель, основавший первое производственное предприятие по извлечению борной кислоты из тосканских геотермальных источников в 1818 году[1].
Фундаментальные физико-химические характеристики
Основные константы и термодинамические параметры
Молекулярная архитектура борной кислоты характеризуется тригональной планарной геометрией с межатомными расстояниями B–O 136 пикометров и O–H 97 пикометров[1]. Кристаллографическая симметрия соединения соответствует точечной группе C3h.
Термодинамические параметры включают молекулярную массу 61,83 г/моль, плотность 1,435 г/см3 при температуре 15 °C. Фазовые переходы происходят при температуре плавления 170,9 °C и температуре кипения 300 °C. Данные характеристики определяют технологические параметры промышленной переработки и лабораторного использования соединения.
Растворимость и диссоциативные равновесия
Растворимость борной кислоты в водных системах демонстрирует выраженную температурную зависимость, возрастая от 2,52 г/100 мл при 0 °C до 27,53 г/100 мл при 100 °C. Кислотно-основные свойства характеризуются ступенчатыми константами диссоциации: pKa1 = 9,24, pKa2 = 12,74, pKa3 = 13,80.
Химическое равновесие в водных растворах описывается уравнением B(OH)3 + H2O ⇌ [B(OH)4]- + H+ с константой ионизации Ka = 7,3×10-10. Данная закономерность определяет слабокислотные свойства соединения и его буферную способность в физиологических системах[5].
Молекулярное строение и кристаллографические модификации
Полиморфизм кристаллических структур
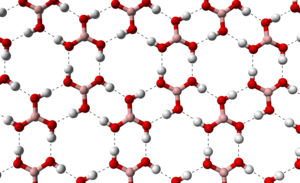
Кристаллографические исследования выявили существование двух полиморфных модификаций борной кислоты: триклинной и тригональной[6]. Триклинная форма характеризуется большей термодинамической стабильностью в стандартных условиях, тогда как тригональная модификация может быть получена специализированными методами кристаллизации.
Слоистая архитектура кристаллической решётки обусловлена формированием водородных связей между молекулами B(OH)3 в планарных слоях с межмолекулярными расстояниями 272 пикометра. Межслоевые взаимодействия характеризуются расстоянием 318 пикометров.
Параметры элементарной ячейки
Кристаллографические параметры триклинной модификации включают постоянные решётки a = 701,87 пм, b = 703,5 пм, c = 634,72 пм с углами α = 92,49°, β = 101,46°, γ = 119,76°. Тригональная форма характеризуется параметром a = 956,08 пм. Пространственные группы симметрии соответствуют P1 для триклинной и P32 для тригональной модификаций[7].
Морфологические характеристики включают образование бесцветных чешуйчатых кристаллов без характерного запаха, что обусловливает специфические требования к методам идентификации и количественного анализа. Детальные рентгеноструктурные исследования при 105 K показали, что электронная плотность в кристаллах борной кислоты распределена неравномерно, с максимальными значениями в областях локализации атомов бора и кислорода. Данная особенность электронного строения определяет специфические оптические и электрические свойства кристаллических модификаций.
Химические свойства и реакционная способность
Кислотно-основные характеристики
Борная кислота проявляет свойства трёхосновной кислоты Льюиса, механизм ионизации которой основан на присоединении гидроксильных анионов к атому бора. Данная особенность отличает её от классических протолитических кислот и обусловливает специфические химические свойства.
Синергетическое усиление кислотности наблюдается в присутствии цис-вицинальных диолов, таких как маннитол. Комплексообразование с данными соединениями приводит к снижению pKa с 9 до значений менее 4, что расширяет аналитические возможности титриметрических методов определения[2].
Термические превращения и разложение
Термодинамика дегидратационных процессов характеризуется ступенчатым удалением молекул воды. Первичное превращение при 107,5 °C приводит к образованию метаборной кислоты HBO2. Дальнейшее нагревание до 150 °C обусловливает формирование тетраборной кислоты H2B4O7. Полная дегидратация до борного ангидрида B2O3 происходит при температуре около 530 °C[1].
Данные превращения имеют фундаментальное значение для технологических процессов получения различных боратных соединений и контроля качества промышленных продуктов.
Комплексообразование и эстерификация
Взаимодействие с алифатическими спиртами в присутствии дегидратирующих агентов приводит к образованию боратных эфиров общей формулы B(OR)3. Наиболее характерной качественной реакцией является синтез борнометилового эфира B(OCH3)3, сгорающего характерным зелёным пламенем[7].
Аналитическое применение комплексообразующих свойств реализуется в потенциометрических методах определения боратного содержания водных систем, включая мониторинг ядерных реакторных контуров.
Методы получения и промышленный синтез
Классические способы синтеза
Фундаментальные синтетические подходы включают гидролитические превращения борсодержащих соединений. Реакция диборана с водой протекает по уравнению:
Аналогичные процессы характерны для тригалогенидов бора:
Промышленно значимый метод основан на обработке тетрабората натрия минеральными кислотами:
Данный процесс обеспечивает высокую степень чистоты продукта при экономически эффективных условиях. Бура как исходное сырьё представляет собой природный минерал, который может растворяться в воде с образованием высококонцентрированных растворов при смешивании с борной кислотой в весовом соотношении 4:5, что значительно превышает растворимость отдельных компонентов и имеет важное технологическое значение для получения концентрированных боратных растворов[2].
Современные промышленные технологии
Современное промышленное производство ориентировано на получение моноволоконного стекловолокна для композитных материалов. Электрохимические применения включают составление гальванических электролитов в оптимальных соотношениях с сульфатом никеля.
Металлургические технологии используют борную кислоту в качестве компонента набивочных масс для футеровки индукционных печей, обеспечивающих термостойкость и химическую инертность огнеупорных материалов[8].
Природные источники и минералогические аспекты
Геотермальные месторождения
Естественное распространение борной кислоты связано с геотермальными процессами и гидротермальной активностью. Минералогическая форма представлена сассолином, встречающимся в горячих источниках и минерализованных водах вулканических регионов[9].
Концентрационные характеристики морских экосистем составляют приблизительно 4×10-4 М по содержанию бора, что обусловливает участие соединения в глобальных геохимических циклах.
Роль в геохимических процессах
Акустические свойства морских систем частично определяются присутствием борной кислоты и боратных ионов, обеспечивающих поглощение звуковых волн в низкочастотном диапазоне 0,2–10 кГц. Высокочастотное поглощение в диапазоне 10–1000 кГц реализуется синергетически с сульфатом магния[9].
Токсикологические характеристики и безопасность
Острая токсичность и летальные дозы
Токсикологические параметры борной кислоты характеризуются выраженной видоспецифичностью и возрастной зависимостью. Смертельные дозы для взрослого человека составляют 15–20 г, для детского организма — 4–5 г[10]. Экспериментальные данные на лабораторных животных указывают на медианную летальную дозу LD50 2660 мг/кг при пероральном введении.
Минимальные летальные концентрации демонстрируют возрастную градацию: 2–3 г для младенцев, 5–6 г для детей, 15–20 г для взрослых индивидуумов[10]. Данные характеристики определяют требования к безопасному обращению и хранению соединения. Клинические наблюдения за 784 случаями отравления борной кислотой в дозах от 10 до 88 г не выявили смертельных исходов, при этом 88 % пострадавших не проявили симптомов интоксикации, что свидетельствует об относительно низкой острой токсичности соединения при случайных воздействиях.
Репродуктивная токсичность и регуляторные ограничения
Регуляторные ограничения в отношении борной кислоты основаны на данных о репродуктивной токсичности. Министерство здравоохранения СССР официально запретило использование соединения для детей, беременных и кормящих женщин 2 февраля 1987 года[11].
Европейская система классификации химических веществ относит борную кислоту к репротоксикантам категории 2 с 2008 года. Данная классификация основана на экспериментальных данных о тератогенных эффектах и нарушениях фертильности при хроническом воздействии.
Медицинские применения и терапевтические свойства
Антисептические и противомикробные эффекты
Медицинское использование борной кислоты имеет полуторавековую историю, начиная с 1860-х годов в качестве антисептического средства. Спиртовые растворы различных концентраций (0,5 %, 1 %, 2 %, 3 %, 5 %) на основе 70 % этанола применяются для наружной обработки кожных покровов[12].
Специализированные применения включают вагинальные суппозитории для терапии кандидозных инфекций, резистентных к стандартным противогрибковым препаратам. Дерматологические показания охватывают лечение акне благодаря антибактериальным свойствам соединения.
Офтальмологические и отоларингологические применения
Профилактические протоколы включают предотвращение грибковых поражений стоп путём применения порошкообразных препаратов. Отоларингологическая практика использует борную кислоту для лечения наружного отита различной этиологии.
Лабораторно-диагностические применения включают использование в качестве консерванта биологических образцов мочи в клинической практике. Экстренная медицина применяет 2 %-ные растворы для нейтрализации щелочных ожогов кожных покровов[13].
Промышленные применения и технологические решения
Стекольная и керамическая промышленность
Производство керамических изделий и стекловолоконных материалов составляет основной сектор промышленного потребления борной кислоты. Технология изготовления LCD-дисплеев использует боратные стёкла с оптимизированными оптическими характеристиками[14].
Ювелирные технологии применяют борную кислоту в комбинации с денатурированным этанолом для предотвращения поверхностного окисления благородных металлов в процессах термической обработки. Текстильное стекловолокно, изготавливаемое с использованием борной кислоты, служит армирующим компонентом в широком спектре пластиковых композитов — от судостроительных материалов до промышленных трубопроводов и печатных плат компьютерной техники, что определяет стратегическое значение борной кислоты в современной материаловедческой индустрии.
Металлургические процессы и гальванотехника
Паяльные флюсы на основе борной кислоты и буры в эквимолярных соотношениях обеспечивают эффективное удаление оксидных плёнок при высокотемпературной пайке. Электротехнические применения включают использование в качестве деионизирующего агента в плавких предохранителях.
Трибологические свойства борной кислоты характеризуются коэффициентами скольжения от 0,10 до 0,02 в зависимости от приложенного давления[15], что обусловливает применение в специализированных смазочных композициях.
Химическая промышленность и материаловедение
Полимерная промышленность использует борную кислоту в производстве тиксотропных материалов типа Silly Putty в комбинации с поливиниловым спиртом или силиконовыми маслами[16]. Нефтегазовые технологии включают применение в гидравлическом разрыве пласта в качестве кроссшивающего агента для гуаровых камедей.
Специализированные области применения
Ядерная энергетика и нейтронная физика
Нейтронно-поглощающие свойства борной кислоты обусловлены высоким сечением захвата тепловых нейтронов изотопом бор-10. Реакторные технологии используют растворы соединения в первичном контуре для регулирования реактивности и аварийного останова реакторных установок.
Бассейны выдержки отработавшего ядерного топлива содержат борную кислоту в концентрациях, обеспечивающих подкритичность нейтронного размножения. Буферные системы плавательных бассейнов используют борную кислоту в концентрации 50–100 ppm боровых эквивалентов[14].
Биоцидные технологии и защита материалов
Инсектицидные свойства борной кислоты реализуются через метаболические нарушения в организме членистоногих, классифицируемые группой IRAC 8D. Эффективность против синантропных насекомых включает контроль популяций тараканов, муравьёв и других вредителей.
Деревозащитные технологии основаны на антитермитных свойствах и способности предотвращать развитие грибковых поражений древесины. Огнезащитная пропитка в комбинации с бурой в соотношении 4:5 обеспечивает снижение горючести древесных материалов[17].
Аналитическая химия и лабораторные применения
Буферные системы на основе борной кислоты обеспечивают стабилизацию pH в широком диапазоне аналитических процедур. Люминесцентные свойства боратных комплексов используются в методах детекции и количественного определения различных аналитов.
Борная кислота в равновесии с сопряжённым основанием — боратным ионом — широко применяется в концентрационном диапазоне 50–100 ppm боровых эквивалентов как первичная или вспомогательная pH-буферная система в плавательных бассейнах. Как слабая кислота с pKa 9,24 в чистой воде при 25 °C, она особенно эффективна против повышения pH, что демонстрируется соответствующими графиками буферной ёмкости.
Видимый pKa существенно снижается в водах плавательных бассейнов или океанской воде из-за взаимодействий с различными молекулами в растворе, составляя около 9,0 в солёной воде бассейна. Независимо от формы растворимого бора, в допустимом диапазоне pH и концентрации бора для плавательных бассейнов борная кислота является преобладающей формой в водном растворе.
Регламентированное использование в качестве пищевой добавки E284 ограничено специфическими технологическими процессами[18]. Спортивные применения включают смазку игровых поверхностей для карром и новусс, обеспечивающую оптимальные фрикционные характеристики.
Агрохимия и пиротехника
Агрохимические применения охватывают коррекцию борного дефицита растений и консервирование зерновых культур, включая рис и пшеницу. Микроэлементное питание растений требует точного дозирования борсодержащих удобрений для предотвращения токсических эффектов.
Пиротехнические композиции используют борную кислоту для предотвращения нежелательных химических реакций между алюминием и нитратными окислителями. Колористические эффекты зелёного пламени реализуются при растворении борной кислоты в метаноле для специальных пиротехнических представлений[7].
Литература
- ГОСТ 18704-78. Кислота борная. Технические условия // Федеральное агентство по техническому регулированию и метрологии.
- Коттон Ф., Уилкинсон Дж. Основы неорганической химии / пер. с англ.. — М.: Мир, 1979. — 680 с.
- Третьяков Ю.Д. Неорганическая химия. в 3 т. — М.: Академия, 2004. — Т. 2. — 368 с.
- Угай Я.А. Общая и неорганическая химия : учебник. — М.: Высш. шк., 2007. — 526 с.
- ФС.2.2.0002.15 Борная кислота // Государственная фармакопея Российской Федерации. XIV издание.
Примечания
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 Препараты бора в психиатрии и неврологии: их взлёт, падение и возобновление интереса // Acta biomedica scientifica. — 2018. — Т. 3, № 4.
- ↑ 2,0 2,1 2,2 Бор: факты и фактики // Химия и Жизнь. — 2017. — № 7.
- ↑ Гей-Люссак, Жозеф Луи // Большая российская энциклопедия.
- ↑ Синтез пентабората аммония. Кристаллическая структура и ИК-спектры поглощения NH₄[B₅O₆(OH)₄·2H₂O] // Башкирский химический журнал. — 2012. — Т. 19, № 3.
- ↑ Третьяков Ю.Д. Неорганическая химия. — М.: Академия, 2004. — Т. 2. — 368 с.
- ↑ ФС.2.2.0002.15 Борная кислота // Государственная фармакопея Российской Федерации.
- ↑ 7,0 7,1 7,2 Окрашивание пламени соединениями бора // HimikaTUS.
- ↑ Футоревка тиглей индукционных печей // Чёрная и цветная металлургия.
- ↑ 9,0 9,1 Коттон Ф., Уилкинсон Дж. Основы неорганической химии / пер. с англ. — М.: Мир, 1979. — 680 с.
- ↑ 10,0 10,1 Прозоровский В. Коварная борная кислота // Наука и жизнь. — 2003. — № 11.
- ↑ Is Boric Acid Toxic to Reproduction in Humans? Assessment of the Animal Reproductive Toxicity Data and Epidemiological Study Results // PubMed. — PMID 26511087.
- ↑ Лечебное действие неорганических соединений бора // Международный студенческий научный вестник. — 2016. — № 3–3.
- ↑ Особенности изготовления глазных капель и примочек с борной кислотой // Молодёжный инновационный вестник. — 2018. — Т. 7, № 2.
- ↑ 14,0 14,1 БОРНАЯ КИСЛОТА (en (англ. )) // Ataman Kimya.
- ↑ Комплексы аминоэфиров борной кислоты в качестве модификаторов полидиметилсилоксанов // Журнал прикладной химии. — 2013. — Т. 86, № 11.
- ↑ Гринвуд Н., Эрншо А. Химия элементов. — М.: БИНОМ. Лаборатория знаний, 2008. — Т. 1. — 607 с.
- ↑ Огне- и биозащита древесины // АРТконсервация.
- ↑ Бор (В) – значение для организма и здоровья + 25 источников // Colloquium-Journal. — 2021. — № 9.
Ссылки
- Большая норвежская
- Большая российская (старая версия)
- Britannica (онлайн)