Термодинамика
Термодина́мика (от греч. thermos — теплый, dynamos — сила) — теория тепловых процессов, не учитывающая молекулярное строение тел. Занимается законами, связанным с процессами тепла и энергии различных систем. На ее основе построено понимание многих явлений, начиная от движений атома и молекулы, заканчивая работой мощного теплового агрегата[1].
Эволюция термодинамики: от интуиции до научного основания
Первый важный шаг в понимании тепловых процессов был сделан с появлением термометра, который, по легенде, был придуман Галилео в конце XVI века. Хотя ранние версии термометров были примитивными, они стали отправной точкой для более точных измерений и совершенствования научных исследований.
В XVIII веке значительные достижения в области термометрии привели к созданию стандартизированных температурных шкал. Особенно интересно, что в 1744 году академик Ричман исследовал различие между понятиями тепла и температуры, проводя эксперименты для измерения теплопроводности различных материалов.
Термодинамика стала научной областью, ориентированной на превращение внутренней энергии в механическую работу. Промышленная революция, порожденная изобретением паровых двигателей во второй половине XVIII века, способствовала стремлению к повышению эффективности этих двигателей.
Исследования по адиабатическому расширению и сжатию были проведены выдающимися учеными: Ламбертом, Дарвином и Питтом. В 1816 году Лаплас установил связь между скоростью звука в воздухе и его удельной теплоемкостью.
Сади Карно в своей работе «На движущей силе огня и о машинах, способных развивать эту силу» (1824), определил максимальная эффективность, которую могут достигать тепловые двигатели. Это заложило основы термодинамики.
Фурье внёс вклад в «аналитическую теорию тепла» (1822), заложив основы появления неравновесной термодинамики.
В 1840 -х годах Майер и Джоуль количественно определили взаимосвязь между механической работой и теплом, установив фундаментальный принцип энергосбережения и трансформации. В 1850 -х годах Клаузиус и Кельвин систематизировали существующие знания и вводят концепции энтропии и абсолютной температуры.
В конце XIX -го века Гиббс ввел термодинамические потенциалы, исследовал условия равновесия и установил законы, регулирующие фазовые переходы и капиллярные явления.
Третий закон термодинамики, сформулированный в 1906 году Вольтером Фридрихом Германом Нернстом, добавил еще одну важную часть головоломки. В 1909 году К. Каратеодори Константин установил аксиоматические основы термодинамики, сделав значительный шаг к более всестороннему пониманию этой фундаментальной научной дисциплины[2].
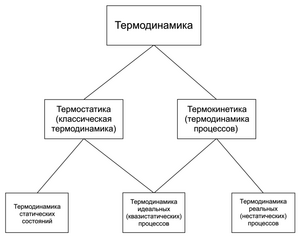
Разделы термодинамики
Классическая термодинамика включает в себя следующие разделы:
- начала термодинамики (иногда также называемые законами или аксиомами);
- уравнения состояния и свойства простых термодинамических систем (идеальный газ, реальный газ, диэлектрики и магнетики и другое);
- равновесные процессы с простыми системами, термодинамические циклы;
- неравновесные процессы и закон неубывания энтропии;
- термодинамические фазы и фазовые переходы;
Кроме этого, современная термодинамика включает также следующие направления:
- строгая математическая формулировка термодинамики на основе выпуклого анализа;
- неэкстенсивная термодинамика;
- применение термодинамики к нестандартным системам;
- квантовая термодинамика[3].
Основы термодинамики
Изучение термодинамики связано с системами, содержащими огромное количество частиц. Применение классической механики для описания таких систем не только неэффективно, но и не имеет смысла. Особенности термодинамического описания обусловлены тем, что поведение больших ансамблей частиц подчиняется статистическим закономерностям и не может быть сведено к анализу детерминированной эволюции динамических систем. В ходе исторического развития термодинамики не было опоры на статистическую теорию, и основные принципы термодинамики могут быть выведены из небольшого числа постулатов, обобщающих опытные данные. Аксиоматика термодинамики может варьироваться у различных авторов, но обычно выделяют четыре основополагающих принципа этой науки.
Важнейшие понятия в термодинамике — система, окружающая среда, уравнения состояния, тепла, работы, внутренней энергии, энергии энтропии и температуры. Первый закон термодинамики: изменения внутренней энергетической энергии системы равны сумме передачи тепла и выполненной работы над системами. Второй закон термодинамики: тепло нельзя самопроизвольно переходить от холодного организма к горячим, а энтропии изолированной системы могут лишь увеличиваться или остаться постоянными[4].
Применение
Термодинамика находит применение в самых разнообразных областях науки и техники, в том числе в химии, биологии, астрофизике, инженерии и других. Она помогает описывать энергетические процессы, оптимизировать работу систем, разрабатывать новые материалы и технологии[5].
Примечание
Данная статья имеет статус «готовой». Это не говорит о качестве статьи, однако в ней уже в достаточной степени раскрыта основная тема. Если вы хотите улучшить статью — правьте смело! |
Данная статья имеет статус «проверенной». Это говорит о том, что статья была проверена экспертом |
- ↑ Термодинамика. Большая Российская Энциклопедия. Дата обращения: 1 июня 2024.
- ↑ Нулевое начало термодинамики. Большая Российская энциклопедия. Дата обращения: 1 июня 2024.
- ↑ Первое начало термодинамки. Наука. Дата обращения: 1 июня 2024.
- ↑ Второе начало термодинамики. Наука. Дата обращения: 1 июня 2024.
- ↑ Термодинамика. Большая Советская Эциклопедия. Дата обращения: 1 июня 2024.