Аккумулятор
Аккумулятор (лат. accumulator — собиратель, от accumulo — собираю, накопляю) — это устройство, которое запасает электрическую энергию путём превращения её в химическую с обратным преобразованием по мере надобности[1] и является одним из типов химических источников тока. Такие источники преобразовывают энергию химических связей в электрическую энергию[2].
Описание и принцип работы
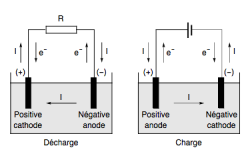
Аккумулятор — это многоразовый источник тока, который предназначен для накопления и хранения энергии. Его работа основана на обратимых окислительно-восстановительных реакциях, что дает возможность использовать батарею многократно. Для создания аккумуляторной батареи несколько аккумуляторов соединяют в одну цепь.
В основе принципа действия аккумуляторов лежит явление электролиза, где используется его важное свойство — обратимость. Электролиз — изменение химического состава раствора при прохождении через него электрического тока, обусловленное потерей или присоединением электронов ионами.
Внутри любого химического источника тока всегда есть два химических вещества, одно из которых готово отдавать свои электроны другому. Химический источник тока и аккумулятор различаются тем, что два реагирующих между собой вещества разделены средой, которая позволяет им обмениваться массой, но не позволяет передавать электроны. Электроны при этом могут двигаться по внешней цепи, создавая электродвижущую силу. Среда, которая располагается между двумя реагирующими веществами, называется электролитом[2].
История
Ещё в 1800 году Алесандро Вольта (1745—1827) — итальянский физик и физиолог, один из основоположников учения об электричестве поместил пластины из цинка и меди в кислоту, чтобы получить непрерывный электрический ток. Вольта назвал свое изобретение «электрический орган». Это был первый химический источник тока на медно-цинковой паре электродов («вольтов столб» или «батарея Вольта»). В 1802 г. немецкий физик Джоан Вильгельм Риттер (1776—1810) изобрел сухой гальванический элемент, а в 1803 году — электрическую аккумуляторную батарею.
В 1854 году немецкий военный врач Вильгельм Зинстеден наблюдал следующий эффект: при пропускании тока через свинцовые электроды, погруженные в разведенную серную кислоту, положительный электрод покрывался двуокисью свинца PbO2, в то время как отрицательный электрод не подвергался никаким изменениям. Если такой элемент замыкали потом накоротко, прекратив пропускание через него тока от постоянного источника, то в нём появлялся постоянный ток, который обнаруживался до тех пор, пока вся двуокись свинца не растворялась в кислоте.
Пять лет спустя, в 1859 году, французский инженер Гастон Планте случайно сделал то же самое открытие и построил первый в истории свинцовый аккумулятор.
До тех пор, пока не была изобретена динамо-машина, аккумуляторы представляли мало интереса, но когда появилась возможность легко и быстро заряжать их с помощью генератора, аккумуляторы получили широчайшее распространение.
В начале XX века усовершенствованием аккумулятора занялся Томас Эдисон, который хотел сделать его более приспособленным для нужд транспорта. В результате были созданы железно-никелевые аккумуляторы с электролитом в виде едкого калия. В 1903 году начинается производство новых портативных аккумуляторов, которые получили широкое распространение практически во всех технических областях[3][4].
Примечания
- ↑ Большая советская энциклопедия. — С. 470—474. — 484 с.
- ↑ 2,0 2,1 Иткис Д. Химия аккумуляторов. Постнаука. Дата обращения: 2023.05.20.
- ↑ История изобретения и усовершенствования аккумулятора. https://www.aktex.ru/. Дата обращения: 2023.05.20.
- ↑ Аккумуляторы. https://kitaphana.kz/. Дата обращения: 2023.05.20.