Пиридин
| Пиридин | |
|---|---|
 | |
| Общие | |
| Хим. формула | С5H5N |
| Физические свойства | |
| Молярная масса | 79,10 г/моль |
| Плотность | 0,98272 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | -41,6 °C |
| • кипения | 115,3 °C |
| • вспышки | 20 °C |
| • самовоспламенения | 482 °C |
| Давление пара | 20,8 мм рт. ст. |
| Классификация | |
| PubChem | 1049 |
| InChI | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Пиридин — органическое вещество, шестичленное гетероциклическое соединение с одним атомом азота. Бесцветная жидкость с резким неприятным запахом, ядовит. Смешивается во всех соотношениях с водой и большинством органических растворителей. Обнаруживает и основные, и нуклеофильные свойства. Используется в синтезе пиперидина и лекарственных средств, инсектицидов и гербицидов, химикатов, используемых при вулканизации каучука, а также в качестве растворителя[1].
История открытия
Пиридин впервые был описан шотландским химиком Томасом Андерсоном в 1840-х годах. Путем перегонки костяного масла был получен пиридин и некоторые другие азотсодержащие органические соединения[2]. Позднее в 1877 году Уильям Рамзай, шотландский британский химик, выступил с сообщением «О соединениях пиридина», перед этим выпустив в свет работу, описывающую синтез пиридина, включающий в себя пропускание смеси ацетилена и цианистого водорода через нагретую трубку. Артур Рудольф Ганч в 1882 году открыл синтез производных пиридина путем взаимодействия -дикарбонильного соединения, альдегида и аммиака, сейчас этот метод получения известен как синтез Ганча. В 1905 году А. Е. Чичибабиным была открыта реакция конденсации альдегидов с аммиаком, которая приводит к образованию 2,3,5-замещенных пиридинов.
Строение
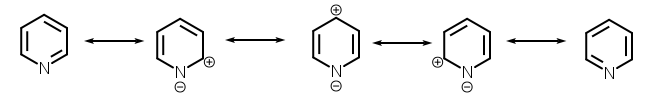
Молекула пиридина представляет собой плоский цикл, все атомы которого находятся в -гибридизации. Сопряженная циклическая система пиридина подобна бензольной, за исключением того, что один атом углерода замещен на атом азота. Его неподелённая электронная пара практически не участвует в сопряжении ввиду своего пространственного расположения. Вследствие электроноакцепторного действия атома азота молекула пиридина является полярной и все атомы углерода имеют некоторый положительный заряд[3].
Химические свойства
Пиридин проявляет основные свойства, реагируя с кислотами с образованием солей пиридиния. Основность пиридина сравнима с основностью анилина.
Реакция Чичибабина относится к взаимодействию с нуклеофильными реагентами. В этой реакции амид натрия реагирует с пиридином с образованием 2-аминопиридина.
Из-за наличия неподелённой электронной пары азота возможно взаимодействие с электрофильными реагентами. Легко осуществляется алкилирование. Электрофильное замещение происходит при жёстких условиях в мета-положение. Окисление пиридина и его производных дает соответствующие N-оксиды, которые в те же реакции электрофильного замещения вступают легче и преимущественно дают орто- и пара-замещённые продукты[3].
Восстановление может проходить как гидрирование в присутствии катализатора (Pt, Ni), так и при действии натрия в абсолютном спирте[4].
Получение
Пиридин содержится в продуктах сухой перегонки каменного угля — каменноугольной смоле и подсмольных водах, откуда его и получают в промышленности. Также он есть в продуктах сухой перегонки костей. Природное сырье служит основным источником пиридина и его гомологов.
Одним из основных методов построения пиридинового ядра является конденсация 1,5-дикарбонильных соединений с аммиаком. Эта конденсация приводит к образованию 1,4-дигидропиридинов, которые при окислении ароматизуются в пиридины[5].
Применение
Пиридин широко используется в качестве растворителя. Большие количества этого вещества используются в качестве промежуточного продукта при производстве замещенных пиридинов, пиперидина и агрохимикатов, более 5 % лекарственных средств синтезировано на основе производных пиридина, в том числе супрастин, фтивазид и другие[6][1].
Воздействие на организм человека
Пиридин может проникать в организм при дыхании и приеме внутрь, а также через кожу. При попадании на неё вещество вызывает покраснение и ощущение жжения. Симптомы при вдыхании — от кашля, головной боли и тошноты до потери сознания. Пиридин, возможно, является канцерогенным для человека. В качестве профилактических мер при работе с веществом рекомендуется применять вентиляцию, средства защиты органов дыхания, защитную одежду и перчатки. Хранить только в оригинальной упаковке и обеспечить огнестойкость[7].
Примечания
- ↑ 1,0 1,1 WORLD HEALTH ORGANIZATION INTERNATIONAL AGENCY FOR RESEARCH ON CANCER. IARC monographs on the evaluation of carcinogenic risks to humans ; 77. — Lyon, 2000. — С. 503—505. — ISBN 92 832 1277 0.
- ↑ Edinburgh : Royal Society of Edinburgh. Transactions of the Royal Society of Edinburgh. — 1857. — С. 571—573.
- ↑ 3,0 3,1 Нейланд О. Я. Органическая химия. — Москва: Высшая школа, 1990. — С. 689—692. — ISBN 5-06-001471-1.
- ↑ Травень В. Ф. Органическая химия: Учебник для вузов: В 2 т.. — Москва: ИКЦ "Академкнига", 2004. — С. 448—457. — ISBN 5-94628-172-0.
- ↑ М.А.Юровская, А.В.Куркин, Н.В.Лукашёв. Химия ароматических гетероциклических соединений (Методическая разработка для студентов 3 курса). — Москва: Химический факультет МГУ имени М. В. Ломоносова, 2007. — С. 28.
- ↑ И. Ф. Фаляхов, Р. З. Гильманов, Ф. Г. Хайрутдинов, Г. П. Шарнин, З. Г. Ахтямова. Химия нитропроизводных пиридина: монография. — КНИТУ, 2016. — С. 606. — ISBN 978-5-7882-1900-4.
- ↑ ПИРИДИН (ноябрь 2019). Дата обращения: 16 декабря 2023.
Данная статья имеет статус «готовой». Это не говорит о качестве статьи, однако в ней уже в достаточной степени раскрыта основная тема. Если вы хотите улучшить статью — правьте смело! |
Данная статья имеет статус «проверенной». Это говорит о том, что статья была проверена экспертом |





![{\displaystyle {\ce {C5H5N + 3H2 ->[Ni, t] C5H11N}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4fb1ae40f576fc348912ff084be9d653846de6d3)
![{\displaystyle {\ce {C5H5N ->[{Na}][{C2H5OH}] C5H11N}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/18f5856b33a0a05c96ba8b97ba7232d9e4b86c2e)
