Гидрокарбонат натрия
| Гидрокарбонат натрия | |
|---|---|
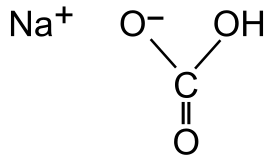 Структурная формула гидрокарбоната натрия Структурная формула гидрокарбоната натрия | |
| Общие | |
| Систематическое наименование |
гидрокарбонат натрия |
| Традиционные названия | пищевая (питьевая) сода, сода двууглекислая |
| Рац. формула | NaHCO3 |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 84,0066 г/моль |
| Плотность | 2,159 г/см³ |
| Термические свойства | |
| Температура | |
| • разложения | 60—200 °C |
| Энтальпия | |
| • образования | -947,7 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 9,59 г/100 мл |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гидрокарбона́т на́трия (лат. Natrii hydrocarbonas, хим. формула NaHCO3) — неорганическое соединение, относящееся к классу кислых солей угольной кислоты, характеризующееся плотностью 2,20 г/см3[1] и проявляющее амфотерные свойства, что обусловливает его широкое применение в различных областях науки и техники.
Фундаментальные характеристики вещества
Молекулярно-физическая основа
Соединение обладает молекулярной массой 84,0066 г/моль[2] и кристаллизуется в моноклинной сингонии. Внешне представляет мелкокристаллический порошок белого цвета с характерными оптическими свойствами, включающими показатели преломления nα = 1,377, nβ = 1,501, nγ = 1,583. Термодинамические параметры включают:
- теплоёмкость 87,6 Дж/моль·К;
- стандартную энтропию 101,7 Дж/моль·К;
- энергию Гиббса образования −851,0 кДж/моль;
- энтальпию образования −947,7 кДж/моль.
Кристаллическая структура характеризуется моноклинной элементарной ячейкой с упорядоченным расположением натриевых катионов и гидрокарбонатных анионов. Межмолекулярные взаимодействия определяются водородными связями между гидрокарбонатными группами, что влияет на физико-химические свойства кристаллической решётки.
Растворимостные и термические свойства
Вещество демонстрирует ограниченную растворимость в органических растворителях: 0,02 массовых процента в ацетоне и 2,13 массовых процента в метаноле при температуре 22 °C[3]. В водной среде растворимость значительно возрастает, достигая 9,59 г/100 мл при стандартных условиях, с заметным увеличением при нагревании:
- 69 г/л при 0 °C;
- 96 г/л при 20 °C;
- 165 г/л при 60 °C.
Термическое поведение характеризуется началом разложения при температурах выше 50 °C[4], с наиболее интенсивным процессом в диапазоне 60-200 °C, сопровождающимся потерей массы 36,917 %. Процесс декарбоксилирования протекает эндотермически с поглощением 129 кДж/моль тепловой энергии.
Химические превращения и реакционная способность
Термодинамика разложения
Процесс термического разложения протекает по уравнению 2NaHCO3 → Na2CO3 + H2O + CO2 с образованием карбоната натрия, воды и углекислого газа. Кинетика реакции описывается уравнением первого порядка с энергией активации 142 кДж/моль. Кислотно-основные свойства проявляются через значения pKa 6,34 и 6,351 для углекислой кислоты, что обеспечивает буферные характеристики растворов в широком диапазоне концентраций[5].
Гидролиз в водных растворах протекает согласно реакции HCO3⁻ + H2O ⇌ H2CO3 + OH⁻, создавая слабощелочную среду с pH 8,1-8,3 для 1 % раствора. Буферная ёмкость максимальна в области pH 6,1-7,4, что соответствует физиологическим значениям организма человека.
Взаимодействие с неорганическими соединениями
Особую значимость представляет способность образовывать стехиометрически точные соединения при взаимодействии с переходными металлами. В частности, реакция с солями марганца(II) приводит к формированию карбоната марганца(II) состава MnCO3 без примесей основных солей[6].
Взаимодействие с минеральными кислотами сопровождается выделением углекислого газа по механизму:
- нейтрализация кислоты с образованием соли;
- формирование нестабильной угольной кислоты;
- спонтанное разложение H2CO3 на воду и CO2.
С органическими кислотами реакции протекают аналогично, при этом с уксусной кислотой образуется ацетат натрия, с лимонной — цитрат натрия. Скорость газовыделения зависит от концентрации кислоты, температуры и степени перемешивания реакционной смеси.
Промышленное производство и получение
Технологические процессы синтеза
Основным промышленным методом получения служит аммиачно-хлоридный способ[2], основанный на пропускании углекислого газа через концентрированный раствор хлорида натрия, насыщенный аммиаком.
Процесс включает две последовательные реакции:
- NH3 + CO2 + H2O → NH4HCO3;
- NH4HCO3 + NaCl → NaHCO3↓ + NH4Cl.
Технологический цикл предусматривает рециркуляцию аммиака путём обработки хлорида аммония гидроксидом кальция. Глобальное производство достигает около 100000 тонн ежегодно при общих мировых мощностях 2,4 миллиона тонн в год. Альтернативный метод — процесс Сольве — обеспечивает получение продукта чистотой до 75 % с возможностью дальнейшей очистки перекристаллизацией.
Современные технологии включают получение из карбоната натрия действием углекислого газа в водной среде под давлением 2-4 атм при температуре 40-60 °C. Выход реакции составляет 92-95 % при соблюдении оптимальных параметров процесса.
Природные источники и добыча
Минералогические исследования показывают, что трона встречается в природе чаще нахколита вследствие повышенной растворимости последнего в водных системах[7]. Основные месторождения сосредоточены в США, Ботсване, Кении, Уганде, Турции и Мексике, при этом крупнейшие залежи троны находятся в бассейне Грин-Ривер штата Вайоминг с запасами более 200 миллионов тонн.
Добыча осуществляется как традиционными горнодобывающими методами (камерно-столбовая система, длинными забоями), так и растворным способом в формациях эоценового возраста (55,8-33,9 млн лет назад). Технология растворного извлечения предполагает:
- бурение скважин в нахколитовые пласты;
- закачку нагретой воды под давлением;
- растворение минерала с образованием насыщенного раствора;
- извлечение раствора на поверхность;
- кристаллизацию продукта при охлаждении.
Попутное извлечение возможно при добыче сланцевой нефти, где нахколит присутствует в качестве сопутствующего минерала в концентрациях 5-15 % по массе.
Медицинское применение и фармакология
Гастроэнтерологическое действие
В клинической практике вещество применяется в качестве антацидного средства для снижения кислотности желудочного сока и терапии язвенной болезни желудка и двенадцатиперстной кишки[8]. Механизм действия основан на нейтрализации соляной кислоты по реакции NaHCO3 + HCl → NaCl + H2O + CO2, однако следует учитывать возможность развития кислотного рикошета вследствие стимуляции выработки гастрина при растяжении желудка образующимся углекислым газом.
Фармакокинетика характеризуется быстрым всасыванием в двенадцатиперстной кишке с последующим поступлением в системный кровоток. Период полувыведения составляет 2-4 часа, элиминация происходит через почки и лёгкие. Дозировка для взрослых составляет 1-2 г на приём, не более 8 г в сутки.
Противопоказания включают состояния метаболического алкалоза, респираторного ацидоза и гипокальциемии. При длительном применении возможно развитие синдрома отмены с усилением секреции соляной кислоты.
Респираторная терапия и местное применение
Ингаляционное введение 0,5-2 % растворов способствует усилению секреции слизистой трахеобронхиального дерева[9], что увеличивает количество мокроты и снижает её вязкость на 30-40 %. Данный эффект используется во фтизиатрии для стимуляции выработки материала для бактериологических исследований, а также в терапии хронического бронхита и бронхиальной астмы.
Механизм муколитического действия связан с изменением pH слизи с кислого на слабощелочной, что активирует эндогенные протеазы и способствует деполимеризации муцинов. Концентрация 1 % обеспечивает оптимальный эффект без раздражения дыхательных путей.
Местное применение включает использование в составе раствора Моффетта для назальной хирургии (кокаин 2 г, адреналин 2 мл, бикарбонат натрия 2 г на 20 мл физиологического раствора) и в комбинации с местными анестетиками для ускорения начала действия путём повышения pH раствора.
Спортивная медицина и физиология
Исследования в области спортивной медицины подтверждают эффективность применения в качестве добавки для повышения мышечной выносливости[10], особенно при кратковременных высокоинтенсивных нагрузках продолжительностью 1-7 минут. Механизм действия основан на буферировании молочной кислоты, образующейся при анаэробном гликолизе.
Протокол применения предусматривает приём 0,3 г/кг массы тела за 60-90 минут до физической нагрузки. Эффективность достигает 1-3 % улучшения результатов в циклических видах спорта. Побочные эффекты включают диспепсию у 15-20 % спортсменов.
В стоматологии проявляет антикариесные и абразивные свойства с индексом относительной дентинной абразивности 7 (очень низкий), обеспечивая механическое очищение зубов и нейтрализацию кислой среды полости рта. Применение в составе зубных паст в концентрации 20-25 % снижает количество кариесогенных бактерий на 40 %.
Безопасность и токсикология
Параметры острой токсичности
Токсикологические исследования устанавливают среднюю летальную дозу на уровне 4220 мг/кг массы тела при пероральном введении крысам[11], что классифицирует соединение как малотоксичное (4-й класс опасности по ГОСТ 12.1.007).
Клинические проявления острого отравления включают:
- диспепсические расстройства;
- метаболический алкалоз;
- гипокалиемию;
- гипокальциемию;
- тетанические судороги при тяжёлых отравлениях.
Вещество характеризуется пожаробезопасностью и несгораемостью, имеет солоноватый мыльный привкус и может вызывать лёгкое раздражение слизистых оболочек при контакте с пылевыми частицами концентрацией более 10 мг/м3.
Хроническое воздействие малых доз не приводит к кумуляции, канцерогенные и мутагенные свойства отсутствуют. Репродуктивная токсичность не установлена при дозах до 1000 мг/кг в экспериментах на лабораторных животных.
Производственная гигиена
Санитарно-гигиенические нормативы устанавливают предельно допустимую концентрацию пыли в воздухе рабочей зоны на уровне 5 мг/м3[12] при средней сменной концентрации. Максимальная разовая концентрация не должна превышать 15 мг/м3. Класс опасности по воздействию на организм — 4 (малоопасные вещества).
Классификация опасности по системе СГС присваивает сигнальное слово «осторожно» с соответствующей пиктограммой раздражающего действия. Регистрационный номер CAS составляет 144-55-8, номер EINECS — 205-633-8. Средства индивидуальной защиты включают респираторы типа «Лепесток» при превышении ПДК в 2 раза и более.
Первая помощь при попадании в глаза — промывание проточной водой в течение 15 минут, при попадании на кожу — смывание водой с мылом. При случайном проглатывании больших количеств — обильное питьё воды, при необходимости — промывание желудка.
Технические и бытовые применения
Пищевая промышленность и кулинария
В пищевых технологиях используется как разрыхлитель теста под кодом E500(ii) в количестве 0,5-2 % от массы муки, а также проявляет слабые дезинфицирующие свойства[13] при обработке поверхностей, контактирующих с продуктами питания. Механизм разрыхления основан на выделении углекислого газа при нагревании или взаимодействии с кислыми компонентами теста.
В хлебопекарной промышленности применяется для производства:
- бисквитных изделий — 0,5-0,8 % к массе муки;
- пряников и печенья — 0,3-0,6 %;
- кексов и маффинов — 0,8-1,2 %;
- блинов и оладий — 0,5-1,0 %.
Химическая промышленность использует соединение для производства красителей (азокрасители, фталоцианины), пенопластов (полистирол, полиуретан) и фторорганических веществ (фреоны, тефлон). В процессах органического синтеза служит мягким основанием для нейтрализации кислых продуктов реакции.
Производство газированных напитков использует технический гидрокарбонат натрия для регулирования кислотности и создания характерного вкуса. Концентрация в готовом продукте составляет 0,1-0,3 %.
Системы пожаротушения и очистки
Применение в системах пожаротушения основано на выделении углекислого газа при нагревании, что ограничивает доступ кислорода к очагу горения. Механизм огнетушащего действия включает[14]:
- эндотермическое разложение с поглощением тепла;
- разбавление горючих газов негорючим CO2;
- образование на поверхности горящего материала защитной плёнки карбоната натрия.
В промышленности применяется для содоструйной очистки (sodablasting) мягких материалов — алюминия, меди, древесины — с рабочим давлением 2-6 атм. Преимущества метода включают отсутствие повреждения обрабатываемой поверхности и экологическую безопасность.
Особое значение имеет способность удалять урановые загрязнения 2 % раствором, что было использовано во время Манхэттенского проекта для обеззараживания одежды и оборудования. Современные применения включают дезактивацию при авариях на атомных станциях.
Альтернативные концепции применения
Критический анализ альтернативных медицинских концепций показывает отсутствие научных подтверждений эффективности в лечении онкологических заболеваний, что отмечается в публикациях Американского онкологического общества[15]. Теория итальянского врача Туллио Симончини о противораковом действии основана на ошибочном представлении о грибковой природе злокачественных опухолей.
Клинические исследования с участием 150 пациентов не выявили статистически значимых различий в выживаемости между группами, получавшими традиционную терапию и комбинированное лечение с гидрокарбонатом натрия. Более того, ощелачивание организма может приводить к серьёзным осложнениям:
- метаболическому алкалозу;
- гипокалиемии с нарушениями ритма сердца;
- гипокальциемии с тетаническими судорогами;
- отёкам и артериальной гипертензии.
Исторические заявления о терапии инфекционных заболеваний, включая высказывания сенатора Ли Овермана в 1919 году о лечении испанского гриппа, не имеют научного обоснования и основаны на анекдотических данных без контролируемых исследований.
Литература
- Бент А. Дж. Технология производства тортов. — 6-е издание. — Springer, 1997.
- Дэвидсон Д. Амфотерные молекулы, ионы и соли. — Журнал химического образования, 1955.
- Номенклатура неорганической химии. Рекомендации IUPAC 2005. — М.: Научный мир, 2009.
- Рутала У. А., Барби С. Л., Агиар Н. К., Собси М. Д., Вебер Д. Дж. Антимикробная активность бытовых дезинфицирующих средств и природных продуктов против потенциальных патогенов человека // Контроль инфекций и больничная эпидемиология. — 2000.
- Тиме К. Карбонаты натрия // Энциклопедия промышленной химии Ульмана. — 6-е издание. — Wiley-VCH, 2000.
- Фентон Т. Р., Тоф С. К., Лайон А. У., Элиасзив М., Ханли Д. А. Причинная оценка пищевой кислотной нагрузки и заболеваний костей // Журнал питания. — 2011.
- Холлеман А. Ф., Виберг Э. Неорганическая химия. — М.: Мир, 2004.
- Швальфенберг Г. К. Щелочная диета: есть ли доказательства того, что щелочная диета полезна для здоровья // Журнал окружающей среды и общественного здравоохранения. — 2012.
Примечания
- ↑ Хейнс У. М. Справочник CRC по химии и физике. — 1920. — С. 4–90.
- ↑ 2,0 2,1 Глинка Н. Л. Общая химия. — Москва: Химия, 1977. — С. 441. — 720 с.
- ↑ Эллингбо Дж. Л., Раннелс Дж. Х. Растворимость карбоната натрия и гидрокарбоната натрия в смесях ацетон–вода и метанол–вода // Журнал химических и инженерных данных. — 1966. — Т. 11, № 3. — С. 323–324.
- ↑ Паскуали И., Беттини Р., Джордано Ф. Термическое поведение композиций диклофенака, диклофенака натрия и гидрокарбоната натрия // Журнал термического анализа и калориметрии. — 2007. — Т. 90, № 3. — С. 903–907.
- ↑ Карякин Ю. В., Ангелов И. И. Чистые химические вещества. — Москва: Химия, 1974. — С. 228.
- ↑ Sumich A. I., Yeshchanka L. S. Study of the composition and properties of products formed in interaction of Na2CO3 with proton-containing reagents // Russian Journal of Applied Chemistry. — 2012. — Т. 88, № 12. — С. 1923–1927.
- ↑ Гертнер Р. С., Виткамп Г. Дж. Смешанная растворителем реактивная перекристаллизация троны в соду // Гидрометаллургия. — 2007. — Т. 88, № 1–4. — С. 75–91.
- ↑ Машковский М. Д. Лекарственные средства. — Москва: Медицина, 1998. — С. 112.
- ↑ Sodium Bicarbonate Intravenous Infusion // Consumer Medicine Information : Better Health Channel. — 2004. — 13 июля.
- ↑ Гргич Й., Родригес Р. Ф., Гарофолини А., Сондерс Б., Бишоп Д. Дж., Шёнфельд Б. Дж., Педишич З. Влияние добавок гидрокарбоната натрия на мышечную силу и выносливость // Спортивная медицина. — 2020. — Т. 50, № 7. — С. 1361–1375.
- ↑ Chambers M. Sodium bicarbonate. — ChemIDplus.
- ↑ ГОСТ 2156-76. Натрий двууглекислый. Технические условия. — Москва: Стандартинформ, 1976.
- ↑ Малик Й. С., Гойал С. М. Вирулицидная эффективность гидрокарбоната натрия на пищевой контактной поверхности против калицивируса коров // Международный журнал пищевой микробиологии. — 2006. — Т. 109, № 1–2. — С. 160–163.
- ↑ Фёлькерт Дж. К. Пожар и пожаротушение — краткое руководство по химии огня и теории пожаротушения для специалистов по обслуживанию пожарного оборудования. — 2015. — С. 14–15.
- ↑ Американское онкологическое общество. идрокарбонат натрия. — 2008.



