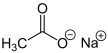
Ацетат натрия
| Ацетат натрия | |
|---|---|
 формулаформула | |
| Общие | |
| Систематическое наименование |
Ацетат натрия |
| Традиционные названия | Этаноат натрия |
| Хим. формула | C2H3O2Na |
| Рац. формула | CH3COONa |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса |
82,03 г/моль (безводная форма) 136,08 г/моль (тригидрат) г/моль |
| Плотность | 1,45 г/см³ |
| Термические свойства | |
| Температура | |
| • разложения | 324 °C |
| Удельная теплота плавления | 264—289 кДж/кг |
| Химические свойства | |
| Растворимость | |
| • в воде | 76 г/100 мл |
| Безопасность | |
| Токсичность |
малотоксичен, ирритант |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Ацета́т на́трия (этаноа́т на́трия) — органическая натриевая соль уксусной кислоты с химической формулой CH₃COONa. Это бесцветное кристаллическое вещество, хорошо растворимое в воде. Ацетат натрия широко используется в пищевой, в текстильной промышленности,для получения красителей, мыл, уксусного ангидрида, ацетилхлорида, винилацетата, в медицине, в гальванотехнике[1].
Открытие
Открытие ацетата натрия тесно связано с историей изучения уксусной кислоты[2]. В 1648 году немецкий химик Андреас Либавиус впервые получил безводную уксусную кислоту путём перегонки медного ацетата. Это открытие стало важным шагом к синтезу ацетата натрия[3].
В 1700 году французский химик Николя Лемери описал получение «возрождённой земли свинца» — вещества, которое сегодня известно как ацетат свинца. Этот эксперимент стал прототипом для синтеза других ацетатов, включая ацетат натрия. Непосредственное открытие ацетата натрия приписывают шведскому химику Йёнсу Якобу Берцелиусу. В начале XIX века он провёл серию экспериментов по нейтрализации уксусной кислоты гидроксидом натрия. Результатом этой реакции стало получение ацетата натрия. Берцелиус не только синтезировал ацетат натрия, но и детально изучил его свойства. Он определил химический состав вещества и описал его кристаллическую структуру. Эти исследования были опубликованы в его фундаментальном труде «Учебник химии» в 1808 году[3].
Открытие ацетата натрия имело важное значение для развития органической химии. Это соединение стало одним из первых хорошо изученных органических солей и послужило моделью для исследования других подобных веществ[3].
Физические свойства
Ацета́т на́трия (этаноат натрия), натриевая соль уксусной кислоты имеет молярную массу 82,03 г/моль. Представляет собой бесцветные кристаллы моноклинной сингонии с температурой плавления tпл = 324 °C. Плотность ацетата натрия — 1,528 г/см3, молярная теплоёмкость — 79,9 Дж/(моль·К), теплота образования (энтальпия) — 709,32 кДж/моль, энергия Гиббса — 607,70 кДж/моль, стандартная энтропия 123,1 Дж/(моль·К). В воде хорошо растворяется. Водой гидролизуется. Обладает плохой растворимостью в этаноле, диэтиловом эфире. кристаллизуется тригидрат из водных растворов, которые представляют собой бесцветные кристаллы моноклинной сингонии и характеризуются температурой плавления tпл = 58 °C, плотностью — 1,45 г/см3, энтальпией образования —1604 кДж/моль, стандартной энтропией — 262 Дж/(моль·К). При 120 °C ацетат натрия обезвоживается[1].
Химические реакции
Ацетат натрия (CH₃COONa) вступает в различные химические реакции, чем обусловлено его широкое применение в промышленности и лабораторной практике[4].
- Гидролиз ацетата натрия происходит в водном растворе, образуя слабощелочную среду:
CH₃COONa + H₂O ↔ CH₃COOH + NaOH
ацетат натрия + вода ↔ уксусная кислота + гидроксид натрия
Эта реакция обратима.
- При нагревании до температуры выше 350 °C ацетат натрия подвергается термическому разложению:
2CH₃COONa → 2Na₂CO₃ + (CH₃)₂CO
ацетат натрия → карбонат натрия + ацетон
В результате этой реакции образуются карбонат натрия и ацетон.
- Ацетат натрия реагирует с сильными кислотами, образуя уксусную кислоту:
CH₃COONa + HCl → CH₃COOH + NaCl
- Реакция Дюма протекает при нагревании (сплавлении) ацетата натрия с гидроксидом натрия. Образуются карбонат натрия Na₂CO₃ и выделяется метан СН4:
CH₃COONa + NaOH → СН4↑+ Na₂CO₃
ацетат натрия + гидроксид натрия → метан + карбонат натрия.
- С гидроксидом натрия ацетат натрия не взаимодействует из-за общего иона Na⁺.
- При электролизе (реакция Кольбе) водного раствора ацетата натрия на катоде выделяется водород Н2, а на аноде — этан С3Н6:
2CH₃COONa + 2H₂O → 2NaOH + CH₃―CH₃ + 2CO₂↑ + H₂↑
- Ацетат натрия может выступать в роли восстановителя. Например, в реакции с перманганатом калия в кислой среде:
5CH₃COONa + 2KMnO₄ + 8H₂SO₄ → 5CO₂ + 2MnSO₄ + K₂SO₄ + 5Na₂SO₄ + 13H₂O
ацетат натрия + перманганат калия + серная кислота → оксид углерода (IV) + сульфат марганца + сульфат калия + сульфат натрия + вода.
- В реакциях алкилирования солей образуются сложные эфиры:
CH₃COONa + СН3―СН2―Cl → CH₃COOС2―СН3 + NaCl
ацетат натрия + хлорэтан → этиловый эфир уксусной кислоты (этилацетат) + хлорид натрия.
- Ацилирование галогенангидридами:
CH₃COONa + СН3СОCl → СН3СООС(О)СН3 +NaCl
ацетат натрия + ацетилхлорид → уксусный ангидрид + хлорид натрия[4].
Эти химические свойства ацетата натрия обуславливают его применение в качестве буферного агента, реагента в органическом синтезе и компонента в различных промышленных процессах.
Способы получения
Ацетат натрия получают различными способами в промышленности и лабораторных условиях[5].
Промышленные способы получения
Выбор метода получения ацетата натрия зависит от требуемой чистоты продукта, доступности реагентов и экономической эффективности процесса[1].
- Основной промышленный метод производства ацетата натрия — нейтрализация уксусной кислоты карбонатом натрия или гидроксидом натрия:
2CH₃COOH + Na₂CO₃ → 2CH₃COONa + H₂O + CO₂↑
уксусная кислота + карбонат натрия → ацетат натрия + вода + оксид углерода (IV) (углекислый газ)
CH₃COOH + NaOH → CH₃COONa + H₂O
уксусная кислота + гидроксид натрия → ацетат натрия + вода
Эти реакции проводят при температуре 50-60 °C с последующей кристаллизацией продукта.
- Другой промышленный способ — карбонизация метилата натрия оксидом углерода (II) при высоком давлении и температуре 250 °C:
CH₃ONa + CO → CH₃COONa
Лабораторные способы получения
- В лабораторных условиях ацетат натрия можно получить реакцией ацетилхлорида CH₃COCl с гидроксидом натрия:
CH₃COCl + NaOH → CH₃COONa + HCl
- Ещё один метод — окисление этанола CH₃CH₂OH в присутствии гидроксида натрия:
CH₃CH₂OH + NaOH + [O] → CH₃COONa + 2H₂O
Эту реакцию проводят при нагревании с использованием окислителей, таких как перманганат калия или дихромат калия.
- Ацетат натрия также образуется при электролизе раствора хлорида натрия с использованием графитовых электродов:
2NaCl + 2H₂O + 2CO₂ → 2CH₃COONa + Cl₂ + O₂↑
Этот процесс требует тщательного контроля температуры и концентрации электролита.
- При взаимодействии карбоновых кислот с металлами, например с натрием, образуется ацетат натрия и выделяется водород:
2СH₃COOH + 2Na → 2CH₃COONa + H₂↑.
- Взаимодействие карбоновых кислот с основными оксидами:
2СH₃COOH + Na₂O → 2CH₃COONa + H₂O
уксусная кислота + оксид натрия → ацетат натрия + вода.
- Ионный обмен с выделением газа:
СH₃COONH4 + NaOH → CH₃COONa + NH3↑ + H₂O
ацетат аммония + гидроксид натрия → ацетат натрия + аммиак↑ + вода.
- Взаимодействие геминальных тригалогенидов с щелочью:
СH3CСl3 + 4NaOH(водный раствор) → CH₃COONa + 3NaСl + 2H₂O[6]
1,1,1-трихлорэтан + гидроксид натрия(водн р-р) → ацетат натрия + хлорид натрия + вода[5].
Область применения
Ацетат натрия находит широкое применение в различных отраслях промышленности и быту благодаря своим уникальным свойствам.
В пищевой промышленности ацетат натрия используется как консервант и регулятор кислотности (E262). Он предотвращает рост бактерий и грибков, продлевая срок хранения продуктов. Его добавляют в хлебобулочные изделия, соусы, маринады и консервированные овощи. Также используется для маринования рыбы в рыбной промышленности, при изготовлении майонезов и соусов, картофельных чипсов, сухариков, сухих бульонов и супы, для консервации фруктов, овощей и ягод[7][8].
Текстильная промышленность применяет ацетат натрия в качестве протравы при окрашивании тканей. Он помогает закрепить краситель на волокнах, улучшая стойкость цвета к стирке и солнечному свету[9].
В медицине ацетат натрия используется как компонент внутривенных растворов для коррекции метаболического ацидоза. Он также входит в состав некоторых лекарственных препаратов и служит буферным агентом в фармацевтических композициях[8][9].
Химическая промышленность использует ацетат натрия как исходное сырьё для синтеза других органических соединений. Он служит промежуточным продуктом при производстве эфиров, красителей и полимеров[10].
В лабораторной практике ацетат натрия применяется как буферный раствор и реагент в аналитической химии. Его используют для приготовления стандартных растворов и в качестве электролита в электрохимических исследованиях[10].
Ацетат натрия входит в состав антиобледенительных средств для дорог и взлётно-посадочных полос аэропортов. Он эффективно понижает температуру замерзания воды и менее коррозионно активен по сравнению с хлоридами натрия[10].
Необычное применение ацетата натрия — химические грелки многоразового использования. Пересыщенный раствор ацетата натрия при кристаллизации выделяет тепло, что позволяет использовать его как источник тепла в портативных устройствах[10].
В фотографии ацетат натрия используется как компонент фиксирующих растворов, помогая стабилизировать изображение на фотобумаге. Ацетат натрия также применяется в производстве бумаги, пластмасс и в нефтяной промышленности как ингибитор коррозии[10].
Влияние на организм
Ацетаты натрия обладают выраженными бактерицидными и дезинфицирующими свойствами. Пищевой консервант Е 262 хорошо усваиваются организмом. Аллергические реакции на ацетат натрия встречаются редко. Однако у некоторых людей может наблюдаться индивидуальная непереносимость, проявляющаяся в виде кожных высыпаний или зуда. Ацетат натрия — абсолютно безопасное вещество, относится к 4 классу по ГОСТ 12.1.007–76[9].
Ацетат натрия при попадании в организм человека быстро метаболизируется. В печени он превращается в ацетил-КоА, который затем включается в цикл Кребса для производства энергии. Этот процесс не вызывает значительных изменений в кислотно-щелочном балансе организма[8].
- Влияние на пищеварительную систему: ацетат натрия обладает слабым раздражающим действием на слизистую оболочку желудка. При употреблении в больших количествах может вызвать тошноту и диарею. Однако в обычных дозах, используемых в пищевой промышленности, не оказывает негативного воздействия[8].
- Воздействие на сердечно-сосудистую систему: исследования показывают, что внутривенное введение ацетата натрия может вызвать кратковременное снижение артериального давления и увеличение частоты сердечных сокращений. Эти эффекты обычно кратковременны и не представляют опасности для здоровых людей[8].
- Влияние на почки: ацетат натрия может увеличивать выведение натрия и воды через почки, что приводит к умеренному мочегонному эффекту. Это свойство используется в медицине для коррекции электролитного баланса[8].
Согласно Объединённому экспертному комитету ФАО/ВОЗ по пищевым добавкам (JECFA), допустимое суточное потребление ацетата натрия не ограничено. Это означает, что вещество считается безопасным при использовании в качестве пищевой добавки в рекомендуемых количествах. При вдыхании пыли ацетата натрия может возникнуть раздражение дыхательных путей. Поэтому при работе с сухим веществом рекомендуется использовать средства защиты органов дыхания.
Примечания
- ↑ 1,0 1,1 1,2 Савинкина, Е. В. Ацетат натрия (4 сентября 2023). Дата обращения: 26 сентября 2024.
- ↑ Уксусная кислота (26 июня 2023). Дата обращения: 26 сентября 2024.
- ↑ 3,0 3,1 3,2 История открытия ацетата натрия. Дата обращения: 26 сентября 2024.
- ↑ 4,0 4,1 Ацетат натрия. Дата обращения: 26 сентября 2024.
- ↑ 5,0 5,1 Ацетат натрия: получение. Дата обращения: 26 сентября 2024.
- ↑ База ГОСТ, ГОСТ Р — национальные стандарты РФ. Дата обращения: 28 сентября 2024.
- ↑ Ацетат натрия. Дата обращения: 28 сентября 2024.
- ↑ 8,0 8,1 8,2 8,3 8,4 8,5 Ацетаты натрия (Е262). Дата обращения: 28 сентября 2024.
- ↑ 9,0 9,1 9,2 Ацетат натрия ГОСТ 2080 76. Дата обращения: 28 сентября 2024.
- ↑ 10,0 10,1 10,2 10,3 10,4 Натрий уксуснокислый — реактив, востребованный промышленностью в больших количествах (29 ноября 2017). Дата обращения: 28 сентября 2024.
Данная статья имеет статус «готовой». Это не говорит о качестве статьи, однако в ней уже в достаточной степени раскрыта основная тема. Если вы хотите улучшить статью — правьте смело! |
Данная статья имеет статус «проверенной». Это говорит о том, что статья была проверена экспертом |
- Страницы с неработающими файловыми ссылками
- Химические вещества по алфавиту
- Знание.Вики:Готовые статьи по науке
- Знание.Вики:Готовые статьи по химии
- Знание.Вики:Готовые статьи по алфавиту
- Соединения натрия
- Органические соединения натрия
- Ацетаты (соли)
- Консерванты
- Классы органических соединений
- Органическая химия
- Органические ввещества
- Проверенная статья