Фибриноген
Фибриноге́н (фа́ктор свёртывания I) — растворимый гликопротеин плазмы крови, который служит основным субстратом для образования фибриновых сгустков. Этот белок циркулирует в кровотоке всех позвоночных животных и играет центральную роль в процессах гемостаза, заживления ран и воспалительных реакций[1].
Строение и биохимические свойства
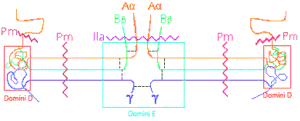
Молекула фибриногена имеет характерную удлинённую форму, напоминающую гантель с тремя соединёнными узлами. Центральный узел (E-домен) содержит переплетённые альфа-цепи, тогда как два периферических узла (D-домены) состоят из бета- и гамма-цепей. Общая длина молекулы составляет около 47,5 нанометров при диаметре соединительной нити 8-15 ангстрем[2][3].
Молекулярная масса фибриногена варьирует от 340 до 420 килодальтон, что зависит от содержания различных изоформ цепей и углеводных остатков. Белок содержит 4-10 % углеводов по массе и обладает отрицательным зарядом при физиологических значениях pH с изоэлектрической точкой около 5,5-6,5. В кровотоке фибриноген имеет период полувыведения около 4 дней, поддерживая нормальную концентрацию 150—400 мг/дл у здоровых людей[4][3].
Синтез фибриногена контролируется тремя генами — FGA, FGB и FGG, расположенными на длинном плече 4-й хромосомы. Альтернативный сплайсинг гена FGA приводит к образованию изоформы AαE, составляющей 1-3 % циркулирующего белка, а ген FGG даёт изоформу γ', представленную в 8-10 % молекул[4][3].
История открытия и изучения
Присутствие волокнистых структур в крови отмечали ещё античные врачи V—IV веков до нашей эры. Однако первое научное описание фибриновых компонентов принадлежит итальянскому анатому Марчелло Мальпиги, который в 1666 году с помощью микроскопа обнаружил волокнистые образования в сердечных тромбах[5].
Развитие терминологии происходило постепенно[5][6]:
- Термин «фибрин» впервые применил французский химик Антуан де Фуркруа в 1801 году.
- Название «фибриноген» было предложено немецким патологом Рудольфом Вирховым в 1847 году.
- Первое получение очищенного фибриногена осуществил шведский физиолог Улоф Хаммарстен в 1878 году[5][6].
Теоретические основы понимания свёртывания крови заложил российский учёный Александр Шмидт в 1872—1895 годах, разработав ферментативную теорию коагуляции. Позднее немецкий исследователь Пол Моравиц в 1905 году предложил двухэтапную модель свёртывания, которая стала классической и получила название «двухфазная модель Моравица»[3][5][6].
Биосинтез и функции в организме
Основным местом синтеза фибриногена служат гепатоциты печени. Координированная транскрипция трёх генов фибриногена усиливается при системных воспалительных состояниях под влиянием цитокинов, особенно интерлейкина-6 и интерлейкина-1β. После трансляции на эндоплазматическом ретикулуме происходит поэтапная сборка молекулы: сначала образуются димеры, затем тримеры, и наконец — гексамеры. В аппарате Гольджи белок подвергается гликозилированию, гидроксилированию и другим модификациям[6].
При повреждении сосудов тромбин расщепляет фибриноген, отщепляя фибринопептиды А и В. Это приводит к образованию фибрин-мономеров, которые самопроизвольно полимеризуются в длинные нити. Образовавшиеся фибриновые нити стабилизируются фактором XIIIa, который создаёт поперечные сшивки между молекулами. Параллельно фибриноген активирует тромбоциты через связывание с их рецептором GpIIb/IIIa[6].
Сформированный фибрин обладает тремя участками связывания тромбина, что позволяет секвестрировать избыток этого фермента и предотвращать чрезмерное свёртывание. Кроме того, фибрин ускоряет активацию плазмина в 100 раз, способствуя последующему растворению сгустка с образованием D-димеров[6].
Наследственные и приобретённые нарушения
Врождённые дефекты
Врождённые дефекты фибриногена представляют группу редких нарушений[3][6]:
- Афибриногенемия — полное отсутствие белка (менее 0,02 г/л) с тяжёлыми кровотечениями.
- Гипофибриногенемия — сниженные уровни (менее 150 мг/дл) с эпизодическими кровотечениями.
- Дисфибриногенемия — нормальные иммунологические уровни при нарушенной функции.
- Гипо-дисфибриногенемия — сочетание низких уровней и функциональных дефектов[6].
Приобретённые изменения
Вторичные нарушения коагуляционного потенциала фибриногена являются клиническим показателем, возникающим при различных патологических процессах. Приобретённая гипофибриногенемия, характеризующаяся снижением концентрации фибриногена в плазме крови ниже физиологических значений, представляет собой полиэтиологическое состояние, связанное с множеством патофизиологических механизмов. Среди ключевых причин развития приобретённой гипофибриногенемии выделяются массивные кровотечения, сопровождающиеся значительной кровопотерей и истощением запасов фибриногена[6][7].
Диссеминированное внутрисосудистое свёртывание (ДВС-синдром), представляющее собой патологическое состояние, характеризующееся генерализованным внутрисосудистым тромбообразованием и потреблением факторов свёртывания крови, также является значимым фактором, приводящим к снижению уровня фибриногена[6][7].
Сепсис, вызванный бактериальной, вирусной или грибковой инфекцией, сопровождается системным воспалительным ответом, который, в свою очередь, активирует коагуляционный каскад и способствует развитию гипофибриногенемии. Когда переливают кровь, в которой мало фибриногена — например, эритроцитарную массу или свежезамороженную плазму, — уровень фибриногена в организме может снизиться. Это происходит, если не восполнить нехватку этого важного белка[6][7].
Тяжёлые заболевания печени приводят к синтезу аномально гликозилированного фибриногена с нарушенной функциональной активностью, что может вызывать как кровотечения, так и тромботические осложнения. Криофибриногенемия характеризуется преципитацией белка при низких температурах, что может приводить к закупорке мелких сосудов и инфарктам тканей конечностей[6][7].
Клинические аспекты и лабораторная диагностика
Фибриноген относится к белкам острой фазы воспаления и его уровни значительно возрастают при инфекциях, травмах и других воспалительных состояниях. Повышение концентрации влияет на скорость оседания эритроцитов, делая этот показатель маркером воспалительной активности. Помимо гемостатической функции, фибрин помогает заживлять раны и восстанавливать повреждённые ткани. Он стимулирует рост клеток, которые называются фибробластами, а также образование новых кровеносных сосудов. Этот процесс называется ангиогенезом. Благодаря фибрину раны заживают быстрее, а повреждённые ткани восстанавливаются[7][8].
Повышенные уровни фибриногена часто наблюдаются при различных злокачественных новообразованиях, особенно при раке желудка, лёгких, простаты и яичников. Повышенное содержание фибриногена в крови может привести к образованию тромбов у людей с онкологическими заболеваниями. Это также может быть связано с появлением перемещающихся тромбов в поверхностных венах, что называется синдромом Труссо[7][8].
Во время беременности наблюдается постепенное повышение уровня фибриногена, достигающее 6 г/л к третьему триместру по сравнению с обычными 3 г/л у небеременных женщин. У новорождённых детей нормальные значения составляют 1,25-3 г/л, что отражает незрелость системы гемостаза[7][8][9].
Различные лекарственные препараты могут влиять на уровни фибриногена. Эстрогены и оральные контрацептивы повышают его концентрацию, тогда как анаболические гормоны, андрогены и омега-3 жирные кислоты оказывают противоположный эффект[8].
Для лабораторной диагностики используются[7][8]:
- Коагулологические тесты (протромбиновое время, тромбиновое время).
- Количественные методы (метод Клаусса, иммунологические тесты).
- Современные технологии (тромбоэластометрия, микроскопические методы).
Нормальные показатели фибриногена в крови составляют[7][9]:
- Взрослые мужчины и женщины: 2-4 г/л.
- Новорождённые: 1,25-3 г/л.
- Беременные (III триместр): до 6 г/л.
- Минимум для гемостаза: 0,5 г/л[9].
Литература
- Casini A, de Moerloose P, Neerman-Arbez M. Clinical Features and Management of Congenital Fibrinogen Deficiencies // Seminars in Thrombosis and Hemostasis. — 2016.
- Fish RJ, Neerman-Arbez M. Fibrinogen gene regulation // Thrombosis and Haemostasis. — 2012.
- Jiang Y, Doolittle RF. The evolution of vertebrate blood coagulation as viewed from a comparison of puffer fish and sea squirt genomes // Proceedings of the National Academy of Sciences. — 2003.
- Undas A. Acquired dysfibrinogenemia in atherosclerotic vascular disease // Journal of Thrombosis and Haemostasis. — 2011.
- Jiang Y, Doolittle RF. The evolution of vertebrate blood coagulation as viewed from a comparison of puffer fish and sea squirt genomes // Proceedings of the National Academy of Sciences. — 2003.
Примечания
- ↑ Mosesson MW. Fibrinogen and fibrin structure and functions (англ.) // Journal of Thrombosis and Haemostasis : журнал. — 2005. — No. 3 (8). — P. 1894–1904. — ISSN 1538-7836.
- ↑ Hall CE, Slayter HS. The fibrinogen molecule: its size, shape, and mode of polymerization (англ.) // The Journal of Biophysical and Biochemical Cytology : журнал. — 1959. — No. 5 (1). — P. 11–16.
- ↑ 3,0 3,1 3,2 3,3 3,4 de Moerloose P, Casini A, Neerman-Arbez M. Congenital fibrinogen disorders: an update (англ.) // Seminars in Thrombosis and Hemostasis : журнал. — 2013. — No. 39 (6). — P. 585–595. — ISSN 0094−6176.
- ↑ 4,0 4,1 Asselta R, Duga S, Tenchini ML. The molecular basis of quantitative fibrinogen disorders (англ.) // Journal of Thrombosis and Haemostasis : журнал. — 2006. — No. 4 (10). — P. 2115–2129. — ISSN 1538−7836.
- ↑ 5,0 5,1 5,2 5,3 350th Anniversary of the Discovery of Fibrin (1666-2016) History of Fibrin(ogen) (англ.). 24th International Fibrinogen Workshop (21-24 June 2016) (15 сентября 2016). Дата обращения: 19 ноября 2025.
- ↑ 6,00 6,01 6,02 6,03 6,04 6,05 6,06 6,07 6,08 6,09 6,10 6,11 Долгов В.В., Свирин П.В. Лабораторная диагностика нарушений гемостаза. — М.: Российская медицинская академия последипломного образования, 2018. — 227 с. — ISBN 5-94789-114-Х.
- ↑ 7,0 7,1 7,2 7,3 7,4 7,5 7,6 7,7 7,8 Кишкун А. А. Клиническая лабораторная диагностика. — 2-е издание. — М.: ГЭОТАР-Медиа, 2019. — 1008 с. — ISBN 978-5-9704-7424-2.
- ↑ 8,0 8,1 8,2 8,3 8,4 Davalos D, Akassoglou K. Fibrinogen as a key regulator of inflammation in disease (англ.) // Seminars in Immunopathology : журнал. — 2012. — Vol. 34, no. 1. — P. 43–62. — ISSN 1863−2297.
- ↑ 9,0 9,1 9,2 Лабораторная диагностика при беременности. Справочник врача-лаборанта. Синекс (2020). Дата обращения: 19 ноября 2025.
Ссылки
- Jennifer McDowall/Interpro: Protein Of The Month: Fibrinogen. (англ.)