Аппарат Гольджи
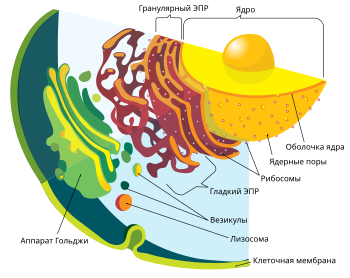
Аппара́т (ко́мплекс) Го́льджи — органелла эукариотических клеток, представляющая собой систему мембранных структур. Основная функция данного органоида заключается в экспорте веществ, произведённых в
эндоплазматической сети. Наименование этой клеточной структуры связано с именем итальянского исследователя Камилло Гольджи, который впервые описал её в 1898 году[1].
Структура
Комплекс Гольджи состоит из уплощённых мембранных цистерн, собранных в стопки. Цистерны имеют дискообразную форму с расширениями по краям и сопровождаются системой везикул. Растительные клетки характеризуются наличием множества отдельных стопок — диктиосом. В клетках животных обычно присутствует одна крупная стопка или несколько стопок, соединенных трубчатыми структурами[2].
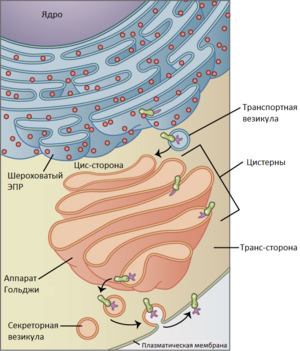
В составе комплекса Гольджи выделяют три основных отдела, окружённых мембранными везикулами:
- Цис-компартмент (проксимальный по отношению к ядру);
- Медиальный компартмент;
- Транс-компартмент (дистальный по отношению к ядру).
Каждый отдел обладает специфическим набором ферментов. Первая цистерна цис-компартмента именуется «цистерной спасения», поскольку обеспечивает возврат рецепторов из промежуточного компартмента эндоплазматического ретикулума. Ферментативная активность цис-компартмента связана с фосфогликозидазой, присоединяющей фосфат к маннозе. Медиальный компартмент содержит маннозидазу, отщепляющую маннозу, и N-ацетилглюкозаминтрансферазу, присоединяющую гликозамины. Транс-компартмент характеризуется наличием пептидазы, осуществляющей протеолиз, и трансферазы, обеспечивающей перенос химических групп.
Функции
Комплекс Гольджи выступает в роли центрального узла обработки и распределения белковых продуктов, поступающих из эндоплазматического ретикулума (ЭР). Синтезированные в ЭР белки транспортируются в комплекс Гольджи посредством везикул, которые сливаются с его мембранными структурами. После модификации в комплексе Гольджи белки, заключённые в везикулы, направляются к целевым локусам внутри клетки либо секретируются во внеклеточное пространство путём экзоцитоза.
По своей функции комплекс Гольджи аналогичен почтовому терминалу: он осуществляет упаковку и маркировку белков для их последующей доставки в различные компартменты клетки или во внеклеточный матрикс. Кроме того, комплекс Гольджи участвует в транспорте липидов и биогенезе лизосом[3].
Архитектоника комплекса Гольджи неразрывно связана с его функциональным назначением. Различные цистерны содержат специфические наборы ферментов, обеспечивая поэтапную модификацию транспортируемых белков по мере их продвижения к транс-компартменту[3].Энзиматические реакции в цистернах комплекса Гольджи локализованы исключительно вблизи мембранных поверхностей, где иммобилизованы ферменты. Этот механизм отличается от ферментативных процессов в ЭР, где растворимые белки и ферменты распределены в люминальном пространстве. Основная часть ферментативной обработки представляет собой посттрансляционную модификацию белков. В частности, фосфорилирование олигосахаридов лизосомальных белков осуществляется в начальном отделе цис-сети[3]. Цис-цистерны ассоциированы с деманнозилированием[3]. Удаление остатков маннозы и присоединение N-ацетилглюкозамина происходит в медиальных цистернах. Транс-цистерны ответственны за галактозилирование и сиалирование. Сульфатирование тирозиновых остатков и углеводных компонентов реализуется в пределах транс-сети[3].
К числу других распространённых посттрансляционных модификаций белков относятся гликозилирование[4] и фосфорилирование. Модификации белка могут формировать сигнальные последовательности, детерминирующие конечную локализацию белка. Например, комплекс Гольджи присоединяет маннозо-6-фосфатную метку к белкам, предназначенным для лизосом.
Ещё одна важная функция комплекса Гольджи заключается в синтезе протеогликанов. Ферменты Гольджи катализируют конъюгацию белков с гликозаминогликанами, формируя таким образом протеогликаны[5]. Гликозаминогликаны представляют собой линейные полисахаридные цепи, являющиеся компонентами внеклеточного матрикса животных тканей.
Перемещение субстанций из эндоплазматического ретикулума
Комплекс Гольджи характеризуется структурной асимметрией — цистерны, расположенные в непосредственной близости от клеточного ядра (цис-область Гольджи), содержат белки на ранних стадиях созревания[2]. К этим цистернам непрерывно присоединяются мембранные везикулы, отделяющиеся от шероховатого эндоплазматического ретикулума (ЭР), на мембранах которого осуществляется рибосомальный синтез белков. Трансфер белковых молекул из эндоплазматической сети (ЭС) в комплекс Гольджи происходит без селективности, однако белки с нарушенной или незавершенной укладкой остаются в пределах эндоплазматической сети. Ретроградный транспорт белков из комплекса Гольджи в ЭС требует наличия специфической сигнальной последовательности (лизин-аспарагин-глутамин-лейцин) и реализуется посредством взаимодействия этих белков с мембранными рецепторами в цис-области Гольджи.
Модификация белков в аппарате Гольджи
В цистернах комплекса Гольджи осуществляется процесс созревания различных типов белков, включая секреторные, трансмембранные белки плазмалеммы и лизосомальные белки[2]. Созревающие белки последовательно перемещаются через цистерны, где подвергаются модификациям — гликозилированию и фосфорилированию. О-гликозилирование предполагает присоединение к белкам сложных углеводов через атом кислорода. Фосфорилирование характеризуется присоединением к белкам остатка ортофосфорной кислоты.
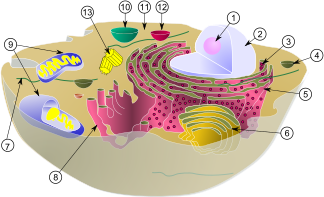
Схематическое изображение типичной животной клетки демонстрирует следующие органеллы: 1 — ядрышко; 2 — ядро; 3 — рибосома (мелкие точки); 4 — везикула; 5 — гранулярный эндоплазматический ретикулум (ЭР); 6 — комплекс Гольджи; 7 — цитоскелет; 8 — агранулярный эндоплазматический ретикулум; 9 — митохондрия; 10 — вакуоль; 11 — цитоплазма; 12 — лизосома; 13 — центриоль и центросома.
Различные цистерны комплекса Гольджи содержат специфические резидентные каталитические ферменты, что обусловливает последовательность процессов, происходящих с созревающими белками. Для контроля этого ступенчатого процесса созревающие белки «маркируются» специфическими полисахаридными остатками (преимущественно маннозными), выполняющими роль своеобразного «индикатора качества».
Механизм перемещения созревающих белков по цистернам комплекса Гольджи при относительной стабильности локализации резидентных белков остаётся не полностью выясненным. Существуют две взаимодополняющие гипотезы, объясняющие этот процесс:
- Согласно первой, транспорт белков осуществляется посредством везикулярного транспорта, аналогичного транспорту из ЭР, при этом резидентные белки не включаются в отпочковывающиеся везикулы.
- Вторая гипотеза предполагает непрерывное передвижение (созревание) самих цистерн, их формирование из везикул на одном полюсе органеллы и дезинтеграцию на другом, при этом резидентные белки перемещаются ретроградно посредством везикулярного транспорта.
Транспорт белков из комплекса Гольджи
От транс-области комплекса Гольджи отделяются везикулы, содержащие полностью сформированные белки[2]. Ключевая функция комплекса Гольджи заключается в сортировке проходящих через него белков. В данном органоиде происходит формирование трёх основных белковых потоков:
- созревание и транспорт мембранных белков;
- созревание и транспорт секреторных белков;
- созревание и транспорт лизосомальных ферментов.
Посредством везикулярного транспорта белки, прошедшие через комплекс Гольджи, доставляются к соответствующим клеточным компартментам согласно полученным в комплексе Гольджи «меткам». Механизмы этого процесса остаются не полностью изученными. Установлено, что транспорт белков из комплекса Гольджи требует участия специфических мембранных рецепторов, распознающих «груз» и обеспечивающих селективное слияние везикул с определёнными органеллами.
Формирование лизосом
Многие гидролитические ферменты лизосом проходят через комплекс Гольджи, где они приобретают специфическую метку — маннозо-6-фосфат (М6Ф) — в составе олигосахарида, присоединённого к полипептидной цепи. Процесс маркировки осуществляется при участии двух ферментов. N-ацетилглюкозаминфосфотрансфераза специфически идентифицирует лизосомальные гидролазы по особенностям их третичной структуры и присоединяет N-ацетилглюкозаминфосфат к шестому атому углерода нескольких маннозных остатков олигосахарида гидролазы. Второй фермент — фосфогликозидаза — отщепляет N-ацетилглюкозамин, формируя М6Ф-метку. Впоследствии эта метка распознаётся М6Ф-рецептором, с помощью которого гидролазы инкапсулируются в везикулы и транспортируются в лизосомы. В кислой среде лизосом фосфат отщепляется от зрелой гидролазы. При нарушении функционирования N-ацетилглюкозаминфосфотрансферазы вследствие мутаций или при генетических дефектах М6Ф-рецептора все лизосомальные ферменты по умолчанию направляются к плазматической мембране и секретируются во внеклеточное пространство. Выявлено, что в норме определённое количество М6Ф-рецепторов также локализуется на плазматической мембране. Они обеспечивают возврат случайно экстернализованных лизосомальных ферментов в клетку посредством эндоцитоза[6].
Перемещение белков к плазматической мембране
В большинстве случаев белки, предназначенные для локализации на плазматической мембране, интегрируются своими гидрофобными доменами в мембрану эндоплазматического ретикулума ещё в процессе синтеза. Впоследствии они транспортируются в составе мембран везикул в комплекс Гольджи, а оттуда — к поверхности клетки. При слиянии везикулы с плазмалеммой эти белки интегрируются в её структуру, в отличие от растворимых белков, находящихся в просвете везикулы и выделяемых во внеклеточное пространство[6].
Экзоцитоз
Практически все вещества, секретируемые клеткой (как протеиновой, так и непротеиновой природы), проходят через комплекс Гольджи, где происходит их упаковка в секреторные везикулы[7]. У растительных организмов, например, с участием диктиосом осуществляется секреция компонентов клеточной стенки.
Примечания
- ↑ Fabene P.F., Bentivoglio M. 1898–1998: Camillo Golgi and "the Golgi": one hundred years of terminological clones (англ.) // Brain Res. Bull.: journal. — 1998. — October (vol. 47, no. 3). — P. 195—198. — doi:10.1016/S0361-9230(98)00079-3. — PMID 9865849..
- ↑ 2,0 2,1 2,2 2,3 Основы клеточной физиологии : пособие / В. А. Костюк..
- ↑ 3,0 3,1 3,2 3,3 Campbell N. A. Biology (4 ed.) (англ.). — Menlo Park, CA: Benjamin/Cummings, 1996. — P. 122, 123..
- ↑ Elmouelhi N., Yarema K. J. Building on What Nature Gave Us: Engineering Cell Glycosylation Pathways (англ.) // Biotechnology and Bioengineering / ed. by W. G. Flynne. — 2008. — P. 37—73. Архивировано 3 августа 2023 года..
- ↑ Prydz K., Dalen K. T. Synthesis and sorting of proteoglycans (англ.) // Journal of Cell Science. — 2000. — Vol. 113, iss. 2. — P. 193—205. — ISSN 0021-9533. — doi:10.1242/jcs.113.2.193. — PMID 10633071..
- ↑ 6,0 6,1 Ченцов Ю. С. Цитология с элементами целлюлярной патологии: Учебное пособие для университетов и медицинских вузов. — М.: МИА, 2010. — 361 с. — 4000 экз..
- ↑ Molecular Biology Of The Cell, 4е издание, 2002 г. — учебник по молекулярной биологии на английском языке.
Ссылки
- Molecular Biology Of The Cell, 4е издание, 2002 г. — учебник по молекулярной биологии на английском языке
- Большая каталанская
- Большая китайская
- Большая норвежская
- Большая российская (старая версия)
- Ларусса
- Ларусса
- Хорватская
- Britannica (онлайн)