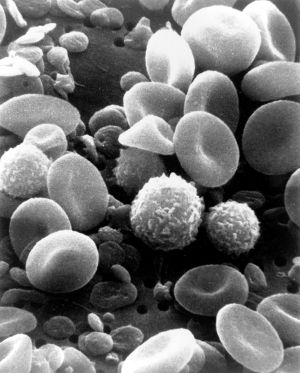
Лимфоциты
Лимфоци́ты (от «лимфа» и греч. κύτος — «вместилище», здесь — «клетка») — агранулоцитарные клетки белой крови, осуществляющие иммунный надзор и защитные реакции организма. Эти клетки циркулируют в крови и лимфе, проникают в ткани и заселяют вторичные лимфоидные органы[1]. Лимфатическая жидкость транспортирует антигены, антитела и сами лимфоциты, выполняя защитную, гомеостатическую, трофическую и метаболическую функции в организме.
Лимфоциты представляют собой единственные клетки, способные избирательно распознавать специфические антигенные структуры среди множества чужеродных молекул[1]. Морфологически лимфоциты разных типов неразличимы при световой и электронной микроскопии, однако идентифицируются иммуноцитохимическими методами благодаря различным поверхностным белкам-маркёрам[2].
Количественные и возрастные показатели
В крови взрослого человека лимфоциты составляют 20–40% всех лейкоцитов. Абсолютное содержание лимфоцитов в норме находится в диапазоне 1,5–3,5 × 109 клеток на литр крови[3].
В детском возрасте наблюдается физиологический перекрёст лейкоцитарной формулы. С пятого дня жизни до примерно пятилетнего возраста лимфоциты преобладают среди белых кровяных клеток, что связано с активным функционированием селезёнки и тимуса[3]. В составе лимфы форменные элементы занимают менее 1% объёма, при этом около 90% клеток представлено лимфоцитами, примерно 5% — моноцитами, оставшиеся 5% — прочими клетками. Эритроциты проникают в лимфу при повышенной проницаемости сосудистых стенок[4].
Субпопуляции лимфоцитов
Основные типы лимфоцитов включают Т-лимфоциты, В-лимфоциты и естественные киллеры (NK-клетки). В периферической крови человека преобладают Т-лимфоциты, тогда как В-лимфоциты и NK-клетки составляют меньшую часть лимфоцитарной популяции[5]. Каждая субпопуляция характеризуется специфическими маркёрами и рецепторами на клеточной поверхности.
В-клетки несут на своей мембране молекулы CD19–CD23, CD40, а также мембранные иммуноглобулины классов M и D[6]. Т-хелперы экспрессируют маркёр CD4 и Т-клеточный рецептор[5]. Цитотоксические Т-киллеры характеризуются присутствием CD8 и Т-клеточного рецептора. Основная популяция T-регуляторных клеток (Tregs) экспрессирует CD4, CD25 и транскрипционный фактор FoxP3. CD8-положительные регуляторные Т-клетки также описаны, но они значительно менее изучены и встречаются реже.
Естественные киллеры (NK-клетки) отличаются наличием молекул CD16 и CD56 при отсутствии специфических антиген-распознающих рецепторов[7]. На ранних стадиях развития тимоциты экспрессируют маркёр CD1, а в процессе созревания в тимусе одновременно экспрессируют CD4 и CD8. Зрелые Т-клетки покидают тимус либо как CD4-положительные хелперы, либо как CD8-положительные цитотоксические клетки.
Дифференцировочные антигены
В процессе дифференцировки лимфоцитов на их поверхности появляются специфические мембранные молекулы гликопротеидов. Такие молекулы можно обнаружить с помощью специфических моноклональных антител и идентифицировать субпопуляции лимфоцитов. Создана номенклатура дифференцировочных антигенов лейкоцитов человека, выявляемых моноклональными антителами. Эта номенклатура базируется на группах моноклональных антител, реагирующих с одними и теми же дифференцировочными антигенами[8]. При определении общей популяции Т-клеток используются моноклональные антитела специфичностей CD2, CD3, CD5, CD6 и CD7[6].
Дифференцировочные антигены Т-клеток характерны либо для определённых стадий онтогенеза, либо для различающихся по функциональной активности субпопуляций. Маркёр CD1 характеризует раннюю фазу созревания Т-клеток в тимусе. В процессе дифференцировки тимоцитов на их поверхности экспрессируются одновременно маркёры CD4 и CD8. Зрелые клетки с маркёром CD4 являются Т-хелперами. Субпопуляция клеток с маркёром CD8 включает цитотоксические Т-лимфоциты. Антитела к гликопротеинам CD4 и CD8 широко используются для того, чтобы различать и разделять Т-клетки, соответственно, на хелперы и цитотоксические клетки[9].
Естественные киллеры
Естественные киллеры составляют приблизительно 10–15% от общего числа лимфоцитов, циркулирующих в крови[10]. Морфологически эти клетки представляют собой крупные лимфоциты диаметром 12–15 мкм, обладающие дольчатым ядром и азурофильными гранулами в цитоплазме. По этой причине их также называют большими гранулярными лимфоцитами.
Функция естественных киллеров заключается в быстром лизисе (уничтожении) клеток-мишеней без предварительной сенсибилизации, что обеспечивает врождённую защиту[11]. Механизм распознавания основан на том, что клетки с пониженной или утраченной экспрессией молекул главного комплекса гистосовместимости I класса не активируют ингибирующие рецепторы естественных киллеров. В результате торможение снимается, и клетка-мишень подвергается лизису. Естественные киллеры атакуют инфицированные вирусами клетки, трансплантированные ткани и опухолевые клетки. У онкологических больных отмечается снижение активности естественных киллеров[12].
Развитие и дифференцировка
Антигеннезависимая стадия
Антигеннезависимая стадия развития лимфоцитов происходит в первичных органах иммунной системы. В-клетки и естественные киллеры образуются и проходят полное созревание в красном костном мозге. Предшественники Т-клеток, не несущие маркёров CD4 и CD8, мигрируют из костного мозга в тимус, где завершают своё созревание. Благодаря роли, которую костный мозг и тимус играют в образовании и созревании лимфоцитов, эти органы классифицируются как центральные органы кроветворения[13].
Регуляция развития В-клеток осуществляется под действием интерлейкинов с первого по седьмой. Для созревания Т-клеток в тимусе необходимы контакты со стромальными клетками, гемопоэтины (колониестимулирующие факторы, интерлейкины 1 и 6), а также специфические тимусные факторы — тимозин, тимопоэтин, тимусный сывороточный фактор и другие. Тимус выполняет не только иммунную, но и эндокринную функцию, вырабатывая гормоны тимозин, тимопоэтин, плазменный фактор тимуса и гуморальный фактор тимуса.
Микроокружение тимуса
Микроокружение тимуса формируется несколькими типами клеток, среди которых ведущую роль играют ретикулоэпителиальные клетки. Строму лимфоидной ткани тимуса образуют эпителиоретикулярные клетки, макрофаги, в том числе дендритные клетки. Ретикулоэпителиальные клетки имеют эпителиальное происхождение и в ходе эмбрионального развития приобретают звёздчатую форму, сохраняя связи отростками через десмосомы.
Различают несколько типов эпителиоретикулярных клеток, выполняющих разные функции: опорную, секреторную (выделяют гуморальный фактор тимуса, тимулин, тимопоэтин и тимозин), обучение Т-лимфоцитов (клетки-няньки) и образование гемато-тимусного барьера. Гемато-тимусный барьер включает эпителиоретикулярную клетку, базальную мембрану эпителиоретикулярной клетки, соединительную ткань с макрофагами, базальную мембрану эндотелия и эндотелий сосудов. Роль барьера заключается в изоляции незрелых Т-лимфоцитов, которые ещё не научились отличать собственные клетки от чужеродных[4].
Тимус представляет собой паренхиматозный орган, снаружи покрытый капсулой, от которой отходят соединительнотканные перегородки, не полностью делящие орган на дольки. Каждая долька содержит корковое и мозговое вещество. Паренхиму тимуса составляют Т-лимфоциты, проходящие антигеннезависимую дифференцировку.
В корковом веществе сразу под капсулой выделяют подкапсулярную зону, где преобладают лимфобласты, пришедшие из красного костного мозга. Лимфоциты проходят антигеннезависимую дифференцировку, перемещаясь от наружных слоёв коры до мозгового вещества. Тимоциты, контактируя с клетками-няньками, получают информацию о главном комплексе гистосовместимости I класса нормальной клетки собственного организма.
В мозговом веществе лимфоциты расположены менее плотно, поэтому оно имеет более светлую окраску. Гемато-тимусный барьер в мозговом веществе отсутствует. Лимфоциты могут циркулировать по организму и возвращаться в тимус, образуя рециркулирующий пул. В мозговом веществе присутствуют макрофаги и дендритные клетки, которым отводится центральное место в отрицательной селекции лимфоцитов. Характерными структурами мозгового вещества являются тельца Гассаля — слоистые концентрические эпителиальные структуры, иногда имеющие признаки ороговения. Тельца Гассаля периодически фагоцитируются макрофагами и секретируют цитокины[4].
Положительная и отрицательная селекция
Последовательность созревания унипотентных предшественников включает стадии лимфобласта (соответствует большому лимфоциту), незрелого среднего лимфоцита и зрелого малого лимфоцита. В корковом веществе тимуса тимоциты проходят положительную селекцию, в ходе которой отбраковывается до 95% клеток, не способных распознать комплексы главной системы гистосовместимости[4].
В мозговом веществе происходит отрицательная селекция, при которой элиминируются лимфоциты, распознающие собственные антигены организма. Не прошедшие отбор тимоциты подвергаются апоптозу и фагоцитируются макрофагами. Регуляцию этого процесса осуществляют Т-регуляторные (Т-супрессорные) клетки.
Миграция Т-лимфоцитов
Прошедшие дифференцировку Т-лимфоциты поступают в посткапиллярные венулы на границе коркового и мозгового вещества. Посткапиллярные венулы органов иммунной системы имеют необычные эндотелиальные клетки кубической формы. Из тимуса выходят наивные Т-лимфоциты, готовые к встрече с антигеном, но ещё не встречавшиеся с ним. Эти клетки мигрируют из первичных органов кроветворения во вторичные.
Поступающие в тимус артерии ветвятся на междольковые, внутридольковые, а затем дуговые сосуды. Дуговые артерии распадаются до капилляров, образующих глубокую сеть в коре. Большая часть капилляров продолжается в субкапсулярные венулы. Меньшая часть корковых капилляров на границе с мозговым веществом переходит в посткапиллярные венулы с высоким эндотелием, через которые осуществляется рециркуляция лимфоцитов.
Инволюция тимуса
С возрастом тимус подвергается обратному развитию. Возрастная инволюция заключается в уменьшении массы органа, снижении производства Т-лимфоцитов, замене коркового вещества белой жировой тканью. Паренхима тимуса уменьшается, границы между корковым и мозговым веществом постепенно исчезают, перегородки между дольками утолщаются, тельца Гассаля увеличиваются в количестве и размере.
Различают также акцидентальную инволюцию — обратное развитие тимуса в ответ на стресс под влиянием кортизола. Акцидентальная инволюция сопровождается массовой гибелью лимфоцитов, а также увеличением количества и размеров телец Гассаля. В отличие от возрастной инволюции, после окончания действия стресс-фактора количество лимфоцитов восстанавливается начиная с 3–4 суток[4].
Активация и эффекторные функции
Антигензависимая стадия развития начинается после встречи зрелых лимфоцитов с антигеном в периферических лимфоидных органах. Наивные лимфоциты проходят бласттрансформацию, превращаясь в иммунобласты, и дифференцируются в эффекторные клетки. В процессе активации формируются долгоживущие клетки памяти[4].
В-клетки проходят путь дифференцировки через стадии проплазмоцита и плазмоцита. Плазматические клетки специализируются на секреции антител, обеспечивая гуморальный иммунитет. Параллельно формируется популяция В-клеток памяти, способных к быстрому ответу при повторной встрече с антигеном[4].
Т-клетки дифференцируются в несколько функциональных типов. Т-киллеры выступают эффекторами клеточного иммунитета, непосредственно уничтожая изменённые клетки. Т-хелперы ускоряют бласттрансформацию В-клеток и Т-клеток, усиливая как гуморальные, так и клеточные иммунные реакции. Т-регуляторы тормозят избыточные иммунные реакции, предотвращая повреждение собственных тканей. Формируются также Т-клетки памяти, обеспечивающие долговременный иммунитет[4].
Т-амплифайеры (Т-индукторы) — термин, использовавшийся в ранних классификациях Т-лимфоцитов. Подобно Т-хелперам, они активируют гуморальный и клеточный иммунитет. В отличие от хелперов, которые действуют через лимфокины (с задержкой 8–14 часов)[4], Т-индукторы запускают иммунный ответ посредством прямых рецепторных контактов, что происходит примерно в течение одного часа. В современной литературе их функции относят к подтипам Т-хелперов (Th1 и Th2).
Распознавание антигенов
Рецепторы на поверхности лимфоцитов играют основную роль в распознавании эпитопов антигенов и в запуске иммунных реакций. В-лимфоциты способны распознавать антигены, находящиеся на клеточной поверхности. Т-лимфоциты распознают только эпитопы, формирующие комплексы с особыми белками клеточной поверхности других клеток — белками главного комплекса гистосовместимости[1].
Мигрирующие в тимус незрелые Т-клетки приобретают способность реагировать на стимулы микроокружения, пролиферируют и трансформируются в Т-лимфоциты, несущие характерные мембранные антигены. Часть Т-лимфоцитов погибает в тимусе, причём гибель части лимфоцитов является генетически запрограммированной[14].
Периферические лимфоидные органы и рециркуляция
Периферические лимфоидные органы включают селезёнку, лимфатические узлы, солитарные лимфоидные узелки, миндалины, червеобразный отросток и пейеровы бляшки подвздошной кишки. Клетки иммунной системы распределены по всему организму, они находятся в крови, лимфе, эпителиальных и соединительных тканях, формируют мелкие сферические скопления — лимфоидные узелки, которые обнаруживаются в соединительной ткани и внутри некоторых органов[15].
Широкое распространение клеток иммунной системы и постоянное перемещение лимфоцитов с кровью и лимфой через соединительные ткани и лимфоидные органы обеспечивают организм обширной и эффективной системой надзора и защиты. Лимфоидные узелки и изолированные клетки иммунной системы, которые обнаруживаются в слизистой оболочке пищеварительной, дыхательной, репродуктивной и выделительной систем, в совокупности рассматриваются как лимфоидная ткань, ассоциированная со слизистыми оболочками (MALT)[16]. Из костного мозга и тимуса лимфоциты мигрируют в периферические органы и заселяют, соответственно, В-зоны и Т-зоны, где при встрече с антигеном превращаются в зрелые иммунные лимфоциты[15].
Внутриутробное развитие
Кроветворение в селезёнке начинается с середины третьего месяца эмбрионального развития. Во второй половине беременности в селезёнке преобладает лимфоцитопоэз, хотя изначально там развиваются разные клеточные линии[4].
Со второго месяца внутриутробного развития в тимусе запускается кроветворение, направленное на дифференцировку Т-лимфоцитов. На 9–10-й неделе в лимфатических узлах начинается кроветворение других линий, включающих эритроциты, гранулоциты и мегакариоциты, однако образование лимфоцитов быстро подавляет эти процессы[4].
С третьего месяца начинается кроветворение в красном костном мозге. К концу внутриутробного периода красный костный мозг становится окончательным органом кроветворения, сохраняя эту функцию на протяжении всей жизни человека. В дальнейшем красный костный мозг обеспечивает постоянную продукцию предшественников всех типов лимфоцитов[4].
Клиническое значение
Относительный лимфоцитоз диагностируется при содержании лимфоцитов более 40% среди всех лейкоцитов крови[3]. Это состояние наблюдается при вирусных инфекциях — острых респираторных заболеваниях, токсоплазмозе, герпесе, краснухе, инфекции, вызванной вирусом иммунодефицита человека[17]. Относительный лимфоцитоз характерен для острых и хронических лейкозов. Повышение доли лимфоцитов отмечается при отравлениях свинцом и мышьяком, а также при приёме некоторых лекарственных препаратов, включая наркотические анальгетики.
Лимфопения развивается вследствие нарушений развития лимфоидной системы, торможения лимфоцитопоэза или ускоренной гибели лимфоцитов. При острых инфекциях лимфопения возникает на фоне усиления гранулоцитопоэза. Снижение числа лимфоцитов отмечается при хронических инфекциях, врождённых и приобретённых иммунодефицитах — агаммаглобулинемии швейцарского типа, ретикулярной дисгенезии, иммунодефиците с тимомой, синдроме Ди Джорджи, синдроме приобретённого иммунодефицита. Лимфопения характерна для болезни Ходжкина, лейкозов, множественной миеломы.
Воздействие ионизирующей радиации приводит к снижению количества лимфоцитов[18]. Терапия глюкокортикоидами сопровождается уменьшением числа лимфоцитов в крови. Лимфопения развивается при хронических заболеваниях печени, при тяжёлых отёках и при потере лимфоцитов через кишечник[19]. Среди провоцирующих факторов выделяют аспарагиназу, соли лития, никотиновую кислоту, антилимфоцитарную сыворотку и рентгеновское облучение.
Примечания
- ↑ 1,0 1,1 1,2 Ярилин А. А. Иммунология: учебник. — М.: ГЭОТАР-Медиа, 2010. — С. 31–35.
- ↑ Yoon J., Jo Y., Kim Mh. et al. Identification of non-activated lymphocytes using three-dimensional refractive index tomography and machine learning (англ.). — Sci Rep, 2017. — P. 7. — 6654 p.
- ↑ 3,0 3,1 3,2 Стуклов, Н. И., Козинец, Г. И., Тюрина Н. Г. Учебник по гематологии. — М., 2018. — С. 41. — 336 с. — (Практическая медицина). — ISBN 978-5-98811-492-5.
- ↑ 4,00 4,01 4,02 4,03 4,04 4,05 4,06 4,07 4,08 4,09 4,10 4,11 Шабалева, М. А., Бондаренко, Н. Ю. Кровь. Кроветворение. Органы кроветворения и иммунной защиты : учебно-методическое пособие. — Гомель: ГомГМУ, 2021. — С. 24.
- ↑ 5,0 5,1 Зеленко Г. А., Бондаренко Н. Ю., Солодова Е. К. Клеточные основы иммунных реакций: учебно-методическое пособие. — Гомель: ГомГМУ, 2012. — С. 32. — ISBN 978-985-506-452-8.
- ↑ 6,0 6,1 Снимщикова И. А. Курс лекций по общей иммунологии. — Орёл: Орловский государственный университет (ОГУ), 2015. — С. 65. — 122 с.
- ↑ Москалёв А. В., Сбойчаков В. Б., Рудой А. С. Общая иммунология с основами клинической иммунологии: учеб. пособие. — М.: ГЭОТАР-Медиа, 2015. — С. 170–171. — 352 с. — ISBN 978-5-9704-3382-9.
- ↑ Фильченков А. А., Глузман Д. Ф., Ивановская Т. С. Новые дифференцировочные антигены нормальных и неопластических кроветворных и лимфоидных клеток (по материалам международных рабочих совещаний HLDA9 и HLDA10). — 2019. — Т. 21. — (Онкология).
- ↑ Климов В. В. Основы иммунологии: учебное пособие. — Томск: Изд-во СибГМУ, 2017. — С. 114. — 169 с. — ISBN 978-5-98591-130-5.
- ↑ Rahman M., Bordoni B. Histology, Natural Killer Cells (англ.). — National Library of Medicine, 2023.
- ↑ Михайлова В. А., Сельков С. А., Соколов Д. И. Фенотипические и функциональные характеристики NK-клеток при беременности // Акушерство и гинекологи. — 2011. — № 5.
- ↑ Кадагидзе З. Г., Короткова О. В., Заботина Т. Н., Ли Дапэн. Влияние Канглайта на иммунологические показатели онкологических больных // Эффективная фармакотерапия. Онкология, гематология и радиология.. — № 2.
- ↑ Мельниченко Ю. М., Кабак С. Л., Заточная В. В., Мащенко И. В. Частная гистология: практикум. — Минск: БГМУ, 2024. — С. 11–12. — 88 с. — ISBN 978-985-21-1715-9.
- ↑ Хаитов Р. М., Игнатьева Г. А., Сидорович И. Г. Иммунология: Учебник. — М.: Медицина, 2000. — С. 120–121. — 432 с. — ISBN 5-225-04543-Х.
- ↑ 15,0 15,1 Сапин М. Р., Никитюк Д. Б., Николенко В. Н., Чава С. В. Анатомия человека: в двух томах. Т. II: учебник / под ред. Сапина М. Р.. — М.: ГЭОТАР-Медиа, 2012. — С. 456.
- ↑ Овсянников Д. Ю., Кузьменко Л. Г., Гришина Т. И. и др. Основы клинической иммунологии и аллергологии детского возраста: учебное пособие / под ред. Овсянникова Д. Ю.. — М., 2022. — С. 136. — 27–46 с. — ISBN 978-5-00202-016-4.
- ↑ Агзамходжаев Т. С. Клиническая лабораторная диагностика и методы исследования. — Ташкент: «Навруз», 2014. — С. 144. — ISBN 978-9943-381-31-5.
- ↑ Гребенюк А. Н., Легеза В. И., Евдокимов В. И., Салухов В. В., Тимошевский А. А. Радиационная медицина : учеб. пособие / под. ред. Алексанина С. С., Гребенюка А. Н.. — СПб.: Всерос. центр. экстрен. и радиац. медицины им. А.М. Никифорова МЧС России, 2013. — С. 10–11. — 156 с.
- ↑ Парфёнов А. И., Крумс Л. М. Энтеропатия с потерей белка. — 2017. — Т. 89. — (Терапевтический архив).