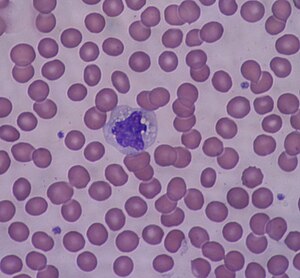
Моноциты
Моноци́ты (от греч. μονος — «один» и греч. κύτος — «вместилище», «клетка») — высокоспециализированные лейкоциты, выполняющие ключевые функции в системе врождённого иммунитета позвоночных[1]. Эти клетки характеризуются уникальной способностью к трансформации в различные типы эффекторных элементов, что делает их центральным звеном в поддержании иммунного гомеостаза и развитии воспалительных реакций.
Морфобиологическая характеристика
Размерные параметры и структурная организация
Моноциты отличаются значительными размерными характеристиками среди всех циркулирующих лейкоцитов. В фиксированных препаратах крови их диаметр может достигать 18—20 мкм[2], что существенно превышает размеры других белых клеток крови. В нативном состоянии в капле крови размеры этих клеток варьируют от 9 до 12 мкм, демонстрируя выраженную пластичность клеточной мембраны.
Амёбоидная морфология моноцитов обеспечивает их высокую подвижность и способность к активной миграции через тканевые барьеры. Клетки способны изменять свою форму в зависимости от функциональных потребностей, что особенно важно при прохождении через эндотелиальные барьеры и межклеточные пространства. Поверхность моноцитов покрыта многочисленными микроворсинками и псевдоподиями, которые увеличивают площадь контакта с окружающей средой и способствуют эффективному взаимодействию с другими клетками и растворимыми факторами.
Классификация моноцитов как агранулоцитов основана на отсутствии специфических гранул, характерных для нейтрофилов, эозинофилов и базофилов. Однако это не означает полного отсутствия гранулярных структур — моноциты содержат азурофильные гранулы, которые представляют собой первичные лизосомы и играют важную роль в переваривании фагоцитированного материала.
Ядерная архитектура
Ядерный аппарат моноцитов демонстрирует характерные морфологические особенности[3], отличающие их от других мононуклеарных клеток. Ядро имеет эллипсоидальную конфигурацию с выраженной дольчатостью, часто приобретая бобовидную или подковообразную форму. Такая конфигурация связана с активными процессами хроматиновой перестройки, которые сопровождают функциональную активацию клеток.
Хроматиновая структура характеризуется меньшей степенью конденсации по сравнению с лимфоцитами, что обеспечивает высокую транскрипционную активность этих клеток. Эухроматин преобладает над гетерохроматином, что отражает активный метаболический статус моноцитов. Гетерохроматин располагается преимущественно под ядерной мембраной в виде отдельных зёрен, рассеянных по всему ядру.
В ядерной структуре обычно выявляется одно или несколько мелких ядрышек, свидетельствующих об активном белковом синтезе. Размер и количество ядрышек могут изменяться в зависимости от функционального состояния клетки — при активации моноцитов ядрышки увеличиваются, что отражает усиление рибосомального биогенеза.
Ядерная мембрана моноцитов содержит многочисленные поры, обеспечивающие интенсивный транспорт между ядром и цитоплазмой. Количество ядерных пор превышает таковое в покоящихся лимфоцитах, что коррелирует с высокой метаболической активностью моноцитов.
Цитоплазматическая организация
Цитоплазматический компартмент моноцитов обладает рядом уникальных характеристик[2]. По сравнению с лимфоцитами, цитоплазма менее базофильна и при окрашивании по методу Романовского—Гимзе приобретает характерный бледно-голубой оттенок. Эта особенность связана с меньшим содержанием рибосом по сравнению с плазматическими клетками, но значительно большим, чем в зрелых лимфоцитах.
Особенностью является наличие многочисленных азурофильных гранул, представляющих собой лизосомальные структуры, которые придают цитоплазме синевато-серый оттенок. Эти гранулы содержат широкий спектр гидролитических ферментов, включая кислую фосфатазу, пероксидазу, эстеразы и арилсульфатазы. Количество и размер лизосом увеличиваются при функциональной активации клеток.
Клетки способны формировать пальцевидные цитоплазматические выросты и специализированные фагоцитозные вакуоли, что отражает их активную функциональную специализацию. Фагоцитозные вакуоли могут сливаться с лизосомами, образуя фаголизосомы — специализированные органеллы для переваривания поглощённого материала.
Митохондрии в моноцитах относительно небольшие, но многочисленные, что обеспечивает высокие энергетические потребности клеток. Эндоплазматический ретикулум представлен как гладкими, так и шероховатыми мембранами, причём последние особенно развиты у активированных клеток. Аппарат Гольджи хорошо развит и активно участвует в формировании лизосом и секреторных везикул.
Цитоскелет моноцитов высоко динамичен и включает актиновые филаменты, микротрубочки и промежуточные филаменты. Актиновая система особенно важна для формирования псевдоподий и обеспечения клеточной подвижности. Микротрубочки участвуют в организации внутриклеточного транспорта и позиционировании органелл.
Онтогенетические аспекты и жизненный цикл
Гемопоэтическое происхождение
Формирование моноцитарной популяции происходит в костномозговом микроокружении из специализированных предшественников — промоноцитов[2]. Эти бипотентные клетки дифференцируются от гемопоэтических стволовых элементов в процессе моноцитопоэза. Монобласты служат наиболее ранними морфологически идентифицируемыми предшественниками, от которых через промежуточные стадии развиваются зрелые моноциты, готовые к выходу в периферическую циркуляцию.
Циркуляторная динамика
Период пребывания моноцитов в сосудистом русле составляет от 36 до 104 часов[2], что значительно превышает время циркуляции других гранулоцитов. Этот относительно продолжительный период позволяет клеткам осуществлять эффективное патрулирование сосудистого русла и своевременно реагировать на появление патогенных агентов. После завершения циркуляторной фазы моноциты мигрируют в периферические ткани, где претерпевают окончательную дифференцировку в резидентные макрофаги или дендритные клетки.
Тканевое распределение
Значительная часть моноцитарного пула организма локализуется вне сосудистого русла. Примерно половина всех моноцитов взрослого человека сосредоточена в селезёнке[4], где они располагаются в красной пульпе в области трабекулярных структур Бильрота. Этот селезёночный резерв играет важную роль в быстрой мобилизации моноцитов при развитии системных воспалительных реакций и может служить источником клеток для экстренного пополнения циркулирующего пула.
Функциональная стратификация популяций
- Классическая субпопуляция
Доминирующую фракцию циркулирующих моноцитов составляют классические моноциты, на долю которых приходится до 85 % от общего числа[1]. Эти клетки характеризуются фенотипом CD14++CD16- и экспрессируют хемокиновый рецептор CCR2, обеспечивающий их миграцию к источникам моноцитарного хемоаттрактантного белка-1. Классические моноциты несут обширный набор паттерн-распознающих и скавенджер-рецепторов, что позволяет им эффективно идентифицировать и фагоцитировать микробные агенты. Характерной особенностью является способность к секреции больших количеств антимикробных пептидов и генерации активных форм кислорода.
- Промежуточная субпопуляция
Промежуточные моноциты представляют небольшую, но функционально значимую фракцию, составляющую около 5 % от общего числа и проявляющую выраженную способность к продукции провоспалительных цитокинов[5]. Фенотипически они характеризуются как CD14++CD16+ и экспрессируют хемокиновые рецепторы CCR5 и CX3CR1. Особенностью этих клеток является секреция фактора некроза опухоли и интерлейкина-1β, что определяет их роль в развитии воспалительных реакций. Промежуточные моноциты функционируют как антигенпрезентирующие клетки благодаря экспрессии молекул главного комплекса гистосовместимости II класса и CD74.
- Неклассическая субпопуляция
Неклассические моноциты составляют примерно 10 % циркулирующего пула и специализируются на патрулирующей функции в сосудистом русле[1]. Их фенотип CD14+CD16++ отражает уникальную функциональную специализацию. Способность к адгезии с эндотелиальными клетками через рецептор CX3CR1 позволяет им осуществлять постоянное сканирование сосудистой стенки на предмет повреждений или присутствия патогенов. Характерной особенностью является преимущественная активация вирусными антигенами через Toll-подобные рецепторы 7 и 8, что отличает их от реакции на бактериальные компоненты.
Иммунологические механизмы
- Врождённый иммунный ответ
Моноциты функционируют как ключевые эффекторы врождённой иммунной системы, обладая широким спектром паттерн-распознающих рецепторов и хемокиновых рецепторов[1]. Эта рецепторная оснащённость обеспечивает способность к распознаванию молекулярных паттернов, ассоциированных с патогенами, и направленной миграции в очаги воспаления. Секреция провоспалительных цитокинов и активное участие в фагоцитарных процессах делают их незаменимыми в первичном иммунном ответе. Фагоцитоз может осуществляться как через опсонизирующие белки, так и посредством прямого распознавания микробных структур.
- Адаптивный иммунный интерфейс
Способность к дифференцировке в дендритные клетки может быть воспроизведена в условиях культивирования при добавлении гранулоцитарно-макрофагального колониестимулирующего фактора и интерлейкина-4[6]. Однако следует отметить, что полученные таким образом клетки сохраняют характерные черты моноцитарного транскриптома и не являются истинными дендритными клетками. В физиологических условиях моноциты мигрируют в лимфатические узлы, где активируют CD4+ и CD8+ T-лимфоциты через представление антигенов в составе молекул главного комплекса гистосовместимости.
- Регуляторные контуры
Активированные моноциты демонстрируют экспрессию рецептора программируемой смерти-1, взаимодействие которого с лигандом PD-L1 индуцирует продукцию интерлейкина-10[7]. Этот механизм способствует активации T-хелперов типа Th2 и ингибированию T-хелперов типа Th1, создавая важный регуляторный контур в иммунном ответе. Продукция фактора некроза опухоли и интерлейкина-12 дополняет спектр цитокиновых эффектов, обеспечивая тонкую настройку иммунных реакций.
Тканевая дифференцировка
- Макрофагальная трансформация
При миграции в ткани моноциты претерпевают значительные морфофункциональные изменения, трансформируясь в тканевые макрофаги. Однако производные клетки сохраняют характерные черты моноцитарного транскриптома[8], что указывает на сохранение молекулярной памяти о клеточном происхождении. Макрофаги приобретают большое гладкое ядро и обширную цитоплазматическую область, заполненную многочисленными везикулярными структурами для процессинга чужеродного материала. Часть макрофагальной популяции формируется ещё в пренатальном периоде в желточном мешке и фетальной печени.
- Специализированные производные
Моноцитарные предшественники дают начало разнообразным специализированным клеткам, включая остеокласты и микроглию. При беременности моноциты периферической крови играют особую роль в регуляции иммунного ответа и контроле развития плаценты[9]. Характерной особенностью моноцитов у беременных является усиленная адгезия к эндотелию и способность к формированию макрофагального пула в децидуальной оболочке матки после миграции из сосудистого русла.
Патофизиологические корреляции
- Гиперпролиферативные состояния
Моноцитоз диагностируется при превышении количества моноцитов в крови свыше 800—1000 клеток на мм3[10] и может наблюдаться при различных патологических процессах. Хронические заболевания, бактериальные и протозойные инфекции часто сопровождаются увеличением моноцитарного пула. Онкологические процессы, саркоидоз и коллагенозы также характеризуются моноцитарной гиперплазией, отражающей активацию макрофагального звена иммунитета.
- Метаболические дисрегуляции
Сахарный диабет ассоциируется с характерными изменениями в моноцитарной популяции[11], что связано с нарушением гемопоэтической регуляции в условиях метаболических расстройств. Синдром Кушинга и другие эндокринопатии также могут сопровождаться количественными и качественными изменениями моноцитов. Иммуно-опосредованные заболевания часто характеризуются дисбалансом различных субпопуляций моноцитов.
- Стресс-индуцированные изменения
Хронический вариабельный стресс активирует гемопоэтические стволовые клетки, что приводит к увеличению продукции моноцитов[12]. Этот феномен отражает эволюционно сформированную связь между стрессорными воздействиями и активацией иммунной системы. Медиаторы стресса, включая метаболиты арахидоновой кислоты, лейкотриен B4 и N-формилированные олигопептиды, могут непосредственно влиять на функциональную активность моноцитов.
Кардиоваскулярная патология
Атеросклеротические процессы
При атеросклерозе наблюдается характерное увеличение количества моноцитов, особенно популяции с высокой экспрессией Ly-6C[13]. Эти клетки мигрируют в атеросклеротические бляшки и дифференцируются в макрофаги, способствуя прогрессированию атеросклеротического процесса. Промежуточные моноциты демонстрируют особую склонность к инфильтрации сосудистой стенки и могут служить предикторами неблагоприятных кардиоваскулярных событий.
Окисленные липопротеины низкой плотности служат мощными хемоаттрактантами для моноцитов и способствуют их адгезии к эндотелию. После проникновения в интиму сосудов моноциты трансформируются в макрофаги, которые активно поглощают липиды и превращаются в пенистые клетки — основной компонент атеросклеротических бляшек.
Эндотелиальная дисфункция, возникающая на ранних стадиях атеросклероза, характеризуется повышенной экспрессией молекул адгезии (VCAM-1, ICAM-1) и хемокинов (MCP-1, IL-8), что способствует привлечению и активации моноцитов. Нарушение барьерной функции эндотелия облегчает проникновение моноцитов в сосудистую стенку.
Металлопротеиназы, продуцируемые активированными макрофагами в атеросклеротических бляшках, способствуют деградации внеклеточного матрикса и дестабилизации бляшек. Это может приводить к разрыву бляшки и развитию острых коронарных синдромов.
Сердечно-сосудистые риски
Повышенное содержание CD14++CD16+ моноцитов рассматривается как независимый фактор риска развития сердечно-сосудистых осложнений[14]. Эти клетки проявляют повышенную адгезивность к эндотелию и способность к продукции провоспалительных медиаторов, что способствует развитию эндотелиальной дисфункции. У пациентов, направляемых на коронарную ангиографию, количественная оценка промежуточных моноцитов может служить дополнительным прогностическим маркёром.
Классические факторы риска сердечно-сосудистых заболеваний (курение, артериальная гипертензия, дислипидемия, сахарный диабет) могут модулировать функции моноцитов. Курение приводит к активации моноцитов и повышению продукции провоспалительных цитокинов, что ускоряет развитие атеросклероза.
Артериальная гипертензия сопровождается хроническим воспалением сосудистой стенки с участием моноцитов и макрофагов. Ангиотензин II может непосредственно активировать моноциты через AT1-рецепторы, способствуя продукции активных форм кислорода и провоспалительных цитокинов.
Семейный анамнез сердечно-сосудистых заболеваний может быть связан с генетическими вариантами, влияющими на функции моноцитов. Полиморфизмы в генах, кодирующих рецепторы хемокинов, цитокины и их рецепторы, могут влиять на предрасположенность к атеросклерозу.
Инфекционные синдромы
Сепсис и системное воспаление
При развитии сепсиса наблюдается характерное увеличение популяции CD14+CD16++ моноцитов[15], что отражает системную активацию иммунной системы в ответ на бактериальную инвазию. Эти клетки демонстрируют изменённый функциональный профиль и могут служить маркёром тяжести септического процесса. Дисбаланс различных субпопуляций моноцитов при сепсисе связан с нарушением иммунного гомеостаза и может влиять на прогноз заболевания.
Синдром системного воспалительного ответа (SIRS) характеризуется массивной активацией моноцитов и продукцией провоспалительных цитокинов. Избыточная продукция TNF-α, IL-1β и IL-6 может приводить к развитию септического шока и полиорганной недостаточности.
Иммунопаралич — состояние, которое может развиваться после начальной фазы гиперактивации при сепсисе. Моноциты становятся гипореактивными к бактериальным стимулам, что повышает риск вторичных инфекций. Снижение экспрессии HLA-DR на моноцитах служит маркёром иммунопаралича.
Грамположительные и грамотрицательные бактерии активируют моноциты через различные паттерн-распознающие рецепторы. Липополисахарид грамотрицательных бактерий распознаётся TLR4, в то время как пептидогликан грамположительных бактерий активирует TLR2.
Эндотоксинемия, характерная для сепсиса, вызванного грамотрицательными бактериями, приводит к массивной активации моноцитов через TLR4/MD2/CD14 комплекс. Это может приводить к развитию эндотоксинового шока с характерными гемодинамическими нарушениями.
Вирусные инфекции
Особенности активации моноцитов при вирусных инфекциях связаны с преимущественным вовлечением Toll-подобных рецепторов 7 и 8, что отличает их реакцию от ответа на бактериальные антигены[16]. При COVID-19 моноцитарные клетки могут вносить значительный вклад в тяжесть течения и прогрессирование заболевания, что связано с их способностью к массивной продукции провоспалительных цитокинов.
Вирус гриппа активирует моноциты через TLR7 и TLR8, что приводит к продукции интерферонов типа I и провоспалительных цитокинов. Избыточная активация может способствовать развитию цитокинового шторма, особенно опасного при пандемических штаммах гриппа.
Вирус иммунодефицита человека может инфицировать моноциты через рецепторы CD4 и корецепторы CCR5 или CXCR4. Инфицированные моноциты могут служить резервуаром вируса и способствовать его диссеминации в различные ткани, включая центральную нервную систему.
Цитомегаловирус также может инфицировать моноциты и влиять на их дифференцировку в макрофаги и дендритные клетки. Это может приводить к нарушению антивирусного иммунитета и способствовать хронизации инфекции.
Респираторно-синцитиальный вирус может вызывать выраженную воспалительную реакцию с участием моноцитов, особенно у детей раннего возраста. Избыточная активация моноцитов может способствовать развитию бронхиолита и дыхательной недостаточности.
Онкогематологические нарушения
Хронический миеломоноцитарный лейкоз
Хронический миеломоноцитарный лейкоз представляет собой клональное гематологическое заболевание, характеризующееся злокачественной пролиферацией моноцитарных элементов[17]. Диагностическим критерием служит персистирующее увеличение моноцитов свыше 1000 клеток на микролитр крови. Характерной особенностью является преобладание классических моноцитов при практически полном отсутствии неклассической субпопуляции.
Заболевание относится к группе миелодиспластических/миелопролиферативных новообразований и характеризуется клональными цитогенетическими аномалиями. Наиболее частыми являются мутации в генах TET2, SRSF2, ASXL1 и CBL, которые влияют на дифференцировку и апоптоз гемопоэтических клеток.
Клиническая картина ХММЛ включает прогрессирующую анемию, тромбоцитопению, спленомегалию и повышенную склонность к инфекциям. Моноцитоз может сопровождаться появлением незрелых форм — промоноцитов, метамиелоцитов и миелоцитов.
Прогноз заболевания варьирует в зависимости от цитогенетических аномалий и молекулярных маркёров. Неблагоприятными прогностическими факторами являются комплексные цитогенетические аберрации, мутации ASXL1 и высокая бластная инфильтрация костного мозга.
Лечение ХММЛ включает поддерживающую терапию, гипометилирующие агенты (азацитидин, децитабин) и трансплантацию гемопоэтических стволовых клеток у молодых пациентов. Таргетная терапия разрабатывается с учётом специфических молекулярных нарушений.
Диагностические маркёры
Отсутствие неклассических моноцитов может служить важным диагностическим признаком хронического миеломоноцитарного лейкоза[18]. Использование slan-маркёра позволяет повысить специфичность диагностики и более точно дифференцировать различные формы миелопролиферативных заболеваний. Анализ субпопуляционного состава моноцитов становится важным компонентом комплексной диагностики гематологических заболеваний.
Проточная цитометрия является основным методом для определения субпопуляций моноцитов. Панель антител обычно включает CD14, CD16, HLA-DR, CD64 и специфические маркёры для различения моноцитов от других лейкоцитов. Молекулярно-генетические исследования играют всё большую роль в диагностике и прогнозировании течения гематологических заболеваний. Секвенирование нового поколения позволяет выявлять мутации в генах, ассоциированных с ХММЛ.
Цитогенетический анализ может выявлять хромосомные аберрации, характерные для различных форм лейкозов. Флуоресцентная гибридизация in situ (FISH) используется для выявления специфических транслокаций и делеций. Иммуногистохимическое исследование костного мозга дополняет диагностический алгоритм, позволяя оценить архитектуру костного мозга и выявлять аномальную локализацию незрелых предшественников (ALIP).
Дефицитарные состояния
- Ятрогенная монопения
Терапия иммуносупрессивными глюкокортикоидами приводит к селективному истощению популяции CD14+CD16+ моноцитов[19]. Этот эффект связан с повышенной чувствительностью данной субпопуляции к апоптозу, индуцированному кортикостероидами. Мониторинг количества моноцитов при проведении иммуносупрессивной терапии позволяет оценить степень иммуносупрессии и риск развития инфекционных осложнений.
- Наследственные дефекты
При наследственной диффузной лейкоэнцефалопатии с образованием сфероидов наблюдается характерное снижение количества неклассических slan-позитивных моноцитов[20]. Это заболевание связано с мутациями в гене, кодирующем рецептор гранулоцитарно-макрофагального колониестимулирующего фактора. Дефект рецепторного аппарата приводит к нарушению дифференцировки и функционирования моноцитарных клеток, что проявляется характерными неврологическими симптомами.
Количественная характеристика в норме
В норме моноциты составляют от 3 до 8 % от общего числа лейкоцитов периферической крови[1]. Это соответствует абсолютному содержанию от 200 до 800 клеток на микролитр.
Возрастные колебания этого показателя могут быть связаны с изменениями в функционировании гемопоэтической системы и перераспределением клеток между различными тканевыми компартментами. Определение как относительного, так и абсолютного количества моноцитов входит в стандартный общий анализ крови и служит важным диагностическим параметром.
Литература
- Афанасьев Ю. И., Кузнецов С. Л., Юрина Н. А., Котовский Е. Ф. и др. Гистология, цитология и эмбриология. — 6-е изд., перераб. и доп. — М.: Медицина, 2004.
- Хаитов Р. М. Иммунология : учебник. — М.: ГЭОТАР-Медиа, 2019. — 496 с.
- Auffray C., Fogg D., Garfa M. et al. Monitoring of blood vessels and tissues by a population of monocytes with patrolling behavior // Science. — 2007.
- Collison J. L., Carlin L. M., Eichmann M. et al. Heterogeneity in the Locomotory Behavior of Human Monocyte Subsets over Human Vascular Endothelium In Vitro // Journal of Immunology. — 2015.
- Gordon S., Taylor P. R. Monocyte and macrophage heterogeneity // Nature Reviews Immunology. — 2005.
- Rogacev K. S., Cremers B., Zawada A. M. et al. CD14++CD16+ monocytes independently predict cardiovascular events // Journal of The American College of Cardiology. — 2012.
- Shi C., Pamer E. G. Monocyte recruitment during infection and inflammation // Nature Reviews Immunology. — 2011.
- Tarfi Sihem, Badaoui Bouchra, Freynet Nicolas et al. Disappearance of slan-positive non-classical monocytes for diagnosis of chronic myelomonocytic leukemia // Haematologica. — 2019.
- Yang J., Zhang L., Yu C. et al. Monocyte and macrophage differentiation: circulation inflammatory monocyte as biomarker for inflammatory diseases // Biomarker Research. — 2014.
- Ziegler-Heitbrock L., Ancuta P., Crowe S. et al. Nomenclature of monocytes and dendritic cells in blood // Blood. — 2010.
Примечания
- ↑ 1,0 1,1 1,2 1,3 1,4 Хаитов Р. М. Иммунология: структура и функции иммунной системы. — М.: ГЭОТАР-Медиа, 2019. — 344 с. — ISBN 978-5-9704-3118-4.
- ↑ 2,0 2,1 2,2 2,3 Афанасьев Ю. И., Кузнецов С. Л., Юрина Н. А., Котовский Е. Ф. и др. Гистология, цитология и эмбриология. — 6-е изд., перераб. и доп. — М.: Медицина, 2004. — 768 с. — ISBN 5-225-04858-6.
- ↑ Mescher A. L. Junqueira's Basic Histology: Text and Atlas. — 15th ed. — New York: McGraw-Hill Education, 2016. — 560 p. — ISBN 978-1259742811.
- ↑ Swirski F. K., Nahrendorf M., Etzrodt M., Wildgruber M., Cortez-Retamozo V., Panizzi P., Figueiredo J. L., Kohler R. H., Chudnovskiy A., Waterman P., Aikawa E., Mempel T. R., Libby P., Weissleder R., Pittet M. J. Identification of splenic reservoir monocytes and their deployment to inflammatory sites // Science. — 2009. — Vol. 325, № 5940. — P. 612—616.
- ↑ Ghattas A., Griffiths H. R., Devitt A., Lip G. Y., Shantsila E. onocytes in coronary artery disease and atherosclerosis: where are we now? // Journal of The American College of Cardiology. — 2013. — Vol. 62, № 17. — P. 1541—1551.
- ↑ Sallusto F., Cella M., Danieli C., Lanzavecchia A. Dendritic cells use macropinocytosis and the mannose receptor to concentrate macromolecules in the major histocompatibility complex class II compartment: downregulation by cytokines and bacterial products // The Journal of Experimental Medicine. — 1995. — Vol. 182, № 2. — P. 389—400.
- ↑ Said E. A., Dupuy F. P., Trautmann L., Zhang Y., Shi Y., El-Far M., Hill B. J., Noto A., Ancuta P., Peretz Y., Fonseca S. G., Van Grevenynghe J., Boulassel M. R., Bruneau J., Shoukry N. H., Routy J. P., Douek D. C., Haddad E. K., Sekaly R. P. Programmed death-1-induced interleukin-10 production by monocytes impairs CD4+ T cell activation during HIV infection // Nature Medicine. — 2010. — Vol. 16, № 4. — P. 452—459.
- ↑ Robbins Scott H., Walzer Thierry, Dembélé Doulaye, Thibault Christelle, Defays Axel, Bessou Gilles, Xu Huichun, Vivier Eric, Sellars MacLean, Pierre Philippe, Sharp Franck R., Chan Susan, Kastner Philippe, Dalod Marc. Novel insights into the relationships between dendritic cell subsets in human and mouse revealed by genome-wide expression profiling // Genome Biology. — 2008. — Vol. 9, № 1. — P. R17.
- ↑ Михайлова В. А., Климовская Я. С., Аманова Н. В., Зайнулина М. С., С. А. Сельков, Д. И. Соколов. Экспрессия адгезионных молекул моноцитами периферической крови при беременности // Медицинская иммунология. — 2010. — Т. 12, № 4—5. — С. 337—342.
- ↑ Rice Lawrence, Jung Moonjung. Neutrophilic Leukocytosis, Neutropenia, Monocytosis, and Monocytopenia. Hematology: Basic Principles and Practice. — 7th ed. — Philadelphia: Elsevier, 2018. — P. 675—681.
- ↑ Hoyer F. F., Zhang X., Coppin E., Vasamsetti S. B., Modugu G., Schloss M. J., Rohde D., McAlpine C. S., Iwamoto Y., Libby P., Naxerova K., Swirski F. K., Dutta P., Nahrendorf M. Bone Marrow Endothelial Cells Regulate Myelopoiesis in Diabetes Mellitus // Circulation. — 2020. — Vol. 142, № 3. — P. 244—258.
- ↑ Heidt Timo, Sager Hendrik B., Courties Gabriel, Dutta Partha, Iwamoto Yoshiko, Zaltsman Alex, von zur Muhlen Constantin, Bode Christoph, Fricchione Gregory L., Denninger John, Lin Charles P., Vinegoni Claudio, Libby Peter, Swirski Filip K., Weissleder Ralph, Nahrendorf Matthias. Chronic variable stress activates hematopoietic stem cells // Nature Medicine. — 2014. — Vol. 20, № 7. — P. 754—758.
- ↑ Swirski F. K., Libby P., Aikawa E., Alcaide P., Luscinskas F. W., Weissleder R., Pittet M. J. Ly-6Chi monocytes dominate hypercholesterolemia-associated monocytosis and give rise to macrophages in atheromata // The Journal of Clinical Investigation. — 2007. — Vol. 117, № 1. — P. 195—205.
- ↑ Heine G. H., Ulrich C., Seibert E., Seiler S., Marell J., Reichart B., Krause M., Schlitt A., Köhler H., Girndt M. CD14++CD16+ monocytes but not total monocyte numbers predict cardiovascular events in dialysis patients // Kidney International. — 2008. — Vol. 73, № 5. — P. 622—629.
- ↑ Fingerle G., Pforte A., Passlick B., Blumenstein M., Strobel M., Ziegler-Heitbrock Hw. The novel subset of CD14+/CD16+ blood monocytes is expanded in sepsis patients // Blood. — 1993. — Vol. 82, № 10. — P. 3170—3176.
- ↑ Martinez J., Huang X., Yang Y. TLR7 and TLR8 activate distinct pathways in monocytes during RNA virus infection // Science Signaling. — 2019. — Vol. 12, № 65. — P. eaaw1347.
- ↑ Foucar K. Myelodysplastic/myeloproliferative neoplasms // American Journal of Clinical Pathology. — 2009. — Vol. 132, № 2. — P. 281—289.
- ↑ Selimoglu-Buet Dorothée, Wagner-Ballon Orianne, Saada Véronique, Bardet Valérie, Itzykson Raphaël, Bencheikh Laura, Morabito Margot, Met Elisabeth, Debord Camille, Benayoun Emmanuel, Nloga Anne-Marie, Fenaux Pierre, Braun Thorsten, Willekens Christophe, Quesnel Bruno, Adès Lionel, Fontenay Michaela, Rameau Philippe, Droin Nathalie, Koscielny Serge, Solary Eric. Characteristic repartition of monocyte subsets as a diagnostic signature of chronic myelomonocytic leukemia // Blood. — 2015. — Vol. 125, № 23. — P. 3618—3626.
- ↑ Fingerle-Rowson G., Angstwurm M., Andreesen R., Ziegler-Heitbrock H. W. Selective depletion of CD14+ CD16+ monocytes by glucocorticoid therapy // Clinical and Experimental Immunology. — 1998. — Vol. 112, № 3. — P. 501—506.
- ↑ Hofer T. P., Zawada A. M., Frankenberger M., Skokann K., Satzl A. A., Gesierich W., Schuberth M., Levin J., Danek A., Rotter B., Heine G. H., Ziegler-Heitbrock L. slan-defined subsets of CD16-positive monocytes: impact of granulomatous inflammation and M-CSF receptor mutation // Blood. — 2015. — Vol. 126, № 24. — P. 2601—2610.