Оксид азота(II)
| Оксид азота(II) | |
|---|---|
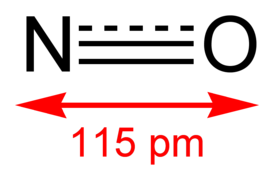  | |
| Общие | |
| Систематическое наименование |
Оксид азота(II) |
| Хим. формула | NO |
| Физические свойства | |
| Состояние | бесцветный газ |
| Молярная масса | 30,0061 г/моль |
| Плотность | газ: 1,3402 кг/м³ |
| Термические свойства | |
| Температура | |
| • плавления | −163,6 °C |
| • кипения | −151,7 °C |
| • разложения | выше +700 °C |
| Энтальпия | |
| • образования | 81 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 0,01 г/100 мл |
| Классификация | |
| Рег. номер CAS | [10102-43-9] |
| Безопасность | |
| Пиктограммы СГС |
|
| NFPA 704 | [1] |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Окси́д азота́ (II) (монооксид азота, окись азота) — бесцветный газ, плохо растворимый в воде и окисляющийся на воздухе до диоксида азота (). При сжижении он имеет голубой цвет, что связано с образованием димеров (). Не образует солей. В биологических системах он выступает в качестве сигнальной молекулы, регулируя кровяное давление и иммунный ответ. В промышленности является промежуточных продуктом при производстве азотной кислоты и других химических соединений. Ядовитый газ, при вдыхании вызывающий раздражение дыхательных путей[2][3].
История открытия
В 1774 году английский химик Джозеф Пристли открыл оксид азота (II), синтезировав его в результате реакции меди с азотной кислотой. Он назвал полученный газ «селитряным воздухом» и описал свои эксперименты в книге «Эксперименты и наблюдения за разными видами воздуха», опубликованной в 1775 году[4].
Исследование биологической активности оксида азота берёт своё начало в 1955 году, когда Роберт Фрэнсис Ферчготт, американский биохимик и профессор фармакологии из Государственного университета Нью-Йорка в Бруклине, обнаружил, что видимый свет оказывает расслабляющее действие на аорту кролика. Это открытие стало предметом его дальнейших исследований. В 1961 году Ферчготт опубликовал обзорную статью, подробно описывающую этот феномен[5].
Параллельно с работами Ферчготта, в СССР в 1965 году Анатолий Фёдорович Ванин опубликовал статью о свободных радикалах нового типа в дрожжевых клетках. Для обнаружения этих радикалов он использовал метод электронного парамагнитного резонанса (ЭПР). Радикал позже был идентифицирован как оксид азота[5].
В 1980 году Ферчготт открыл эндотелиальный фактор расслабления сосудов (EDRF), который, как позже выяснилось, был идентичен оксиду азота. В 1986 году Луис Игнарро, профессор фармакологии Школы медицины Калифорнийского университета в Лос-Анджелесе, независимо от Ферчготта пришёл к выводу, что EDRF идентичен оксиду азота. Игнарро также показал, что механизм вазодилатирующего эффекта нитроглицерина реализуется через его метаболизм в оксид азота[5].
Ферид Мурад, профессор кафедры биохимии и молекулярной биологии Университета Джорджа Вашингтона, в 1977 году обнаружил, что нитраты способствуют высвобождению оксида азота, который расслабляет гладкие мышечные клетки и приводит к расширению сосудов[5].
В 1992 году оксид азота был назван молекулой года Американской ассоциацией развития науки и научным журналом «Science». В 1998 году Роберт Ф. Ферчготт, Луис Дж. Игнарро и Ферид Мурад были удостоены Нобелевской премии в области физиологии и медицины за открытие роли оксида азота как сигнальной молекулы в регуляции сердечно-сосудистой системы[5].
Свойства вещества
Химическое строение
Молекула оксида азота (II) (NO) обладает структурой, которая может быть предсказана на основе электронной конфигурации атомов азота и кислорода. Атомы кислорода имеют два неспаренных электрона, в то время как атомы азота имеют три неспаренных электрона. При образовании молекулы NO формируется двойная связь, и один неспаренный электрон остаётся на атоме азота. Это делает молекулу NO свободным радикалом, что является редким явлением в природе[6].
Молекула NO состоит из одного атома азота и одного атома кислорода, связанных двойной связью. Оставшийся неспаренный электрон на атоме азота придаёт молекуле парамагнитные свойства. Структура молекулы может быть представлена как N≡O, где тройная линия обозначает двойную связь и один неспаренный электрон. Несмотря на наличие неспаренного электрона, молекула NO достаточно стабильна. Это связано с делокализацией электронов и особенностями орбиталей азота и кислорода. Делокализация позволяет стабилизировать молекулу, несмотря на наличие неспаренного электрона. Длина связи N-O составляет 0,115 нм, а энергия связи равна 626,84 кДж/моль. Порядок связи 2,5[7].
В электронной структуре NO присутствует неспаренный электрон, что делает его радикалом (нитроксил-анионом). Это объясняет его высокую реакционную способность и короткий срок существования в свободном состоянии[6].
Молекулы NO могут объединяться и образовывать димерные молекулы N2O2. В этом случае проблема неспаренного электрона решается за счёт образования новой связи между двумя молекулами NO[6]:
Димерная молекула N2O2 не имеет неспаренных электронов и, следовательно, является более стабильной[6].
Физические свойства
При комнатной температуре NO является бесцветным газом. Температура плавления составляет –163,7 °C, а температура кипения –151,6 °C. Плотность газа составляет 1,3402 г/дм3, а плотность жидкости при температуре –163 °C — 1,332 г/см3[2]. Растворимость при атмосферном давлении и 20 °С равна 4,7 мл газа NO на 100 г воды[6].
NO является парамагнитным веществом из-за наличия неспаренного электрона в его молекуле. В жидком состоянии NO содержит около 25 % димера (N2O2), а в твердом состоянии он полностью состоит из димера[3]. NO сжижается с трудом; в жидком и твердом виде он имеет голубой цвет[2].
Химические свойства
Соединение с промежуточной степенью окисления азота, NO, может проявлять свойства как восстановителя, так и окислителя[6].
Восстановительные свойства
NO обладает высокой реакционной способностью и легко окисляется под действием кислорода и галогенов. Например, реакция с хлором приводит к образованию хлористого нитрозила[2].
Оксид азота (II) вступает во взаимодействие с озоном и полностью поглощает его[6].
Под действием сильных окислителей, таких как кислород, NO окисляется до нитрат-иона. Это свойство было использовано в камерном способе получения серной кислоты, разработанном ещё в XVIII веке. В этом процессе NO выступает в роли катализатора-переносчика кислорода[4]:
Реакция диспропорционирования
Оксид NO, взаимодействуя с щелочью, образует соль азотистой кислоты, оксид азота (I) и азот[6].
Окислительные свойства
NO также активно реагирует с восстановителями, причём восстановление обычно идёт до термодинамически стабильного молекулярного азота. Примеры таких реакций включают[4].
Подбором условий можно превратить NO и в другие соединения со степенями окисления от +1 до -3[4].
- Кислая среда
- Нейтральная среда
Комплексообразование
Строение молекулы NO, сходное с молекулами кислорода, оксида углерода (II) и HCN, позволяет ей образовывать комплексы. Парамагнитные свойства NO, обусловленные наличием неспаренных электронов, также схожи с парамагнитными свойствами кислорода. Примером образования комплекса с участием NO служит реакция «бурого кольца», открытая Пристли. В этой реакции нитрат-ион сначала восстанавливается до NO под действием сульфата железа[4].
Затем с избытком FeSO₄ образуется окрашенный в бурый цвет комплекс[4].
Способы получения
В природе
Монооксид азота (NO) действительно образуется в атмосфере при грозовых разрядах. Этот процесс связан с высокими температурами и энергией, которые возникают при молниях. Во время грозовых разрядов азот (N2) и кислород (O2) в атмосфере могут реагировать друг с другом, образуя монооксид азота. Этот процесс является одним из естественных источников оксидов азота в атмосфере. Оксиды азота играют важную роль в химии атмосферы, влияя на образование озона и другие химические процессы[3].
Исторический
В ходе лабораторных экспериментов можно синтезировать оксид азота (II), подвергая взаимодействию разбавленную азотную кислоту с неактивными металлами. Так, в 1774 году английский исследователь Джозеф Пристли впервые осуществил реакцию, в результате которой при взаимодействии меди с 30-процентной азотной кислотой был получен оксид азота
В промышленности
В конце XIX века возникла необходимость в азотсодержащих соединениях для производства красителей, взрывчатых веществ и удобрений. Был предложен технологический процесс горения воздуха[4].
Термодинамические расчеты показали, что для реакции требуются высокие температуры. В 1901 году горение воздуха было осуществлено дуговым методом: воздух продувался через электрическую дугу с температурой около 4000 °C, затем охлаждался, чтобы предотвратить разложение NO. Метод не получил распространения из-за высокого расхода электроэнергии. Возможно, с развитием регенеративных печей и ядерных реакторов, его технико-экономические показатели улучшатся[4]. Это единственный оксид азота, который можно получить в результате взаимодействия азота и кислорода[7].
В настоящее время основная схема получения оксида азота(II) - это каталитическое окисления аммиака[4].
При выполнении реакции важно минимизировать контакт газовой смеси с катализатором, чтобы избежать распада NO. Для этого используют тонкую сетку из сплава платины с родием, через которую продувается смесь воздуха с аммиаком (12 %), что обеспечивает выход окиси азота до 98 %. Окисление оксида до диоксида азота и его перевод в азотную кислоту также представляют технологические трудности. Для увеличения скоростей реакции создают поглотительные камеры большого объёма с развитой внутренней поверхностью[4].
В лаборатории
Реакция в растворах позволяет получить газ высокой степени чистоты[7].
Применение
В промышленности
Синтез азотной кислоты
Азотная кислота (HNO3) является важным химическим реагентом, используемым в производстве удобрений, взрывчатых веществ и других химических продуктов. Процесс синтеза азотной кислоты включает несколько стадий, одна из которых связана с оксидом азота(II)[8].
- Окисление аммиака. Аммиак (NH3) окисляется до оксида азота(II) (NO) в присутствии катализатора (обычно платина-родиевый катализатор) и кислорода при высоких температурах[8].
- Оксид азота(II) затем окисляется до диоксида азота (NO2) при взаимодействии с кислородом[8].
- Процесс синтеза азотной кислоты включает в себя растворение диоксида азота в воде с использованием кислорода в качестве окислителя, в результате чего образуется азотная кислота[8].
Синтез гидроксиламина
Гидроксиламин (NH2OH) является важным промежуточным соединением в химической промышленности, используемым в производстве капролактама, который является предшественником нейлона. Процесс синтеза гидроксиламина включает использование оксида азота(II)[9]:
- Реакция NO с водородом. Оксид азота(II) реагирует с водородом (H2) в присутствии катализатора (обычно палладий на угле) для образования гидроксиламина[7].
- В промышленности часто используется процесс Рэшлига для синтеза гидроксиламина. В этом процессе NO сначала окисляется до NO2, который затем реагирует с аммиаком и водородом для образования гидроксиламина[7].
В науке
Оксид азота (II) стал объектом пристального внимания исследователей во второй половине XX века благодаря своей роли в функционировании организма человека. В 1980-х годах было обнаружено, что он является ключевой молекулой, регулирующей сосудистый тонус и передачу нервных импульсов. Это открытие послужило основой для дальнейших исследований и применения оксида азота в медицинской практике[5].
Уровень опасности и меры предосторожности
Опасность пожара
Монооксид азота (NO) представляет собой химическое соединение, обладающее высокой реактивностью и потенциальной опасностью. Ниже приведены основные аспекты, связанные с опасностью монооксида азота, особенно в контексте пожаров и взрывов[2][10].
- Монооксид азота горит при нагревании с водородом. Это создает дополнительные риски при неправильном обращении или в условиях повышенной температуры.
- NO бурно реагирует с восстановителями, что может вызвать неконтролируемые реакции и выделение большого количества энергии. Монооксид азота может воспламенить горючие материалы, такие как древесина, бумага, масло и другие, что увеличивает риск обширных пожаров. Несовместимость с алюминием, сероуглеродом, гипохлоритом, хромом, фтором, топливом, углеводородами, трихлоридом азота, озоном, фосфором, диметилгидразином, ураном, ангидридом уксусной кислоты, аммиаком, оксидом бария, трихлоридом бора, хлористым метилом, 1,2-дихлорэтаном, дихлорэтиленом, этиленом, железом, магнием, марганцем, олефинами, калием, пропиленом, натрием, серой, трихлорэтиленом, 1,1,1-трихлорэтаном. Контакт с этими веществами может привести к опасным реакциям и взрыва.
- Контейнер с оксидом азота (II) может взорваться при нагревании, что представляет серьезную угрозу для безопасности. Пары монооксида азота могут взорваться, особенно в закрытых помещениях, что приведет к отравлению и другим опасным последствиям[2][10].
Токсичность
При контакте с водой или паром монооксид азота выделяет тепло и едкие пары, что может привести к дополнительным рискам возгорания или химического отравления. При нагревании монооксида азота выделяются высокотоксичные пары оксидов азота, которые могут привести к серьезным повреждениям дыхательной системы и даже смерти при высоких концентрациях[2][10].
Воздействие на организм человека
- Смертельная опасность: Даже кратковременное воздействие монооксида азота в небольших количествах может привести к смерти или необратимым повреждениям.
- Раздражение: NO раздражает глаза, нос, горло и может вызвать потерю сознания.
- Образование кислот: Вдыхание оксида азота приводит к образованию кислот в дыхательной системе, что вызывает раздражение и застойные явления в лёгких[2][10].
Концентрации
- 60–150 частей на миллион: Немедленное раздражение носа и горла с кашлем и жжением в горле и груди.
- 100–150 частей на миллион: Опасны при кратковременном воздействии в течение 30–60 минут.
- 200–700 частей на миллион: Могут привести к летальному исходу при очень кратковременном воздействии[2][10].
Меры предосторожности
Для обеспечения безопасности при работе с газом NO необходимо строго соблюдать следующие правила[2][10]:
- В случае обнаружения утечки газа следует немедленно отойти на расстояние не менее 100 метров от места утечки. При возникновении пожара необходимо отойти на расстояние не менее 800 метров от очага возгорания.
- Для тушения пожара рекомендуется использовать специальную одежду и оборудование. Необходимо переместить контейнер с газом на безопасное расстояние от огня.
- Для тушения пожара можно использовать следующие методы.
- Распыление воды для тушения пламени; применение специальных шлангов или насадок для тушения пожара.
- Использование сухого химического огнетушителя или углекислого газа для тушения небольших пожаров; распыление воды, тумана или пены для тушения больших пожаров.
- В случае пролива газа запрещается прикасаться к нему.
- Следует избегать контакта с легковоспламеняющимися материалами.
- При обнаружении утечки газа необходимо немедленно перекрыть её.
- Для уменьшения концентрации паров газа рекомендуется распылить воду.
- Запрещается лить воду на пролитое вещество.
- Для удаления газа из ёмкости необходимо перевернуть её.
- После завершения работы необходимо изолировать помещение и обеспечить его проветривание[2][10].
Биологическая активность
Оксид азота (NO) образуется из аминокислоты L-аргинина под действием фермента NO-синтазы (NOS). В процессе синтеза происходит окислительное декарбоксилирование гуанидиновой группы аргинина, в результате чего высвобождается молекула NO. Монооксид азота вызывает расслабление гладкомышечных клеток сосудов. Приводит к снижению концентрации кальция в клетках, что способствует расслаблению миоцитов и расширению кровеносных сосудов[11].
Оксид азота (NO) действительно играет многогранную роль в различных физиологических процессах, и его клиническое применение активно исследуется. Вот более детализированное объяснение каждого из аспектов, связанных с его функциями и потенциальными медицинскими применениями[11]:
- Контроль тонуса сосудов и кровяного давления. Играет ключевую роль в регулировании тонуса сосудов и артериального давления. Он способствует расслаблению гладких мышц сосудов, что приводит к их расширению (вазодилатации) и снижению давления. Это помогает поддерживать стабильность кровяного давления. Такое свойство делает NO ценным инструментом в лечении гипертонии и других сердечно-сосудистых заболеваний.
- Участие в иммунном ответе. NO также влияет на различные типы иммунных клеток, участвующих в иммунном ответе, регулируя воспалительные процессы. Это делает его потенциальным инструментом в терапии воспалительных заболеваний и усилении иммунного ответа. Макрофаги производят NO через iNOS, реагируя с супероксид-анионами для образования пероксинитрита (ONOO⁻). Пероксинитрит окисляет и нитрует липиды, белки, сахара и нуклеиновые кислоты, повреждая бактериальные структуры. Это включает окисление мембран, модификацию белков и повреждение ДНК/РНК. Избыток NO и пероксинитрита может повредить собственные клетки, поэтому важна регуляция этих процессов[12].
- Роль нейромедиатора в центральной нервной системе. Оксид выступает в качестве нейромедиатора, участвуя в передаче нервных импульсов и регулируя когнитивные функции. Это делает его перспективным агентом в лечении нейродегенеративных заболеваний и улучшении когнитивных способностей.
- Противоопухолевая активность. NO способен ингибировать деление опухолевых клеток и способствовать их гибели, что делает его потенциальным агентом в противоопухолевой терапии. Это открывает новые возможности в разработке методов лечения рака и предотвращения метастазирования.
- Предотвращение окислительного стресса. Соединение взаимодействует с активными формами кислорода, предотвращая окислительный стресс и повреждение клеток. Это делает его ценным инструментом в антиоксидантной терапии для защиты клеток от повреждений.
- Регуляция работы желудочно-кишечного тракта, мочеполовой системы и органов дыхания. NO регулирует моторику желудка и кишечника, стимулируя перистальтику мочевыводящих путей и бронхов. Это делает его потенциальным инструментом в лечении заболеваний желудочно-кишечного тракта, мочеполовой системы и дыхательных путей.
- Стимуляция образования новых кровеносных сосудов и процессов заживления. Вещество стимулирует ангиогенез и репаративные процессы, способствуя образованию новых кровеносных сосудов и ускорению заживления ран, а также формированию новой костной ткани. Это делает его ценным инструментом в регенеративной медицине для ускорения заживления ран и восстановления тканей.
- Снижение воздействия стрессовых факторов. NO снижает негативное воздействие кортикостероидов и других стрессовых факторов. Это делает его потенциальным инструментом в терапии стрессовых состояний и заболеваний, связанных с хроническим стрессом[11]
Исследования по применению NO в медицине активно развиваются, особенно в контексте лечения сердечно-сосудистых заболеваний и нарушений эрекции. NO-зависимые механизмы используются для разработки новых методов лечения, направленных на улучшение микроциркуляции, снижение риска тромбозов и оптимизацию работы сосудов[11].
Современные исследования показали, что оксид азота играет ключевую роль в различных физиологических процессах, включая регуляцию артериального давления, иммунитета и деятельности центральной нервной системы. NO также участвует в ремоделировании сосудов, противодействует образованию злокачественных клеток, регулирует процессы окисления, ускоряет заживление ран и образование новой костной ткани, а также минимизирует пагубное воздействие стрессовых гормонов[5].
Примечания
- ↑ Nitric oxide | Cameo Chemicals | NOAA. Дата обращения: 1 апреля 2022. Архивировано 18 июля 2022 года.
- ↑ 2,00 2,01 2,02 2,03 2,04 2,05 2,06 2,07 2,08 2,09 2,10 Оксид азота II: получение и химические свойства. Chemege.ru. Дата обращения: 10 декабря 2024. Архивировано 12 февраля 2021 года.
- ↑ 3,0 3,1 3,2 Раков Э. Г. Оксид азота (II). Большая российская энциклопедия (21 марта 2024). Дата обращения: 10 декабря 2024. Архивировано 16 июня 2024 года.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 4,6 4,7 4,8 4,9 Зеленин К. Н. Оксид азота(II): новые возможности давно известной молекулы // Соросовский Образовательный Журнал : журнал. — 1997. — № 10. — С. 105 - 110.
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 5,6 Дударь А. И. Открытие и исследования оксида азота в биологических системах: ретроспективный анализ // Наука. Мысль: электронный периодический журнал : журнал. — 2015. — № 6. — С. 8-13. — ISSN 2224-0152.
- ↑ 6,0 6,1 6,2 6,3 6,4 6,5 6,6 6,7 Валединская О. Р. Оксиды и гидроксиды азота. Тайна степеней окисления // Химия : журнал, сайт. — 2003. — Февраль (№ 5 (604)). — ISSN 2077-1959.
- ↑ 7,0 7,1 7,2 7,3 7,4 Кузнецов И. В., Хмелев С. С. Химия азота и его важнейших соединений. Саратовский национальный исследовательский государственный университет имени Н.Г. Чернышевского. Дата обращения: 24 декабря 2024.
- ↑ 8,0 8,1 8,2 8,3 Лекция 6 Производство азотной кислоты. Карагандинский технический университет имени Абылкаса Сагинова. Дата обращения: 24 декабря 2024.
- ↑ Гидроксиламин. Ataman Kimya. Дата обращения: 24 декабря 2024.
- ↑ 10,0 10,1 10,2 10,3 10,4 10,5 10,6 ICSC 1311 - Монооксид азота. International Chemical Safety Cards (2018). Дата обращения: 22 декабря 2024. Архивировано 22 декабря 2024 года.
- ↑ 11,0 11,1 11,2 11,3 Дударь А. И. Открытие и исследования оксида азота в биологических системах: ретроспективный анализ // Наука. Мысль: электронный периодический журнал : журнал. — 2015. — № 6. — С. 8 - 13. — ISSN 2224-0152.
- ↑ Космачевская О., Топунов А. Колыбель для NO // Химия и жизнь XXI век : журнал, сайт. — 2019. — № 10. — ISSN 1727-5903.
Данная статья имеет статус «готовой». Это не говорит о качестве статьи, однако в ней уже в достаточной степени раскрыта основная тема. Если вы хотите улучшить статью — правьте смело! |





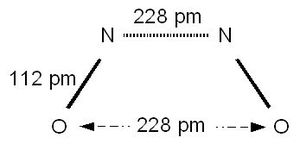













![{\displaystyle {\ce {FeSO4 + NO + H2O -> [Fe(H2O)5NO]SO4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/10bcae3e6b610f3a661d3d1ef8b74cee0dfffc27)


![{\displaystyle {\ce {4NH3 + 5O2->[t, p] 4NO + 6H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8050109721f0bb93be85265a2a2e104a9bcef758)





