Оксид азота(I)
| Оксид азота(I) | |||
|---|---|---|---|
 | |||
 | |||
| Общие | |||
| Систематическое наименование |
Закись азота | ||
| Хим. формула | N2O | ||
| Физические свойства | |||
| Состояние | бесцветный газ | ||
| Молярная масса | 44,0128 г/моль | ||
| Плотность | 1,98 г/л (при н. у.) | ||
| Термические свойства | |||
| Температура | |||
| • плавления | -90,86 °C | ||
| • кипения | -88,48 °C | ||
| • разложения | выше +500 °C | ||
| Классификация | |||
| Рег. номер CAS | 10024-97-2 | ||
| SMILES | |||
| Безопасность | |||
| Пиктограммы СГС |
|
||
| NFPA 704 | |||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
Окси́д азо́та (I) (гемиокси́д, «веселя́щий га́з», окси́д диазо́та, за́кись азо́та) — неорганическое вещество, соединение азота с кислородом, имеющее химическую формулу N2O, представляет собой несолеобразующий оксид. Оно обладает окислительными свойствами и плохо растворимо в воде, не вступая с ней в реакцию[1][2]. При нормальных условиях ― инертный газ[3]
В малых концентрациях этот газ вызывает лёгкое опьянение («веселящий газ»). При вдыхании чистого газа быстро наступает состояние опьянения и сонливости. Закись азота обладает слабой наркотической активностью, что позволяет использовать её в медицине в высоких концентрациях. В смеси с кислородом, при правильном дозировании (до 80% закиси азота), она вызывает хирургический наркоз[1][2][4].
Оборот закиси азота ограничен Федеральным законом Российской Федерации от 29 декабря 2020 года № 472-ФЗ «Об ограничении оборота закиси азота в Российской Федерации»[5].
История открытия
История открытия закиси азота, также известной как оксид азота или «веселящий газ», берёт своё начало с экспериментов Джозефа Пристли, проведённых в 1772 году. Этот известный натурфилософ и химик синтезировал газ и описал свои открытия в книге «Эксперименты и наблюдения за разными видами воздуха», изданной в 1775 году[6].
Почти через 25 лет, в 1799 году, британский химик, физик и изобретатель Хемфри Деви продолжил исследования закиси азота. Он обнаружил уникальные свойства этого газа, в частности, его воздействие на человеческий организм. Деви заметил, что вдыхание N2O вызывает эйфорию и снижает чувствительность к боли. Эти открытия привели к использованию закиси азота в медицине в качестве анестезирующего средства[6].
Бродячие артисты были первыми, кто начал использовать закись азота. Им была нужна весёлая публика, а газ мог это обеспечить. Смеющиеся люди привлекали к представлению других любопытных зрителей, и вокруг артистов собиралась внушительная толпа. Поскольку газ выпускали незаметно и он распространялся повсюду, им дышали не только зрители, но и сами артисты[7].
В книге Джеймса Уатта и Томаса Беддоу «Соображения о медицинском использовании и производстве искусственных воздухов», изданной в 1794 году, были представлены два значимых аспекта. Во-первых, Уатт предложил конструкцию «машины» для производства закиси азота (N₂O), а также устройство для ингаляции газов в медицинских целях. Во-вторых, Беддоу выдвинул новую теорию о том, что туберкулёз и другие заболевания лёгких могут быть излечены с помощью ингаляций «искусственных воздухов». Хотя эта теория не подтвердилась, она способствовала развитию методов ингаляционной терапии[8].
Наркотические свойства веселящего газа были известны ещё в XVIII веке. С 1799 года и вплоть до 1863 года в Великобритании проводились «вечеринки веселящего газа», на которых представители высшего общества собирались, чтобы надышаться закисью азота. Эти мероприятия стали своеобразным развлечением для аристократии и интеллигенции того времени[8].
В 1844 году американский стоматолог Горацио Уэллс впервые в истории провёл удаление зуба с использованием закиси азота в качестве анестетика. Горацио Уэллс, известный американский стоматолог, предпринял несколько попыток убедить окружающих в эффективности закиси азота (N₂O) в качестве анестетика. Во время первой демонстрации лечения зуба дантист дал пациенту небольшую дозу газа, в результате чего тот находился в бессознательном состоянии меньшее время, чем предполагалось. Газ также оказал воздействие на свидетелей процедуры. В результате пациент проснулся и испытывал сильную боль, а окружающие безудержно смеялись[7].
Первая публичная демонстрация «веселящего газа» не увенчалась успехом. Вторая попытка также оказалась неудачной. На этот раз Гораций дал пациенту слишком большую дозу наркотического вещества, из-за чего пациент едва не умер[7].
После этих неудачных попыток Уэллс прекратил эксперименты и отказался от идеи использовать закись азота для анестезии. Однако его дело продолжил другой врач, коллега Уэллса Уильям Мортон. Мортон успешно использовал газ и стал известен как первооткрыватель анестезии. Эти действия бывшего напарника привели Уэллса в уныние. Он потребовал публично признать его первенство в идее использования закиси азота в качестве анестетика, но Мортон не отреагировал на его требования[7].
Свойства вещества
Химическое строение
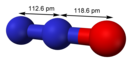
Молекула закиси азота имеет линейную структуру. Её дипольный момент равен 0,166 D[9]. Конфигурация молекулы оксида азота(I) может быть представлена в виде резонансных структур[4].
Физические свойства
Закись азота представляет собой бесцветный газ, обладающий плотностью 1,977 г/л. Температура плавления этого вещества составляет -90,86°C, что соответствует -131,55°F и 182,29 K. Температура кипения равна -88,48°C, что эквивалентно -127,26°F и 184,67 K. Закись азота (N₂O), охлажденная до жидкого состояния, выглядит как бесцветная жидкость. Её плотность составляет 1,22 г/см³. При кипении жидкая закись азота превращается в бесцветный газ со сладким запахом и умеренной токсичностью[9].
Растворимость закиси азота в воде при температуре 15°C составляет 1,5 г/л, а также она способна растворяться в спирте, эфире и серной кислоте[9].
Давление пара закиси азота при температуре 20°C составляет 5150 кПа, Магнитная восприимчивость равна -18,9×10⁻⁶ см³/моль. Показатель преломления (nD) равен 1,000516 при 0°C и 101,325 кПа. Вязкость составляет 14,90 мкПа·с[9].
В термохимических характеристиках стандартная молярная энтропия (S⁰₂₉₈) равна 219,96 Дж/(К·моль) Стандартная энтальпия образования (ΔH⁰₂₉₈) составляет +82,05 кДж/моль[9].
Химические свойства
Несолеобразующий оксид, поэтому кислотные свойства не характерны[1].
Окислительные свойства
Оксид азота (I) в обычных условиях проявляет инертные свойства[10]. Однако при нагревании он начинает проявлять окислительные свойства, окисляя такие вещества, как водород, аммиак, металлы и сернистый газ. В результате этих реакций азот восстанавливается до простого вещества[1][4].
Оксид азота (I) + сера → азот + оксид серы (IV)
Восстановительные свойства
Оксид азота (I) также может проявлять восстановительные свойства при взаимодействии с сильными окислителями. Например, он окисляется раствором перманганата калия в серной кислоте (редокс-реакция)[4]:
Оксид азота (I) + серная кислота (концентрированная) + перманганат калия → оксид азота (II) + сульфат марганца + сульфат калия + вода
Внутримолекулярная реакция окисления и восстановления
При нагревании закись азота разлагается на азот и кислород. Тлеющая лучинка вспыхивает в атмосфере закиси азота[2].
Способы получения
Промышленный метод
Разложение нитрата аммония: один из наиболее распространённых промышленных методов получения закиси азота включает осторожное нагревание нитрата аммония (NH₄NO₃) до примерно 250°C. При этом нитрат аммония разлагается на закись азота и водяной пар[9].
Добавление различных фосфатных солей способствует образованию более чистого газа при несколько более низких температурах. Однако эту реакцию может быть трудно контролировать, что приводит к детонации[9].
Лабораторные методы
Разложение нитрата аммония
Разложение нитрата аммония также является распространённым лабораторным методом получения закиси азота[9].
Реакция нитрата натрия с сульфатом аммония
Закись азота можно получить нагреванием смеси нитрата натрия (NaNO₃) и сульфата аммония (NH₄)₂SO₄[9].
Реакция мочевины, азотной и серной кислот
Метод включает реакцию мочевины ((NH₂)₂CO), азотной кислоты (HNO₃) и серной кислоты (H₂SO₄)[9].
Прямое окислении аммиака (NH₃) с помощью катализатора
Окисление аммиака кислородом с применением катализаторов на основе диоксида марганца (MnO₂) и оксида висмута (Bi₂O₃), аналогично Оствальдскому процессу[9].
Реакция хлорида гидроксиламмония с нитритом натрия
Хлорид гидроксиламмония (NH₃OHCl) реагирует с нитритом натрия (NaNO₂) с образованием закиси азота[9].
Реакция сульфаминовой кислоты с азотной кислотой
Наиболее удобным способом получения закиси азота (N₂O) является процесс нагревания сульфаминовой кислоты (NH₂SO₃H) с азотной кислотой (HNO₃), концентрация которой составляет 73%. В результате этой реакции образуются закись азота, серная кислота (H₂SO₄) и вода (H₂O). Данный метод является эффективным и относительно несложным в исполнении, что делает его привлекательным для использования в лабораторных условиях для получения закиси азота[11].
Применение
В промышленности
Инертный оксид азота, известный также как закись азота (N₂O), представляет собой вещество, находящее широкое применение в различных областях промышленности благодаря своим уникальным свойствам. В газосварочных работах закись азота используется для поддержания необходимой температуры и стабильности пламени, что критически важно для обеспечения качественной сварки и предотвращения окисления металлов. В метрологии и аналитике закись азота применяется для калибровки высокоточных приборов благодаря своей стабильности физических и химических свойств. В химической промышленности закись азота служит исходным материалом для производства азотной и серной кислот, а также может выступать в качестве промежуточного продукта в синтезе различных химических соединений. В оборонной промышленности закись азота применяется в производстве взрывчатых веществ благодаря своим окислительным свойствам[12].
В медицине
Веселящий газ часто используется в стоматологии, особенно в детской, для уменьшения боли и тревожности. Он также применяется при проведении лазерных процедур, диагностических исследований (например, колоноскопии), в отделениях неотложной помощи и в акушерской практике. Действие анестетика начинается через 10-15 секунд после поступления в организм. Длится 10-15 минут после окончания вдыхания. Закись азота удаляется с выдыхаемым воздухом[13].
Некоторые исследования показывают, что закись азота может облегчать состояние людей с депрессией, устойчивой к другим методам терапии, но это не является официально признанным методом лечения[13].
Оксид азота (N₂O) обладает как наркотическим, так и обезболивающим действием, и эти эффекты реализуются посредством двух различных механизмов. Первый механизм связан с активацией эндогенной опиоидной системы и её взаимодействием с нисходящей норадренергической системой. Это взаимодействие приводит к снижению болевой чувствительности и созданию ощущения комфорта. Второй механизм заключается в воздействии N₂O на мезолимбический путь, что приводит к избыточному выделению дофамина в области награды. Это выделение дофамина вызывает эйфорические ощущения и является основой наркотического эффекта закиси азота[8].
В агротехнике
Закись азота находит своё применение в различных сферах, включая агрономические исследования. В сельском хозяйстве этот газ используется для изучения воздействия нитрата азота на рост и развитие растений. Благодаря закиси азота учёные могут оценить эффективность удобрений и оптимизировать их использование, что, в свою очередь, способствует повышению урожайности и улучшению качества сельскохозяйственных культур[9].
Транспорт
В сфере автомобилестроения закись азота активно применяется с целью повышения эффективности работы двигателей. В процессе впрыска N2O в двигатель происходит его распад на азот и кислород, что приводит к увеличению количества доступного для горения топлива кислорода. В результате двигатель получает возможность сжигать большее количество топлива за единицу времени, что, в свою очередь, приводит к увеличению его мощности. Этот процесс, известный как «нитроускорение», широко используется в автоспорте и при тюнинге автомобилей[13].
Гибридные ракетные двигатели представляют собой инновационное решение в области космической инженерии. В качестве окислителя в таких двигателях используется жидкий оксид азота (N₂O (I)), а в качестве горючего водород. Это позволяет достичь высокой эффективности и надёжности при эксплуатации[14].
Закись азота (N₂O) представляет собой вещество, обладающее рядом преимуществ, которые делают его привлекательным для использования в ракетных двигателях. Во-первых, закись азота менее опасной по сравнению с другими окислителями, такими как жидкий кислород или азотная кислота. Это делает её более безопасной в обращении и хранении. Во-вторых, закись азота стабильна при комнатной температуре, что упрощает её хранение и транспортировку. Кроме того, закись азота может разлагаться с образованием кислорода, который может использоваться для дыхания. Это является дополнительным преимуществом в космических миссиях. Высокая плотность закиси азота и её способность храниться при низком давлении делают её конкурентоспособной по сравнению с системами хранения газа под высоким давлением. Исторически, Роберт Годдард, американский пионер ракетостроения, уже в 1914 году предложил использовать закись азота и бензин в качестве топлива для ракет на жидком топливе[9].
Пищевая промышленность
В пищевой промышленности закись азота находит применение в качестве пропеллента в баллонах для взбитых сливок. При выходе из баллона газ быстро расширяется, взбивая сливки в пену. Это позволяет легко и быстро получить взбитые сливки без использования электрических миксеров или других приспособлений[13]. Как пищевой компонент имеет индекс E942. В Российской Федерации и Европейском союзе она включена в список разрешённых к использованию в пищевой промышленности[15].
Закись азота при нормальных условиях инертный газ, который создает условия, препятствующие окислению и размножению бактерий. Это, в свою очередь, способствует увеличению сроков хранения продуктов во время упаковки и транспортировки. Закись азота также предотвращает окисление жирных продуктов и защищает их от гниения. Она находит применение в обработке кофе, вина, пива, мясных и рыбных изделий, продлевая их срок годности. Вещество широко используется в пищевой промышленности для упаковки разнообразных продуктов, включая мясные и рыбные изделия, фруктовые соки и вино. Она не вступает в реакцию с продуктами и напитками, сохраняя их первоначальные органолептические свойства: вкус, запах и текстуру. С 1980-х годов закись азота активно используется в виноделии для устранения нежелательного окисления и подавления размножения бактерий[15][3].
Несмотря на наличие более доступных пропеллентов таких, как двуокись углерода (CO2), закись азота демонстрирует особенно насыщенный вкус в пористых продуктах, таких как шоколад. Это связано с тем, что она образует более крупные пузырьки газа, что обеспечивает лучшее вкусовое восприятие[15][3].
Уровень опасности и меры предосторожности
Токсичность
При правильном медицинском использовании веселящий газ считается безопасным. Как и любой анестетик, он может вызывать побочные эффекты, такие как тошнота и головная боль. Частое применение может привести к нарушению обмена витамина B12, что важно для нормальной работы нервной системы и синтеза ДНК. Обезболивание закисью азота может быть противопоказана детям младше двух лет, людям с некоторыми пульмонологическими болезнями, заложенностью носа, дефицитом витамина B12 и тяжелыми психическими расстройствами[13].
Злоупотребление закисью азота или неправильное её использование может иметь серьёзные последствия, вплоть до летального исхода. Среди побочных эффектов и рисков самостоятельного применения закиси азота можно выделить следующие[13][15]:
- Гипоксия — вдыхание чистой закиси азота без достаточного количества кислорода может привести к гипоксии, то есть к недостатку кислорода в организме, что, в свою очередь, может вызвать повреждение мозга и других органов.
- Снижение артериального давления — закись азота может вызвать снижение артериального давления, что особенно опасно для людей с сердечно-сосудистыми заболеваниями.
- Потеря сознания — из-за гипоксии или других факторов человек может потерять сознание, что может привести к травмам или другим осложнениям.
- Смерть от удушья — вдыхание большого количества закиси азота без достаточного количества кислорода может привести к удушью и, как следствие, к смерти.
- Другие риски — длительное или частое использование закиси азота может привести к дефициту витамина B12, что, в свою очередь, может вызвать неврологические проблемы и другие осложнения.
- Наркоз с содержанием закиси азота противопоказан людям с тяжёлыми заболеваниями центральной нервной системы, при алкогольном опьянении и страдающим хроническим алкоголизмом. Применение закиси азота в таких случаях может вызвать приступ возбуждения, галлюцинации и другие нежелательные эффекты[13][15].
Меры предосторожности
Оборот закиси азота ограничен Федеральным законом Российской Федерации от 29 декабря 2020 года № 472-ФЗ «Об ограничении оборота закиси азота в Российской Федерации»[5].
Закись азота, предназначенная для медицинских целей, должна использоваться исключительно под контролем специалистов, прошедших соответствующее обучение. Это обеспечивает безопасность и эффективность применения данного газа. Важным аспектом является обязательное разбавление закиси азота кислородом. В медицинской практике применяется смесь, содержащая не менее 20% кислорода. В случае использования смеси с меньшим содержанием кислорода возможны серьёзные последствия, вплоть до остановки дыхания и летального исхода[11].
Экологическое воздействие
Закись азота (N₂O) представляет собой важный компонент атмосферы, и в 2020 году её концентрация достигла 535 частей на миллиард, увеличиваясь примерно на одну часть на миллиард в год. Этот газ является основным поглотителем стратосферного озона, и его воздействие на озоновый слой сравнимо с воздействием хлорфторуглеродов (ХФУ). Анализ данных за десятилетие, закончившееся в 2016 году, показывает, что около 40% выбросов закиси азота в атмосферу, составляющих 17 тераграммов азота в год, связаны с деятельностью человека. Рост выбросов обусловлен расширением сельского хозяйства и развитием промышленности в странах с развивающейся экономикой[9].
Процесс, при котором происходит разложение органических соединений азота с образованием аммиака (NH3) и аммония (NH4+), является ключевым этапом в круговороте азота в природе. Этот процесс осуществляется в почве и служит основным источником атмосферного аммиака. Окисление аммиака: аммиак, попадая в атмосферу, подвергается окислению до различных оксидов азота: закись азота, диоксид азота (NO2) и монооксид азота (NO). Эти оксиды азота играют значимую роль в химических процессах, происходящих в атмосфере[16].
Закись азота является третьим по значимости долгоживущим парниковым газом после углекислого газа (CO2) и метана (CH4) и вносит значительный вклад в глобальное потепление. Её долговечность в атмосфере и высокий потенциал глобального потепления делают её объектом пристального внимания и мониторинга выбросов[9].
Закись азота выполняет двойную функцию в атмосфере: она не только разрушает стратосферный озон, но и способствует глобальному потеплению. Это делает контроль и регулирование выбросов закиси азота критически важными для устойчивого развития и защиты окружающей среды[9].
Примечания
- ↑ 1,0 1,1 1,2 1,3 Ерёмин В.В., Антипин Р. Л., Дроздов А. А., Карпова Е. В., Рыжкова Н. О. Химия: углублённый курс для подготовки к ЕГЭ.. — М.: Эксмо, 2020. — С. 297. — 608 с. — ISBN 978-5-04-104070-3.
- ↑ 2,0 2,1 2,2 Рэмсден Э. Н. Начала современной химии. Справ, изд. / Пер. с англ./Под ред. В. И. Барановского, А. А. Белюстина, А. И. Ефимова, А. А. Потехина. — Л.: Химия, 1989. — С. 471. — 784 с. — ISBN 5-7245-0127-9.
- ↑ 3,0 3,1 3,2 Особенности применения пищевой закиси азота. Троицкий вариант (июль 2022). Дата обращения: 25 ноября 2024.
- ↑ 4,0 4,1 4,2 4,3 Оксид азота I: строение и химические свойства. Chemege.ru. Дата обращения: 25 ноября 2024.
- ↑ 5,0 5,1 Федеральный закон от 29 декабря 2020 г. № 472-ФЗ «Об ограничении оборота закиси азота в Российской Федерации». ГАРАНТ.РУ (20 сентября 2020). Дата обращения: 25 ноября 2024.
- ↑ 6,0 6,1 История веселящего газа. Azot Shop. Дата обращения: 25 ноября 2024.
- ↑ 7,0 7,1 7,2 7,3 Котова К. История одного изобретения: «веселящий газ». Dentalmagazine.ru (25 июля 2019). Дата обращения: 26 ноября 2024.
- ↑ 8,0 8,1 8,2 Паевский А. Продолжатель Аркадия. Выпуск 2. История молекул: веселящий газ. Mendeleev.info (8 октября 2021). Дата обращения: 26 ноября 2024.
- ↑ 9,00 9,01 9,02 9,03 9,04 9,05 9,06 9,07 9,08 9,09 9,10 9,11 9,12 9,13 9,14 9,15 9,16 Оксид азота. Ataman Kimya. Дата обращения: 25 ноября 2024.
- ↑ Хаускрофт К., Констебл Э. Современный курс общей химии. В 2-х т. Т.2. — М.: Мир, 2009. — С. 163. — 528 с. — ISBN 978-5-03-003310-5.
- ↑ 11,0 11,1 "Веселящий газ": область применения и влияние на организм человека. РИА Новости (18 сентября 2012). Дата обращения: 25 ноября 2024.
- ↑ Оксиды азота: виды, свойства и применение в медицинской, пищевой, аналитической и промышленной отраслях. S-GAS.COM (16 марта 2023). Дата обращения: 26 ноября 2024.
- ↑ 13,0 13,1 13,2 13,3 13,4 13,5 13,6 Белицкая С. Веселящий газ: что это, как действует, чем вредна закись азота, запрещен ли газ в России. АО «ТБанк» (2024-05-34). Дата обращения: 25 ноября 2024.
- ↑ Шеленин А. В. Ракетное топливо. Российский патент 2021 года RU 2761188 C1. Изобретение по МКП C06B25/22 .. Пантеон патентов (6 декабря 2021). Дата обращения: 25 ноября 2024.
- ↑ 15,0 15,1 15,2 15,3 15,4 Е942 пищевая добавка. Справочник Medum.ru. Дата обращения: 25 ноября 2024.
- ↑ Азот: история открытия, нахождение в природе, биохимический цикл азота.. Экологический мониторинг (3 января 2024). Дата обращения: 25 ноября 2024.
Данная статья имеет статус «готовой». Это не говорит о качестве статьи, однако в ней уже в достаточной степени раскрыта основная тема. Если вы хотите улучшить статью — правьте смело! |





![{\displaystyle {\ce {2N2O + S ->[t] 2N2 + SO2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d6cb53b68d71ed9ae2cb6a8c93a8f106c362aa46)
![{\displaystyle {\ce {5N2O + p ->[t] 5N2 + P2O5}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/61cbe01aedca544db2b2d8290df659e2fbb82812)
![{\displaystyle {\ce {2N2O + 2NH3 ->[t] 4N2 + 3H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/63c855c2a278f6561b0a5b6e2c1f0ee5afe9dcb2)
![{\displaystyle {\ce {2N2O + SO2 + H2O ->[t] N2 + H2SO4}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/795aed15075e101a49a0b81a254da1e33b11bfad)
![{\displaystyle {\ce {5N2O + 3H2SO4 + 2KMnO4 ->[t] 10NO + 2MnSO4 + K2SO4 + 3H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d4bb399a1c3b20f9ac992c1444c8fc9d56e56e3a)
![{\displaystyle {\ce {2N2O ->[t] 2N2 + O2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c23f91cdd0e6ccef4779d5eaf8ee0e86b2d5042f)