Оксид кальция
| Оксид кальция | |
|---|---|
- | |
| Общие | |
| Систематическое наименование |
Оксид кальция, окись кальция |
| Традиционные названия | оксид кальция, негашёная известь, жжёная известь, кирабит; кипелка |
| Хим. формула | CaO |
| Рац. формула | CaO |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 56.077 г/моль |
| Плотность | 3.37 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 2570 °C |
| • кипения | 2850 °C |
| Мол. теплоёмк. | 42.05 Дж/(моль·К) |
| Энтальпия | |
| • образования | -635.09 кДж/моль |
| Безопасность | |
| Предельная концентрация | 1 мг/м³ |
| ЛД50 | 100 мг/кг |
| Токсичность | Зарегистрированные препараты оксида кальция относятся ко 2-му классу опасности для человека, оказывают общетоксическое действие. |
| Пиктограммы ECB |
|
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Окси́д ка́льция (негашёная известь, жжёная известь, кирабит, «кипелка», окись кальция, Е529) — представляет собой неорганическое соединение с химической формулой CaO. Вещество характеризуется кубической кристаллической структурой и высокой плотностью, составляющей 3,4 г/см³ при температуре 20 °C. Молекулярная масса оксида кальция равна 56,08 а. е. м. (атомных единиц массы). Оксид кальция обладает исключительной термостойкостью. Активно взаимодействует с водой, образуя гидроксид кальция (Ca(OH)₂), но практически не растворим в этаноле и этилацетате[1].
Методы получения оксида кальция включают высокотемпературный обжиг известняка (CaCO₃) при 900—1000 °C и термическое разложение нитрата кальция (Ca(NO₃)₂). Оксид кальция (CaO) — высокоактивное вещество, вступающее в реакции с различными веществами. При нагревании он реагирует с SiO₂, Fe₂O₃ и Al₂O₃, образуя силикаты, ферриты и алюминаты кальция. С кислотами CaO образует соли. При высоких температурах он восстанавливает металлы (Na, K, Mg, Al) до кальция. Также реагирует с P, S и C, образуя фосфид, сульфид и карбид кальция[1].
История открытия
Эпоха неолита (примерно около 7500 лет до нашей эры)
Наиболее ранние археологические свидетельства использования оксида кальция относятся к докерамическому неолиту, периоду, ознаменовавшему переход к оседлому образу жизни и земледелию. В этот исторический этап человечество начало осваивать базовые принципы строительства жилищ и ведения хозяйства, что привело к формированию первых архитектурных комплексов на территории Ближнего Востока и Малой Азии, особенно в регионе Анатолии[2].
Анализ археологических данных свидетельствует о том, что древние жители региона использовали примитивные технологии для обжига природных залежей известняка в кострищах, что позволяло получать строительные растворы с высокими связующими свойствами. Эти смеси использовались для того, чтобы соединять кирпичи и каменные блоки, что значительно увеличивало надёжность и долговечность архитектурных сооружений[2].
Поселение Чатал-Хююк, Турция (~7500-5700 годы до нашей эры)
Чатал-Хююк, одно из древнейших поселений раннего неолита, расположенное в южной части современной Турции, представляет собой уникальный пример ранней урбанизации. В ходе раскопок здесь были обнаружены многочисленные артефакты, свидетельствующие о применении известковых растворов в качестве связующих материалов в строительстве. Растворы использовались для скрепления кирпичей и каменных блоков, что обеспечивало высокую прочность и долговечность сооружений, многие из которых сохранились до наших дней[2].
Иерихон, Палестина (~7000 лет до до нашей эры)
Иерихон, одно из древнейших известных поселений человечества, расположенное на территории современной Палестины, также демонстрирует использование извести в строительных технологиях. Исследования показывают, что уже в этот период стены зданий покрывались штукатуркой на основе обожжённого известняка, смешанного с водой. Это позволяло не только защищать конструкции от воздействия влаги, но и придавать поверхностям гладкость и белый цвет, что значительно улучшало эстетические качества интерьеров[2].
Древний Египет (3000-2000 годы до нашей эры)
Оксид кальция, также известный как негашёная известь, занимал центральное место в древнеегипетской культуре, находя применение в различных сферах, включая строительство и ритуальные практики. Этот материал, благодаря своим уникальным физико-химическим свойствам, стал неотъемлемой частью технологического арсенала египтян, способствуя возведению монументальных архитектурных сооружений и реализации сложных погребальных обрядов[3][4].
Применение оксида кальция в строительстве
В течение тысячелетий древнеегипетские мастера активно использовали различные соединения кальция, включая гидратированную известь, для создания долговечных и прочных конструкций. Применение известкового раствора в строительстве было особенно значимым для возведения грандиозных монументов, таких как знаменитые египетские пирамиды[3].
Исследования, проведённые внутри Великой Пирамиды Хеопса, выявили наличие следов известковой штукатурки, что свидетельствует о применении данного материала в качестве связующего компонента строительных конструкций. Это открытие подтверждает высокую технологическую компетентность древних египтян в области использования извести[3][4].
Не менее важную роль известь играла в отделке храмовых комплексов, таких как Луксор и Карнак. Многочисленные археологические находки указывают на то, что стены храмов украшались слоем известковой побелки, которая не только придавала сооружениям эстетически привлекательный белый цвет, но и обеспечивала надёжную защиту от воздействия влаги и предотвращала разрушение каменных конструкций. Строительная деятельность в Древнем Египте демонстрировала высокий уровень технологического мастерства и эффективного использования оксида кальция, что способствовало созданию долговечных памятников архитектуры, сохранившихся до наших дней[3][4].
Использование извести в мумификации и похоронной культуре
Помимо строительной сферы, оксид кальция находил применение и в ритуальных практиках, связанных с мумификацией и погребальной культурой древнего народа. В процессе мумификации древние египтяне использовали измельчённую известь в качестве дезинфицирующего средства, что позволяло предотвратить разложение тела умершего. Эта практика была особенно важна для достижения главной цели мумификации — сохранения тела человека для загробной жизни. Применение извести обеспечивало сохранение мумии в течение длительного времени, что являлось неотъемлемой частью религиозных верований египтян о жизни после смерти[3][4].
Археологические исследования также выявили наличие изделий из известняка, таких как саркофаги, которые использовались в погребальных обрядах. Примером таких артефактов являются каменные гробницы, найденные в некрополе Саккара, выполненные из известняковых блоков и украшенные символическими изображениями и иероглифами. Известь играла ключевую роль не только в архитектурной сфере, но и в религиозной и культовой практике Древнего Египта, отражая глубокое уважение египтян к загробному миру и стремление обеспечить достойное посмертное существование для своих предков[3].
Месопотамия (3000-2000 годы до нашей эры)
На территории древних цивилизаций Шумер и Вавилон известь играла ключевую роль в различных сферах человеческой деятельности, что свидетельствует о высоком уровне технологического развития этих культур[5].
Использование извести в строительной практике
Одним из наиболее значимых аспектов применения извести в древнем строительстве было её использование в качестве добавки к глине при изготовлении кирпича и возведении стен. Древние жители Месопотамии эмпирически установили, что введение известкового порошка в глиняный раствор значительно повышает его прочность, что способствовало созданию более устойчивых и долговечных конструкций, особенно в условиях влажного климата региона. Применение известковых смесей также существенно улучшало гидроизоляционные свойства строительных материалов, что было критически важно в районах, подверженных частым наводнениям рек Тигр и Евфрат. Известь не только повышала прочность сооружений, но и обеспечивала их защиту от воздействия влаги, что способствовало увеличению срока службы зданий и сооружений[5].
Известь в декоративно-прикладном искусстве
Помимо строительной функции, известь играла важную роль в декоративно-прикладном искусстве Месопотамии. В частности, она использовалась для изготовления специальных глазурей, которые наносились на изделия из глины и керамики. Эти глазури позволяли создавать яркие и насыщенные цвета, а также обеспечивать гладкую поверхность и повышенную устойчивость к внешним воздействиям. Применение глазурей не только придавало изделиям эстетическую ценность, но и значительно увеличивало их долговечность, что было особенно важно для предметов быта и ритуальных объектов[5].
Археологические и письменные свидетельства
Археологические находки предоставляют доказательства широкого распространения технологии производства и применения извести в Месопотамии уже в III тысячелетии до нашей эры. Во время раскопок города Ура были обнаружены фрагменты зданий, покрытые слоем известковой штукатурки, что свидетельствует о высоком уровне строительной культуры и использовании специализированных покрытий для улучшения внешнего вида и сохранения конструкций[5].
Значительные данные о применении извести также сохранились благодаря письменным источникам. Клинописные таблички из знаменитой библиотеки царя Ашшурбанипала содержат подробные описания процесса добычи сырья, технологии изготовления извести и её последующего применения в строительной практике древнего государства Ассирия. Эти записи позволяют получить представление о высоком уровне развития химической промышленности и технологий обработки природных ресурсов, достигнутом жителями древней Месопотамии[5].
Античный период: применение оксида кальция в Древней Греции и Риме
Древние греки и римляне значительно усовершенствовали технологии производства и применения извести, создав на её основе уникальные строительные материалы, которые до сих пор вызывают восхищение своей долговечностью и прочностью. Одним из таких материалов стал «римский бетон» (opus caementicium), который стал настоящим технологическим прорывом своего времени[6][7].
Технологические особенности римского бетона: Римский бетон представлял собой композитный материал, состоящий из нескольких ключевых компонентов. Основным связующим веществом служила известь (оксид кальция, CaO), которая при гидратации образовывала прочный цементный камень. Для улучшения эксплуатационных характеристик бетона римляне использовали вулканический пепел, известный как пуццолан. Этот природный материал обладал способностью связывать известь с мелкозернистым заполнителем, что обеспечивало повышенную прочность и водонепроницаемость смеси. В качестве заполнителей применялись песок и мелкие камни, что придавало бетону необходимую механическую устойчивость и снижало усадочные деформации[6][7].
Интеграция оксида кальция в производство бетона через горячий метод смешивания имеет ряд преимуществ: способствует самовосстановлению бетонной конструкции, ускоряет гидратацию и твердение цемента, а также расширяет возможности химической модификации бетона, улучшая его механические характеристики, химическую стойкость и долговечность[8].
Знаменитые памятники архитектуры и инженерные сооружения: Одним из наиболее ярких примеров применения римского бетона является Пантеон в Риме, построенный в 126 году Купол этого храма диаметром почти 43 метра до сих пор является одним из самых впечатляющих архитектурных достижений античности. Конструкция купола выполнена из бетона с использованием специальных растворов на основе извести, что обеспечило его высокую прочность и устойчивость к внешним воздействиям[8][9][10].
Древняя Русь
В контексте древнерусского строительного дела, проблема недостаточной водостойкости воздушной извести представляла собой значительное препятствие для обеспечения долговечности и устойчивости возводимых сооружений. В отличие от инновационного римского бетона, в котором активно применялись пуццоланы — вулканические пеплы, обладавшие гидравлическими свойствами, на Руси была разработана альтернативная технология, основанная на использовании цемянки. Эта добавка, представляющая собой мелкотолчёный керамический кирпич или глиняную черепицу, стала ключевым элементом древнерусских строительных растворов[11][6].
Основной компонент древнерусских строительных смесей — гашёная известь (Ca(OH)₂), которая при гидратации формирует основу для связывания компонентов раствора. Гидравлическая добавка в виде цемянки, состоящей из перемолотого кирпичного боя или глиняной крошки, вступала в реакцию с известью при контакте с водой. В результате этой химической реакции кремнезём и глинозём, содержащиеся в цемянке, трансформировались в гидросиликаты кальция, аналогичные современным цементным соединениям. Процесс обеспечивал необходимую водостойкость и прочность строительных растворов[11].
Археологические исследования и письменные источники позволяют реконструировать применение цемянки в древнерусском строительстве. В кладке Софийского собора в Киеве, возведённого в XI веке, были обнаружены известковые растворы, содержащие кирпичную крошку. Аналогичные находки зафиксированы и в новгородских храмах XII-XIV веков, таких как церковь Спаса на Нередице. Письменные источники также подтверждают использование «извести с толчёным плинфом» (плинфа — тонкий кирпич византийского типа), что свидетельствует о систематическом применении данной технологии в древнерусском зодчестве[11][12].
Военное использование негашёной извести
Римская тактика (I век до нашей эры)
Пример эффективного военного применения негашёной извести связан с периодом правления древнеримского полководца Квинта Сертория. В ходе войны с харукитанами (Испания, около 80 года до нашей эры), он впервые продемонстрировал необычную стратегию ведения боя. По приказу Сертория специально подготовленные сосуды наполнялись измельчённой негашёной известью, которая хранилась в сухом виде. Во время битвы эти ёмкости бросались в сторону неприятеля, где разбивались, освобождая большое облако едкой известковой пыли. Эффект от этой химической атаки был весьма значительным: противник испытывал острое чувство удушья, раздражения дыхательных путей и глаз, подвергался воздействию высокой температуры реакции гидратации CaO, терял ориентацию и боевую эффективность. Такая мера оказывала сильное психологическое воздействие, способствуя быстрой победе над врагом[13].
Китайское изобретение: известные колесницы (II век нашей эры)
Около 178 года нашей эры китайские мастера разработали особый вид боевой техники, названный «известковыми колесницами». Конструкция включала специальные устройства, нагревавшие негашёную известь до высоких температур, вследствие чего она превращалась в густые облака горячего пара и токсичной известковой пыли. Этот пар смешивался с воздухом, распространялся среди солдат неприятельских армий, вызывая резкую боль в глазах, кашель, воспаление дыхательных путей и значительно снижая боеспособность врага. Известковые колесницы активно использовались китайской армией для борьбы с повстанческими движениями внутри страны и демонстрировали высокую эффективность в качестве средства массового поражения[13].
Применение извести в средневековых морях
Известна практика использования негашёной извести и в военно-морских операциях Средних веков. Записи историка Давида Юма свидетельствуют о применении извести англичанами в борьбе с французским флотом. Корабли неприятелей обстреливали небольшими порциями сухой негашёной извести, помещёнными в особые снаряды. После попадания на палубу судна или в трюмы суда эта известь вступала в контакт с морской водой, быстро разогреваясь и высвобождая клубы горячей пыли и газа. Такой метод оказывал сильнейшее влияние на моральный дух экипажа корабля: моряки испытывали трудности с дыханием, ощущали ожоги кожи и слизистой оболочки глаз, вынуждены были прекращать боевые действия[13].
Составляющие греческого огня
Один из наиболее загадочных аспектов использования негашёной извести относится к рецепту знаменитого греческого огня, применяемого Византией в VII-X веках. Согласно некоторым исследованиям, оксид кальция мог входить в состав греческого огня наряду с нефтью, серой и другими горючими веществами. Предполагается, что реакция гидратации извести служила катализатором процесса возгорания смеси, обеспечивая быстрое повышение температуры и интенсивность пламени. Поскольку греческий огонь обладал уникальным свойством гореть даже на воде, считалось, что негашёная известь играла важную роль в поддержании его стойкости и устойчивости к тушению[13].
Свойства вещества
Химическое строение
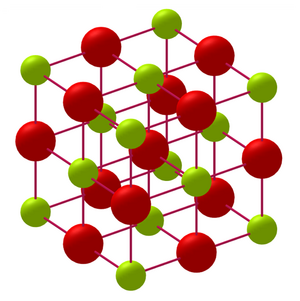
Оксид кальция образует кубическую гранецентрированную кристаллическую решётку (тип хлорида натрия, пространственная группа Fm3m). В структуре каждый ион кальция (Ca²⁺) окружён шестью ионами кислорода (O²⁻), и наоборот[14][15]. Параметры решётки[16]:
- Плотность: 3.37 г/см³;
- Межатомное расстояние Ca-O: 2.40 Å;
- Координационное число: 6 для обоих ионов.
Структура стабилизируется ионной связью, образованной переходом двух электронов от кальция к атому кислорода. Энергия ионизации кальция составляет 6.9 эВ, что обусловливает высокую полярность связи[17][18].
Физические свойства
Общие физические свойства вещества
- Внешний вид и морфология: Оксид кальция представляет собой мелкодисперсный порошок белого или сероватого цвета, не обладающий выраженным запахом.
- Гигроскопичность и адсорбционные свойства: Оксид кальция проявляет высокую гигроскопичность, активно поглощая влагу из атмосферы. Кроме того, он способен абсорбировать углекислый газ, что делает его эффективным реагентом для декарбонизации газовых сред.
- Растворимость в растворителях: Вещество хорошо растворимо в глицерине, что позволяет использовать его в качестве компонента различных технологических растворов. В то же время оксид кальция практически нерастворим в этиловом спирте и воде. При контакте с водой происходит экзотермическая реакция с образованием гидроксида кальция (Ca(OH)₂), сопровождающаяся выделением значительного количества тепла.
- Термические характеристики: Оксид кальция обладает высокими температурами плавления и кипения, составляющими 2572 °C и 2850 °C соответственно.
- Оптические параметры: Показатель преломления оксида кальция для D-линии натрия составляет 1,8380 при температуре 20 °C, что указывает на его высокую оптическую плотность и прозрачность в видимом спектре.
- Плотность и молярная масса: Плотность вещества составляет 3,35 г/см³, а его молярная масса равна 56,08 г/моль.
- Теплопроводность и диэлектрические свойства: Оксид кальция характеризуется высокой теплопроводностью, что делает его незаменимым в системах теплообмена. Кроме того, вещество обладает хорошими диэлектрическими свойствами, что позволяет использовать его в электроизоляционных материалах[1][19].
Стандартные термодинамические свойства
Стандартная энтальпия образования (ΔH°₂₉₈, кДж/моль)
- Для твёрдого состояния: −635,5 кДж/моль
- Для газообразного состояния: −26 кДж/моль
Энтальпия образования представляет собой термодинамическую величину, характеризующую количество энергии, выделяемой или поглощаемой при образовании одного моля данного вещества из его элементов в условиях стандартного состояния (298 К и 1 бар). Для CaO энтальпия образования в твёрдом состоянии указывает на значительное экзотермическое выделение энергии, что свидетельствует о высокой энергетической стабильности соединения[1].
Стандартная энергия Гиббса образования (ΔG°₂₉₈, кДж/моль)
Для твёрдого состояния: −604,2 кДж/моль
Энергия Гиббса образования является важным термодинамическим параметром, позволяющим оценить термодинамическую устойчивость вещества и его способность к спонтанному образованию в условиях стандартного состояния. Отрицательное значение ΔG°₂₉₈ для CaO подтверждает его высокую термодинамическую стабильность и склонность к самопроизвольному образованию из элементов[1].
Стандартная энтропия (S°₂₉₈, Дж/(моль·К))
- Для твёрдого состояния: 39,7 Дж/(моль·К)
- Для газообразного состояния: 219,6 Дж/(моль·К)
Энтропия является фундаментальной термодинамической характеристикой, отражающей степень беспорядка в системе. Более высокие значения энтропии свидетельствуют о большей степени неупорядоченности, что характерно для газообразного состояния CaO по сравнению с его твёрдым аналогом. Это различие обусловлено различиями в молекулярной подвижности и конфигурационных возможностях частиц в различных агрегатных состояниях[1].
Стандартная мольная теплоёмкость (Cₚ°₂₉₈, Дж/(моль·К))
Для твёрдого состояния: 42,8 Дж/(моль·К)
Теплоёмкость является термодинамической характеристикой, описывающей количество тепла, необходимое для повышения температуры одного моля вещества на один градус Кельвина. Высокое значение теплоёмкости для твёрдого CaO указывает на его способность аккумулировать значительное количество тепловой энергии при нагревании, что имеет важное значение для его применения в теплотехнических процессах[1].
Энтальпия плавления (ΔH°пл, кДж/моль)
50 кДж/моль
Энтальпия плавления представляет собой термодинамическую величину, характеризующую количество энергии, необходимое для фазового перехода вещества из твёрдого состояния в жидкое при температуре плавления. Для CaO данное значение составляет 50 кДж/моль, что указывает на относительно высокую энергетическую стоимость этого процесса[1].
Химические свойства
Оксид кальция (негашёная известь, CaO) — типичный основный оксид, проявляющий высокую химическую активность.
Реакции с водой и гидратация
Ключевая характеристика CaO — экзотермическое взаимодействие с водой с образованием гидроксида кальция[20]:
Процесс, известный как «гашение извести», сопровождается увеличением объёма в 2.5 раза, выделением пара и тепла[21]. Реакция необратима при комнатной температуре, но становится обратимой выше 580 °C[18].
Взаимодействие с кислотами
CaO нейтрализует кислоты, образуя соли кальция[20]:
- Реакция с соляной кислотой с образованием хлорида кальция и воды.
- Реакция с серной кислотой с образованием сульфата кальция и воды.
Реакции с кислотными и амфотерными оксидами оксидами
CaO связывает кислотные и амфотерные оксиды, образуя соли[22]:
- С оксидом углерода(IV) образуется карбонат кальция:
- С оксидом серы(IV) образуется сульфит кальция:
- С оксидом алюминия образуется алюминат кальция:
Реакции с восстановителями
При высоких температурах CaO восстанавливается до металла или образует бинарные соединения[22]:
- С углеродом (1900—1950 °C) образуется ацетиленид кальция (карбид кальция) и угарный газ:
- С алюминием (1200 °C) образуется кальций и оксид алюминия:
Реакции с хлором
- В реакции с хлором образуется хлорид кальция и кислород[23][15]:
- Реакция с хлором может привести к образованию гипохлорита кальция[24]:
Реакция с пероксидом водорода
- С пероксидом водорода образуется кристаллогидрат пероксида кальция[25]:
Способы получения
Прямое взаимодействие металла с кислородом
При сгорании кальция на воздухе при высоких температурах происходит его взаимодействие с молекулами кислорода, что приводит к образованию кристаллического оксида кальция. Этот метод характеризуется высокой ценой реактива, что делает его затратным и редко применяемым в промышленных масштабах. Однако он используется в лабораторных условиях для получения небольших количеств[22].
Термическое разложение карбонатов
Наиболее распространённым промышленным методом синтеза оксида кальция является термическое разложение карбоната кальция[22]:
При нагревании кальцита до температуры 900—1000 °C происходит его эндотермическое разложение на оксид кальция и углекислый газ. Данный метод является основным в производстве оксида кальция. Он характеризуется высокой экономичностью и широко применяется в крупномасштабных промышленных процессах[22].
Термическое разложение сульфатов
Разложение сульфата кальция, или гипса, также может быть использовано для получения оксида кальция. Эта реакция протекает при значительно более высоких температурах и описывается следующим уравнением[22]:
Процесс требует температур выше 1000 °C, что делает его менее экономичным и практически не применяемым в промышленных масштабах. Однако он может быть полезен в лабораторных условиях для синтеза малых количеств CaO[22].
Восстановление оксидов кальцием
В некоторых случаях оксид кальция может быть получен путём восстановления оксидов. Например, восстановление оксида кремния кальцием описывается следующей реакцией[22]:
Этот метод требует избытка кальция и высоких температур, что делает его сложным и дорогостоящим. В связи с этим он редко применяется на практике и чаще всего используется в научных исследованиях[22].
Термическое разложение нитратов
Ещё одним способом получения оксида кальция является термическое разложение нитрата кальция[22]:
Разложение нитрата кальция происходит при температурах выше 500—600 °C и сопровождается образованием двуокиси азота и молекулярного кислорода. Этот метод используется преимущественно в лабораторных условиях для получения высокочистого оксида кальция[22].
Горение нитридов
Горение нитрида кальция также может быть использовано для синтеза оксида кальция[22]:
Эта реакция протекает при высоких температурах и сопровождается образованием молекулярного азота. Данный метод редко применяется на практике и чаще всего используется в научных исследованиях[22].
Восстановление карбонатов углеродом
Одним из экономически выгодных методов получения оксида кальция является восстановление карбоната кальция углеродом[22]:
Этот процесс, известный как обжиг с углеродом, протекает при температуре 800 °C и характеризуется образованием монооксида углерода. Метод широко используется в специализированных отраслях промышленности, таких как производство строительных материалов и цемента[22].
Применение
Негашёная известь (оксид кальция, CaO) — это ценное химическое соединение, широко используемое в различных областях. Основные сферы применения включают[13]:
- Производство стали: основное применение в кислородно-конвертерном процессе (BOS), где расходуется 30-50 кг на тонну стали. Известь используется для нейтрализации кислотных (и амфтотерных) оксидов (SiO2, Al2O3, Fe2O3).
- Строительство и производство материалов: известь применяется для изготовления газобетона (плотность 0,6-1,0 г/см³) и укрепления глинистых грунтов. Также она используется в производстве цемента и штукатурных работах, в исторических, как и в современных реставрационных проектах[26].
- Энергетическое применение: экзотермическая реакция при гашении извести выделяет 5,54 МДж энергии, что позволяет использовать её в самонагревающихся упаковках для пищи.
- Исторически известь применялась в освещении, например, в прожекторах, нагреваемых до 2400 °C.
- Химическая промышленность: известь используется в производстве стекла, алюминатно-кальциевого цемента, а также в органическом синтезе, обработке питьевой воды и очистке промышленных газов от SO2.
- Нефтяная промышленность: известь применяется для обнаружения воды в топливных резервуарах и в индикаторных пастах с фенолфталеином.
- Целлюлозно-бумажная промышленность: известь используется для регенерации NaOH из Na2CO3 и химической обработки целлюлозы.
- Горнодобывающая промышленность: известь применяется для разрушения горных пород и в специальных картриджах с водой.
- Используется для известкования почвы, защиты деревьев от вредителей и побелки хозяйственных помещений. Это вещество эффективно снижает кислотность грунта, служит источником кальция для растений и помогает бороться с сорняками, однако его применение требует соблюдения осторожности и недопустимо в сочетании с навозом. При правильном использовании негашёная известь значительно улучшает качество почвы и повышает урожайность, но вносить её следует не чаще одного раза в 3-4 года[27].
В 2023 году мировое производство извести составило примерно 430 миллионов метрических тонн. С 2010 года, когда объёмы производства составляли 311 миллионов метрических тонн, мировое производство извести в целом увеличилось[28], при этом Китай является крупнейшим производителем (около 170 млн тонн в год), за ним следуют США (около 20 млн тонн в год)[13].
Уровень опасности и меры предосторожности
Уровень опасности
Оксид кальция, известный как негашёная известь, представляет собой вещество, относящееся ко второму классу опасности. Это высокоопасное соединение, обладающее сильными раздражающими и коррозионными свойствами. В связи с этим, при работе с ним необходимо соблюдать строгие меры предосторожности[19][29].
Токсикологическая характеристика оксида кальция включает в себя следующие аспекты[19][29]:
- Воздействие на кожу и слизистые оболочки. Контакт с кожей вызывает химические ожоги, которые могут привести к глубокому повреждению тканей. Попадание в глаза может вызвать язвы роговицы и даже слепоту. Вдыхание пыли или аэрозолей раздражает дыхательные пути, вызывая кашель, пневмонию и отёк лёгких. Проглатывание оксида кальция может привести к ожогам пищевода и желудка, а также к перфорациям и внутренним кровотечениям.
- Хроническое воздействие. Длительный контакт с известковой пылью может вызвать дерматиты, изъязвление кожи, хронический ринит, прободение носовой перегородки и профессиональную бронхиальную астму.
Первая помощь
Первая помощь при отравлении оксидом кальция включает в себя следующие действия[19][30]:
- При попадании на кожу необходимо немедленно смыть вещество большим количеством воды в течение не менее 15 минут и снять загрязнённую одежду. При попадании в глаза необходимо промывать их проточной водой в течение не менее 20 минут, при этом веки должны быть открытыми.
- При вдыхании необходимо вывести пострадавшего на свежий воздух, обеспечить покой и, при необходимости, провести ингаляцию кислородом. При проглатывании не следует вызывать рвоту, так как это может привести к повторному ожогу пищевода. Пострадавшему следует дать выпить молоко или воду, если он находится в сознании.
Во всех случаях требуется срочная медицинская помощь[19][30].
Меры безопасности
Производственные меры, направленные на обеспечение безопасности при работе с оксидом кальция, включают в себя[19][30]:
- Индивидуальную защиту органов дыхания, такую как респиратор класса FFP3 или противогаз с фильтром от пыли.
- Защиту глаз с помощью герметичных очков или защитного щитка[31].
- Защиту кожи с помощью кислото- и щёлочестойких перчаток, таких как нитриловые или неопреновые, а также спецодежды с длинными рукавами[19][31].
- Обязательная принудительная вентиляция производственных помещений для поддержания оптимального уровня кислорода и минимизации концентрации вредных веществ в воздухе рабочей зоны. Предельно допустимая концентрация (ПДК) оксида кальция не должна превышать 2 мг/м³, что соответствует установленным нормам промышленной гигиены[31].
- Категорический запрет на использование сухой уборки, которая может привести к образованию пыли и аэрозолей. Вместо этого рекомендуется применять влажную уборку или специализированные промышленные пылесосы, оснащённые фильтрами высокой степени очистки.
- Хранение и транспортировка оксида кальция должны осуществляться в герметичных контейнерах, изготовленных из полиэтилена, ламинированных материалов, стали или пластика. Это предотвращает возможность утечки и контакта вещества с окружающей средой. Условия хранения должны соответствовать строгим требованиям: помещения должны быть сухими, хорошо проветриваемыми и удалёнными от источников влаги, кислот и фтора, которые могут вступать в химическую реакцию с оксидом кальция.
- Маркировка контейнеров должна содержать знак «Едкое вещество» (UN 1910, класс 8), что указывает на необходимость соблюдения повышенных мер предосторожности при обращении с данным веществом[19][30].
Оксид кальция, являясь важным промышленным реагентом, требует строгого соблюдения техники безопасности. Нарушение установленных правил работы с этим веществом может привести к серьёзным химическим травмам, включая ожоги кожи и слизистых оболочек, а также к развитию профессиональных заболеваний, таких как хронические респираторные патологии[19][30].
Примечания
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 Кипер Р. А. Свойства вещества: кальция оксид. Химия и токсикология. Дата обращения: 11 июня 2025.
- ↑ 2,0 2,1 2,2 2,3 Hodder I. The leopard’s tale. Revealing the mysteries of Çatalhöyük. — London: Thames & Hudson, 2006. — ISBN 978-0500051412..
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 Lucas A., Harris J. Ancient Egyptian Materials and Industries 4th ed. Edition / Harris J.. — Нью-Йорк: Dover Publications, 2012. — 540 с. — ISBN 978-0486224460.
- ↑ 4,0 4,1 4,2 4,3 Nicholson P.T., Shaw I. Ancient Egyptian Materials and Technology. — Cambridge: Cambridge University Press, 2012. — 702 с. — ISBN 978-0521120982.
- ↑ 5,0 5,1 5,2 5,3 5,4 Moorey P. R. S. Ancient Mesopotamian Materials and Industries: The Archaeological Evidence.. — Oxford: Clarendon Press, 1994. — 456 с. — ISBN 978-0198149217.
- ↑ 6,0 6,1 6,2 Известь: История. Самарский завод «Строммашина». Дата обращения: 8 июня 2025.
- ↑ 7,0 7,1 Глава II. Опус цементум - римский бетон. СимпоZий Συμπόσιον. Дата обращения: 8 июня 2025.
- ↑ 8,0 8,1 Chandler D. L. Riddle solved: Why was Roman concrete so durable? (англ.). Mit News (6 января 2023). Дата обращения: 8 июня 2025.
- ↑ Moore D. The Pantheon (англ.). Romanconcrete · com (1999). Дата обращения: 8 июня 2025.
- ↑ Почему римский бетон был прочным и под водой. Castle.men. Дата обращения: 8 июня 2025.
- ↑ 11,0 11,1 11,2 Медникова Е.Ю., Пескова А.А. Строительные растворы из архитектурных памятников южной Руси. РусАрх (2008). Дата обращения: 8 июня 2025.
- ↑ Заграевский С.В. Организация добычи и обработки белого камня в Древней Руси. РусАрх (2007). Дата обращения: 8 июня 2025.
- ↑ 13,0 13,1 13,2 13,3 13,4 13,5 Оксид кальция. Ataman chemicals. Дата обращения: 14 апреля 2025.
- ↑ Оксид кальция. Образовака. Дата обращения: 13 июня 2025.
- ↑ 15,0 15,1 Кальция оксид. БРЭ. Дата обращения: 13 июня 2025.
- ↑ Сакович Р. А., Шаулов А. Ю. Начальные стадии формирования надмолекулярной структуры оксидов Ca и Mg // Журнал неорганической химии : журнал. — 2023. — Т. 68, № 8. — С. 1077—1082. — ISSN 0044-457X.
- ↑ Жаворонков Н. М. [и др.] Химическая энциклопедия: В 5 т. / под (общей) редакцией Кнунянц И. Л.. — М.: Мир, 1990. — Т. 2. — С. 293. — ISBN 5-85270-035-5.
- ↑ 18,0 18,1 Кучеренко А. А. Химическая термодинамика гидратации известкового вяжущего. ResearchGate GmbH (2012). Дата обращения: 15 июня 2025.
- ↑ 19,0 19,1 19,2 19,3 19,4 19,5 19,6 19,7 19,8 Оксид кальция. Свойства и меры предосторожности. ПраймКемикалсГрупп (21 февраля 2020). Дата обращения: 14 апреля 2025.
- ↑ 20,0 20,1 Оксид кальция: способы получения и химические свойства. Chemege.ru. Дата обращения: 13 июня 2025.
- ↑ Гашеная известь. Стройцентр ИНКОМ. Дата обращения: 15 июня 2025.
- ↑ 22,00 22,01 22,02 22,03 22,04 22,05 22,06 22,07 22,08 22,09 22,10 22,11 22,12 22,13 22,14 Оксид кальция, CaO, химические свойства, получение. Acetyl. Дата обращения: 15 июня 2025.
- ↑ Химические Уравнения oнлайн!. Дата обращения: 15 июня 2025.
- ↑ Calcium Oxide (англ.). GeeksforGeeks (30 июля 2024). Дата обращения: 15 июня 2025.
- ↑ Третьяков Ю.Д., Мартыненко Л.И., Григорьев А.Н., Цивадзе А.Ю. Неорганическая химия. Том 2.. — М.: Химия, 2001. — ISBN 5-03-003190-0.
- ↑ Скачать ГОСТ 9179-2018 Известь строительная. Технические условия. Статус-Грунт. Дата обращения: 15 апреля 2025.
- ↑ Негашеная известь - средство для побелки и для борьбы с сорняками. Мульча.рф. Дата обращения: 13 июня 2025.
- ↑ Jaganmohan M. Global lime production 2010-2023 (англ.). Statista (19 апреля 2024). Дата обращения: 29 мая 2025.
- ↑ 29,0 29,1 ГОСТ 12.1.007-76 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности. Стандартинформ (2007). Дата обращения: 14 апреля 2025.
- ↑ 30,0 30,1 30,2 30,3 30,4 Calcium oxide Safety Data Sheets (англ.). Echemi Digital Technology Co. Дата обращения: 15 апреля 2025.
- ↑ 31,0 31,1 31,2 Кальция оксид. Химпром-М. Дата обращения: 12 июня 2025.