Оксид меди (II)
| Оксид меди | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
Оксид меди(II) |
| Хим. формула | CuO |
| Физические свойства | |
| Состояние | черный порошок |
| Молярная масса | 79,545 г/моль |
| Плотность | 6,31 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 1447 °C |
| • кипения | 2000 °C |
| • разложения | 1100 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | нерастворим |
| Классификация | |
| Рег. номер CAS | [1317-38-0] |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
| Оксид меди | |
|---|---|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Окси́д ме́ди (II) (окись меди, монооксид меди, чёрный оксид меди) — бинарное соединение меди в степени окисления +2 и кислорода −2 (CuO). Представляет собой кристаллическое вещество чёрного цвета. Материал характеризуется высокой химической стабильностью и практически нерастворим в водной среде[1][2][3].
Проявляет амфотерные свойства с преобладанием основных и слабовыраженными кислотными свойствами. В окислительно-восстановительных реакциях оксид меди(II) проявляет выраженные окислительные свойства, обусловленные наличием атомов меди в степени окисления +2[1][2][3].
В природных условиях данный оксид встречается в виде минерала тенорита, который также известен под альтернативным названием мелаконит. Оксид меди(II), как и большинство её соединений, обладает высокой токсичностью, что требует особого внимания при обращении с ним[1][2][3].
История открытия
Оксид меди(II), или CuO, является одним из древнейших химических соединений, используемых человечеством. Его история восходит к зарождению металлургии, хотя точная дата открытия остаётся неизвестной. Первые документальные свидетельства применения CuO датируются III тысячелетием до нашей эры и относятся к Древнему Египту, где этот оксид использовался для стекла и глазурей. Латинское название меди, Cuprum, происходит от острова Кипр, который в античные времена был важным центром медной торговли. В древности CuO получали в процессе обжига медных руд[4].
Свойства вещества
Химическое строение
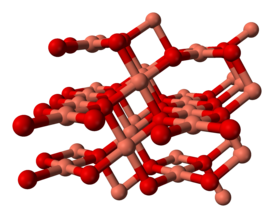
Оксид меди(II) представляет собой высокоупорядоченное неорганическое соединение, характеризующееся кристаллической структурой, принадлежащей к моноклинной сингонии. Данная сингония характеризуется наличием элементарной ячейки, имеющей форму косого параллелепипеда с тремя различными длинами ребёр и одним углом, не равным 90°. Основные параметры элементарной ячейки включают: длину рёбра a = 0.46837 нм, длину рёбра b = 0.34226 нм, длину рёбра c = 0.51288 нм, а также угол β между рёбрами a и c, составляющий 99,54°[5].
Кристаллы CuO относятся к пространственной группе симметрии C2/c, что строго регламентирует расположение атомов меди и кислорода в кристаллической решётке посредством набора операций симметрии, включающих оси, плоскости и центр симметрии. Эта специфическая атомная конфигурация непосредственно определяет ключевые физические и химические свойства вещества, такие как его характерный чёрный цвет, хрупкость, полупроводниковое поведение[5].
Дополнительно стоит отметить, что работа выхода объёмного CuO, представляющая собой энергию, необходимую для удаления электрона из твёрдого тела, составляет 5,3 электронвольта (эВ)[6].
Атомы меди в оксидах меди, в частности в форме Cu²⁺, демонстрируют выраженную тенденцию к структурным искажениям. В идеальном восьмиграннике из атомов кислорода атомы меди испытывают сильное энергетическое невыгодное положение из-за наличия «лишнего» электрона. Это приводит к различным типам структурных искажений, таких как тетрагональные или тригональные искажения. Искажения, известные как эффект Яна-Теллера, могут быть статическими или динамическими, что влияет на электронные и магнитные свойства материала[7].
Все высокотемпературные сверхпроводники на основе меди имеют общий структурный мотив — плоские слои CuO₂. В этих слоях атом меди окружён четырьмя атомами кислорода, формируя квадратную решётку. Апикальные атомы кислорода, расположенные над и под слоями CuO₂, образуют более длинные и слабые связи. Это обусловлено эффектом Яна-Теллера и стремлением атомов меди минимизировать энергетические затраты[7].
Чистые слои CuO₂ являются изоляторами. Однако при введении легирующих элементов или изменении концентрации кислорода происходит изменение электронной структуры, что приводит к появлению носителей заряда — «дырок» (для p-типа проводимости) или электронов (для n-типа проводимости). При достижении определённой концентрации носителей заряда материал переходит из состояния изолятора в сверхпроводящее состояние при охлаждении[7].
В p-типе сверхпроводимости основным механизмом является формирование куперовских пар из дырок. Эти пары обладают высокой энергией связи и могут существовать при относительно высоких температурах. Важно отметить, что для достижения сверхпроводимости необходимо наличие дефектов или примесей, которые способствуют образованию куперовских пар[7].
Хотя n-тип сверхпроводимости также возможен в оксидах меди, он менее изучен и менее эффективен. В этом случае носителями заряда являются электроны, которые образуют куперовские пары при охлаждении. Однако для достижения сверхпроводимости в n-типе требуется более высокая концентрация носителей заряда, что делает этот тип менее стабильным и менее эффективным[7].
Оксиды меди представляют собой уникальные материалы, сочетающие в себе структурные искажения, обусловленные эффектом Яна-Теллера, важную роль кислородных состояний в электронной проводимости и возможность достижения высокотемпературной сверхпроводимости при легировании. Особенности делают их ключевыми объектами исследований в области физики твёрдого тела и материаловедения[7].
Физические свойства
Оксид меди, CuO может существовать в виде гранул, крупных кристаллов или сухого порошка. В атмосферной среде он может проявляться как чёрный порошок без запаха или мелкодисперсные чёрные частицы, распределённые в воздухе. Плотность оксида меди при температуре 14°C/4°C составляет 6,315 г/см³, что свидетельствует о его высокой молекулярной массе и значительной компактности кристаллической решётки[8].
Температура плавления CuO при повышенном давлении кислорода составляет приблизительно 1447 °C. Однако при нормальном атмосферном давлении при этой температуре оксид меди разлагается, что обусловлено его химической нестабильностью в данных условиях[8].
Оксид меди характеризуется крайне низкой растворимостью в воде и этаноле. Тем не менее, он проявляет способность к растворению в разбавленных кислотах, цианидах щелочных металлов и карбонате аммония. В аммиаке CuO растворяется медленно, что указывает на его химическую инертность в щелочной среде[8].
Моноксид меди демонстрирует высокую термическую стабильность. Его температура плавления составляет 1447 °C, что указывает на прочность химических связей в кристаллической решётке. Температура кипения достигает 2000 °C, подчёркивая устойчивость соединения в высокотемпературных средах. Практически нулевое давление пара (0 ± 1 мм рт. ст.) подтверждает нелетучесть материала при стандартных условиях, что критично для применения в термостабильных покрытиях и электронных компонентах[7].
Материал является полупроводником p-типа с дырочным механизмом проводимости, что определяет его применение в фотокатализе и сенсорах. Ширина запрещённой зоны (1.2 эВ) обеспечивает эффективное поглощение видимого света и генерацию носителей заряда. Работа выхода электрона (5.3 эВ) создаёт высокий энергетический барьер для эмиссии, что важно для устройств, требующих стабильности электронных свойств (солнечные элементы, транзисторы)[7].
Стандартная энтальпия образования ΔH, характеризующая изменение энтальпии при образовании одного моля вещества из простых веществ в их стандартных состояниях, для CuO составляет −162 кДж/моль. Это значение указывает на высокую экзотермичность процесса образования оксида меди(II), что свидетельствует о его стабильности и термодинамической предпочтительности по сравнению с элементами, из которых он образован[9].
Стандартная энергия Гиббса образования ΔG, отражающая изменение свободной энергии Гиббса при тех же условиях, равна −129,4 кДж/моль для CuO. Отрицательное значение ΔG подтверждает, что реакция образования оксида меди(II) является спонтанной при стандартных условиях, что также подтверждает его термодинамическую устойчивость[9].
Стандартная энтропия вещества S, характеризующая меру беспорядка или случайности в системе, для CuO составляет 42,63 Дж/(моль·K). Это значение указывает на относительно низкую степень беспорядка в кристаллической решётке оксида меди(II), что способствует его стабильности и низким значениям энтальпии и энергии Гиббса[9].
Стандартная мольная теплоёмкость при постоянном давлении Cp, отражающая количество теплоты, необходимое для повышения температуры одного моля вещества на один градус Кельвина при постоянном давлении, для CuO составляет 42,3 Дж/(моль·K). Это значение свидетельствует о том, что оксид меди(II) проявляет умеренные теплоёмкостные свойства, что характерно для большинства неорганических соединений[9].
Химические свойства
Оксид меди(II), CuO, является представителем амфотерных оксидов. Этот факт указывает на способность оксида меди(II) проявлять как основные, так и кислотные свойства в зависимости от условий реакции. Кроме того, CuO выступает в роли окислителя[10].
Термическое разложение
При сильном нагревании выше 1026 °C оксид меди(II) разлагается на оксид меди(I) и кислород. Условия: температура 1026—1100 °C и низкое парциальное давление кислорода[10][2].
Взаимодействие с водой
Чистый оксид меди(II) практически не реагирует с водой. Однако свежеосаждённый CuO медленно гидратируется, образуя на поверхности гидроксид меди(II). Равновесие сильно смещено влево, так как CuO практически нерастворим в воде[10].
Взаимодействие с кислотами (осно́вные свойства)
Оксид меди(II) легко взаимодействует с минеральными и органическими кислотами, образуя соли меди(II) и воду[10]:
- С соляной кислотой: Оксид меди(II) + Соляная кислота → Хлорид меди(II) + Вода.
- С серной кислотой: Оксид меди(II) + Серная кислота → Сульфат меди(II) + Вода. Реакция протекает при умеренном нагревании.
- С уксусной кислотой: Оксид меди(II) + Уксусная кислота → Ацетат меди(II) + Вода.
Взаимодействие с кислотными оксидами (осно́вные свойства)
Взаимодействие оксида меди(II) с кислотными оксидами является классическим примером кислотно-основной реакции, в процессе которой образуются соли. Одним из наиболее характерных примеров такого взаимодействия является реакция оксида меди(II) с оксидом серы(VI), который также известен как триоксид серы (SO₃). В результате этой химической реакции образуется сульфат меди(II) (CuSO₄), что можно представить следующим химическим уравнением[11]:
В данной реакции CuO выступает в качестве основного оксида, а SO₃ — в качестве кислотного оксида. Образующийся сульфат меди (II) представляет собой кристаллы белого цвета, обладающие высокой гигроскопичностью[11].
Взаимодействие со щелочами и основными оксидами (амфотерные свойства)
При сплавлении CuO с твёрдыми щелочами или их оксидами образуются купраты(II)[10]:
- С гидроксидом натрия: Оксид меди(II) + Гидроксид натрия → Купрат(II) натрия + Вода.
- С оксидом натрия: Оксид меди(II) + Оксид натрия → Купрат(II) натрия. Сплавление при 800—1000 °C.
Оксид меди(II) (CuO) представляет собой твёрдое вещество чёрного цвета, которое практически не растворяется в воде. Несмотря на свою низкую растворимость, оксид меди(II) способен вступать в реакцию с концентрированными растворами щелочей, что демонстрирует его амфотерные свойства. При взаимодействии оксида меди(II) с концентрированными растворами щелочей (например, NaOH или KOH) в водном растворе образуются растворимые комплексные соединения — купраты. В результате реакции образуется ярко-синий раствор комплексного соединения. Образующиеся тетрагидроксокупраты хорошо растворимы в воде[10].
Взаимодействие с водным раствором аммиака
Оксид меди(II) (CuO) — твёрдое вещество чёрного цвета, обладающее способностью образовывать устойчивые комплексные соединения. Особенно интересной является его реакция с аммиаком, в результате которой происходит образование характерного аммиачного комплекса. При взаимодействии оксида меди(II) с избытком аммиака в присутствии воды протекает следующая реакция[12]:
В этой реакции участвуют три компонента: оксид меди(II), аммиак и вода, которые в результате химического взаимодействия образуют комплексное соединение — гидроксид тетраамминмеди(II). Аммиак в данном процессе выступает в роли лиганда, формируя устойчивую координационную сферу вокруг иона меди. Процесс комплексообразования сопровождается характерными визуальными признаками. Наиболее заметным из них является интенсивная синяя окраска образующегося раствора, что служит надёжным индикатором успешного протекания реакции. Реакция протекает при комнатной температуре и является экзотермической, то есть сопровождается выделением тепла[12].
Образующийся комплекс отличается высокой устойчивостью в водных растворах, что делает его ценным соединением для различных практических применений. Соединение широко используется в аналитической химии для качественного и количественного определения меди, а также в химической промышленности при синтезе различных аммиачных комплексов. Данная реакция представляет собой классический пример образования координационного соединения и часто используется в демонстрационных экспериментах для иллюстрации процессов комплексообразования в химии[12].
Взаимодействие с водным раствором цианида
Оксид меди(II) (CuO) проявляет способность к образованию комплексных соединений. Одной из важных реакций является его взаимодействие с цианид-ионами (CN−). Процесс образования комплекса протекает в несколько стадий: сначала оксид меди(II) реагирует с цианидами в присутствии воды, образуя промежуточное соединение, которое затем трансформируется в устойчивый комплексный ион. Реакция может быть представлена следующими уравнениями[10]:
В этой реакции участвуют следующие вещества: оксид меди(II), цианид калия и вода, которые в результате химического взаимодействия образуют комплексное соединение — тетрацианокупрат(II). Образующийся комплекс Cu(CN)42− характеризуется высокой устойчивостью. Реакция протекает в щелочной среде и требует строгого соблюдения мер безопасности из-за токсичности цианидов. Комплекс обладает рядом важных свойств: хорошо растворяется в воде, способен вступать в дальнейшие реакции обмена и отличается стабильностью при хранении. Благодаря этим характеристикам он широко применяется в аналитической химии для качественного и количественного определения меди и других металлов[10].
Взаимодействие с водородом
Восстановление меди водородом представляет собой окислительно-восстановительную реакцию, протекающую при нагревании. Этот процесс является классическим примером восстановления металла из его оксидной формы, демонстрируя фундаментальные принципы химического взаимодействия. Реакция описывается следующим химическим уравнением[13][11]:
Оксид меди(II) и водород выступают в роли исходных реагентов, тогда как медь и вода являются конечными продуктами реакции восстановления. Процесс восстановления меди водородом протекает при температуре в диапазоне 150—250 °C без применения катализатора. Наблюдаемые характерные признаки включают изменение цвета исходного чёрного оксида меди на красный цвет металлической меди, что свидетельствует о завершении реакции[13][11].
Взаимодействие с оксидом углерода(II)
Восстановление меди из оксида меди(II) угарным газом — важный промышленный процесс, который описывается следующим уравнением[1][11]:
В данной реакции участвуют следующие вещества: оксид меди(II) (CuO) — твёрдое кристаллическое вещество чёрного цвета, угарный газ (CO) — бесцветный ядовитый газ, медь (Cu) — твёрдое вещество красного цвета и углекислый газ (CO2) — бесцветный газ без запаха. Реакция протекает при температуре 250—450 °C. Для повышения эффективности процесса часто используются катализаторы, которые ускоряют конверсию угарного газа[1][11].
Взаимодействие с углеродом (коксом)
Восстановление меди углеродом (коксом) представляет собой важный процесс пирометаллургии, который протекает при высокой температуре около 1200 °C. В процессе участвуют оксид меди(II) (CuO) — твёрдое кристаллическое вещество чёрного цвета, углерод (кокс) — твёрдое пористое вещество чёрного цвета, медь (Cu) — твёрдое вещество красного цвета и угарный газ (CO) — бесцветный ядовитый газ[1].
Механизм реакции основан на окислительно-восстановительных процессах, где углерод выступает в роли восстановителя, отдавая 2 электрона, а оксид меди(II) является окислителем. В ходе реакции происходит восстановление ионов меди Cu2+ до металлической меди Cu0, при этом углерод окисляется до угарного газа. Характерными признаками протекания реакции являются изменение цвета реакционной массы с чёрного на красный и выделение угарного газа. Процесс носит экзотермический характер[1].
Альтернативный вариант с образование углекислого газа[1]:
Взаимодействие с алюминием (алюмотермия)
Алюмотермия представляет собой эффективный метод восстановления металлов, в частности меди, с использованием алюминия в качестве восстановителя. Характерными признаками протекания реакции являются интенсивное выделение тепла (реакция экзотермическая), изменение цвета реакционной массы с чёрного на красный, образование расплавленной меди и формирование белого слоя оксида алюминия. Этот процесс протекает при высоких температурах в диапазоне 1000—1100 °C. В реакции участвуют оксид меди(II) (CuO) — твёрдое кристаллическое вещество чёрного цвета, алюминий (Al) — серебристо-белый металл, медь (Cu) — твёрдое вещество красного цвета и оксид алюминия (Al2O3) — белый кристаллический порошок[14].
Механизм реакции основан на окислительно-восстановительных процессах, где алюминий выступает в роли сильного восстановителя, а оксид меди(II) — окислителя. В ходе реакции происходит восстановление ионов меди Cu2+ до металлической меди Cu0, при этом алюминий окисляется до оксида алюминия Al2O3[14].
Взаимодействие с аммиаком
Восстановление меди аммиаком — окислительно-восстановительный процесс, который протекает при высоких температурах в диапазоне 500—550 °C. В химической реакции участвуют оксид меди(II) (CuO) — твёрдое кристаллическое вещество чёрного цвета, аммиак (NH3) — бесцветный газ с резким запахом, медь (Cu) — твёрдое вещество красного цвета, азот (N2) — бесцветный газ без запаха и вода (H2O) — жидкость[14].
Механизм реакции основан на окислительно-восстановительных процессах, где аммиак выступает в роли восстановителя, а оксид меди(II) — окислителя. В ходе реакции происходит восстановление ионов меди Cu2+ до металлической меди Cu0, при этом аммиак окисляется до молекулярного азота N2, а также образуется вода как побочный продукт[14].
Характерными признаками протекания реакции являются изменение цвета реакционной массы с чёрного на красный, выделение газообразных продуктов, экзотермический характер процесса и образование капель воды[14].
Особенности процесса включают необходимость высоких температур для инициирования реакции, строгий контроль температурного режима, обеспечение хорошей вентиляции из-за выделения газообразных продуктов и соблюдение мер безопасности при работе с аммиаком. Данный процесс демонстрирует важные принципы окислительно-восстановительных реакций и находит применение как в лабораторных исследованиях, так и в некоторых промышленных процессах получения меди[14].
Взаимодействие с пероксидами металлов (пероксидом натрия)
Реакция оксида меди(II) (CuO) с пероксидом натрия (Na₂O₂) представляет собой высокотемпературный окислительный процесс, протекающий при сплавлении (нагревании до температуры 700 °C). В результате этого экзотермического взаимодействия образуется купрат(III) натрия, который может быть представлен в двух формах: NaCuO₂ и Na₃CuO₃. Химическое уравнение данной реакции можно записать следующим образом[15][16]:
Пероксид натрия (Na₂O₂), являясь мощным окислителем, инициирует процесс окисления меди, изменяя её степень окисления с +2 (в составе CuO) до +3 (в купрате(III) натрия). Высокая температура, при которой происходит сплавление, является критическим условием для успешного протекания данной реакции, поскольку в водной среде она не реализуется из-за гидролиза пероксида натрия[15][16].
Взаимодействие с серой
Взаимодействие оксида меди(II) с серой представляет собой особый высокотемпературный процесс восстановления, протекающий в специфических условиях. Процесс осуществляется при температуре 150—200 °C в условиях вакуума, что является обязательным требованием для успешного протекания реакции. В процессе участвуют оксид меди(II) (CuO) — твёрдое кристаллическое вещество чёрного цвета, сера (S) — твёрдое вещество жёлтого цвета, медь (Cu) — твёрдое вещество красного цвета и оксид серы(I) (S2O) — газообразный продукт реакции. Необходимость создания вакуума обусловлена неустойчивость оксида серы(I) на воздухе[16].
Взаимодействие с медью
Взаимодействие оксида меди(II) с металлической медью представляет собой особый окислительно-восстановительный процесс, протекающий при высоких температурах. Реакция описывается следующим уравнением[13]:
Процесс протекает при температуре в диапазоне 1000—1200 °C, что является критически важным условием для его реализации. В данной реакции участвуют оксид меди(II) (CuO) в качестве окислителя и металлическая медь (Cu0) в качестве восстановителя, в результате чего образуется оксид меди(I) (Cu2O)[13].
Взаимодействие с иодоводородом
При взаимодействии оксида меди(II) (CuO) с иодоводородной кислотой (HI) происходит окислительно-восстановительная реакция. Твёрдый оксид меди растворяется, образуя белый или кремовый осадок йодида меди(I) (CuI), одновременно выделяется бурый йод (I₂), а в качестве побочного продукта возникает вода. Упрощённое уравнение процесса[14]:
Визуально реакция проявляется исчезновением чёрного оксида, появлением светлого осадка CuI и бурой окраской раствора (или фиолетовыми парами) из-за выделения молекулярного йода. Образование именно йодида меди(I), а не CuI₂, объясняется тем, что соединение меди(II) с иодом неустойчиво и мгновенно разлагается на CuI и свободный йод. Реакция демонстрирует восстановительные свойства йодоводорода и применяется для синтеза йодида меди(I), а также в промышленности для очистки медных поверхностей от оксидных плёнок[14].
Взаимодействие со спиртами
Оксид меди (II) (CuO) проявляет выраженную окислительную активность в реакциях с алифатическими спиртами, что позволяет ему служить эффективным реагентом для трансформации вторичных спиртов в кетоны. Этот процесс характеризуется высокой степенью селективности, что обусловлено стабильностью карбонильной группы в молекуле кетона по сравнению с алкоксильной группой вторичного спирта. В случае взаимодействия CuO с первичными спиртами наблюдается менее селективное окисление, что может приводить к образованию альдегидов в качестве основного продукта и карбоновых кислот в качестве побочного продукта. Это обусловлено тем, что первичные спирты могут подвергаться дальнейшему окислению до альдегидов, а затем, при более жестких условиях, до карбоновых кислот[1].
Третичные спирты, напротив, не вступают в реакцию с CuO, поскольку они не способны подвергаться дегидрированию без разрушения углеродного скелета молекулы. Этот аспект делает третичные спирты инертными к данному типу окислительных превращений[1].
Способы получения
Термическое разложение гидроксида меди (II)
Термическое разложении гидроксида меди(II) при температуре 200 °C. При этом происходит следующая реакция[11]:
В результате реакции образуется оксид меди(II) и вода. Этот метод является одним из самых простых и часто используемых в лабораторных условиях[11].
Окисление металлической меди
- Окисление металлической меди кислородом воздуха при высоких температурах (400—500 °C). Реакция протекает по схеме[11]:
- Окисление оксидами азота. Например в качестве окислителя может быть использован оксид азота(IV)[1]:
Окисление оксида меди(I)
Одним из методов синтеза важного в неорганической химии и промышленности соединения — оксида меди(II) (CuO) — является реакция окисления оксида меди(I) (Cu₂O) кислородом воздуха. Суть реакции заключается во взаимодействии красно-бурого кристаллического оксида меди(I) (Cu₂O) с газообразным кислородом (O₂) при нагревании, в результате чего образуется чёрный оксид меди(II) (CuO). Химическое уравнение этого процесса записывается следующим образом[1]:
Прокаливание солей меди
Третий способ включает прокаливание различных солей меди[11]:
- Прокаливание гидроксокарбоната меди(II). В качестве побочных продуктов образуется углекислый газ (СО2) и вода (Н2О):
- Прокаливание нитрата меди(II). Побочными продуктами выступают оксид азота(IV) (NO2) и кислород (О2):
- Прокаливание сульфата меди(II). В продуктах реакции образуются дополнительно оксид серы(IV) (SO2) и кислород (О2)[1]:
Обжиг сульфидов
Обжиг сульфидов меди является ключевым этапом в промышленной переработке медных руд. Данный процесс осуществляется путём нагревания породы в среде кислорода при температуре в диапазоне 600—800 °C. В результате протекания окислительной реакции, которая может быть описана следующим химическим уравнением[1]:
Образуется оксид меди(II) (CuO), представляющий собой порошкообразный материал, который широко применяется в металлургической промышленности. Кроме того, в ходе реакции образуется оксид серы(IV) (SO₂), который является важным промежуточным продуктом в производстве серной кислоты[1].
Применение
Оксид меди (II) является многофункциональным химическим соединением, находящим широкое применение в различных научных и промышленных сферах. Его физико-химические свойства делают его незаменимым в следующих областях[1]:
- В качестве исходного реагента для синтеза других солей меди, включая производство консервантов для древесины, где он играет ключевую роль в обеспечении долговечности и биостойкости обработанных материалов[17].
- В качестве пигмента в керамике, где оксид меди (II) применяется для достижения различных цветовых оттенков глазури, таких как синий, красный и зелёный, благодаря своим ярко выраженным хроматическим свойствам.
- В металлургии, где он служит важным компонентом при сварке и пайке медных сплавов, обеспечивая высокое качество и прочность соединений.
- В производстве гальванических элементов и батарей, включая ранние типы батарей, такие как Эдисоновско-Лаландская батарея, где оксид меди (II) выступает в роли активного электрода, способствуя эффективной генерации электрического тока.
- В оптике, где он используется для изготовления оптических стёкол и в качестве полирующего агента для оптических поверхностей, обеспечивая высокую степень прозрачности и гладкости.
- В сельском хозяйстве, где оксид меди (II) применяется как фунгицид и пестицид, эффективно подавляя развитие патогенных микроорганизмов и защищая растения от болезней.
- В катализе, где он используется как катализатор в органических реакциях промышленного масштаба, способствуя повышению эффективности и селективности химических процессов.
- В разработке химических датчиков и сверхпроводящих материалов, где его уникальные свойства позволяют создавать высокочувствительные устройства и материалы с уникальными эксплуатационными характеристиками.
- В пищевой промышленности, где оксид меди (II) применяется в качестве добавки в корма для животных, предотвращая дефицит меди и способствуя улучшению здоровья и продуктивности сельскохозяйственных животных.
- В производстве вискозы, фосфатов и сухих батарей, где он выполняет разнообразные функции, включая активацию химических реакций и улучшение эксплуатационных характеристик конечных продуктов.
- Является компонентом в производстве стекла и эмалей, где он применяется для достижения специфических цветовых характеристик. В частности, он используется для получения зелёной, синей и медно-рубиновой окрасок. В процессе синтеза стекла и эмалей CuO взаимодействует с основными компонентами матрицы, что приводит к образованию комплексных соединений, определяющих финальную цветовую гамму[15].
Уровень опасности и меры предосторожности
Предусмотрены следующие гигиенические нормативы предельно допустимых концентраций (ПДК) меди в воздухе[18]:
Для атмосферного воздуха:
- максимальная разовая ПДК для сульфата меди (в пересчёте на медь) — 0,003 мг/м³;
- среднесуточная ПДК оксида меди (в пересчёте на медь) — 0,002 мг/м³.
Для воздуха рабочей зоны предусмотрены следующие значения:
- максимальная разовая ПДК меди — 1,0 мг/м³ (ГН 2.2.5.686-98);
- среднесуточная ПДК меди — 0,5 мг/м³.
Медь относится к веществам 2-го класса опасности[18].
Оксид меди (CuO) обладает значительным токсическим потенциалом, особенно в условиях профессионального воздействия. Согласно классификации по системе GHS (Глобально гармонизированной системе классификации и маркировки химических веществ), оксид меди классифицируется как вещество, представляющее опасность для водной среды, с категорией «Очень токсично для водных организмов с долгосрочными последствиями». Это свидетельствует о его высокой экологической токсичности и способности вызывать необратимые изменения в экосистемах при попадании в водоёмы[8].
Основные пути попадания оксида меди в организм человека: через органы дыхания, кожные покровы и слизистые оболочки глаз. Эти пути могут приводить к различным симптомам токсического воздействия, таким как раздражение конъюнктивы и верхних дыхательных путей, лихорадка, вызванная ингаляцией паров металлов, металлический или сладковатый привкус во рту, а также изменение цвета кожи и волос, что может быть связано с накоплением ионов меди в организме. Оксид меди оказывает токсическое воздействие на органы зрения, кожные покровы и респираторную систему[8].
Для минимизации риска профессионального воздействия на работников необходимо применять комплексные меры предосторожности. Рекомендуется использование средств индивидуальной защиты (СИЗ), включая защитные очки, перчатки и респираторы. Выбор класса защиты респиратора должен основываться на концентрации пыли и паров оксида меди в рабочей зоне[8].
Эффективная вентиляция рабочей зоны является ключевым фактором для предотвращения накопления пыли и аэрозолей оксида меди. Рекомендуется использовать системы местной вытяжной вентиляции, которые обеспечивают удаление загрязнённого воздуха непосредственно из зоны его образования. Личная гигиена работников также играет важную роль в профилактике токсического воздействия. После завершения работы с оксидом меди необходимо тщательно вымыть руки и лицо с мылом, а загрязнённую одежду сменить. Соблюдение правил хранения и утилизации химических веществ является неотъемлемой частью системы управления рисками. Необходимо обеспечить герметичность тары, в которой хранится оксид меди, и использовать специализированные методы утилизации для предотвращения загрязнения окружающей среды[8].
Примечания
- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 1,12 1,13 1,14 1,15 Оксид меди(II), CuO, химические свойства, получение. Acetyl.ru. Дата обращения: 14 июля 2025.
- ↑ 2,0 2,1 2,2 2,3 Зимина Г. В. Оксиды меди. БРЭ. Дата обращения: 14 июля 2025.
- ↑ 3,0 3,1 3,2 Медь (II) оксид. СоюзХимПром-промышленная химия, лабораторное стекло. Дата обращения: 14 июля 2025.
- ↑ Лукас А. Материалы и ремесленные производства Древнего Египта / Перевод с английского Б. Н. Савченко, Общая редакция и вступительная статья проф. В. И. Авдиева. — М.: Издательство иностранной литературы, 1958.
- ↑ 5,0 5,1 Химическая энциклопедия / Главный редактор: И. Л. Кнунянц. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 670. — 671 с. — ISBN 5-82270-035-5.
- ↑ Copper(II) oxide. Ataman Kimya. Дата обращения: 22 июля 2025.
- ↑ 7,0 7,1 7,2 7,3 7,4 7,5 7,6 7,7 Оксид меди. Ataman Kimya. Дата обращения: 22 июля 2025.
- ↑ 8,0 8,1 8,2 8,3 8,4 8,5 8,6 Cupric Oxide | CuO | CID 164827. PubChem. Дата обращения: 23 июля 2025.
- ↑ 9,0 9,1 9,2 9,3 Кипер Р. А. Меди(II) оксид - свойства, реакции. Дата обращения: 22 июля 2025.
- ↑ 10,0 10,1 10,2 10,3 10,4 10,5 10,6 10,7 Лидин Р. А., Молочко В. А., Андреева Л. Л. Химические свойства неорганических веществ: Учеб. пособие для вузов / Под ред. Р. А. Лидина. — 3-е изд., испр.. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- ↑ 11,0 11,1 11,2 11,3 11,4 11,5 11,6 11,7 11,8 11,9 Степанов В. Оксид меди (II): способы получения и свойства. Chemege.ru. Дата обращения: 24 июля 2025.
- ↑ 12,0 12,1 12,2 Карапетьянц М. Х., Дракин С. И. Общая и неорганическая химия. Учебное пособие для вузов. — М.: Химия, 1981. — 632 с.
- ↑ 13,0 13,1 13,2 13,3 Оксиды меди — урок. Химия, 11 класс.. ЯКласс. Дата обращения: 22 июля 2025.
- ↑ 14,0 14,1 14,2 14,3 14,4 14,5 14,6 14,7 Химия. Большой справочник для подготовки к ЕГЭ: справочное издание / под ред. В. И. Доронькина. — Ростов на Дону: Легион, 2023. — 560 с. — ISBN 978-5-9966-1718-0.
- ↑ 15,0 15,1 15,2 Оксид меди с йодоводородом. Металл мастер. Дата обращения: 22 июля 2025.
- ↑ 16,0 16,1 16,2 Потехин В. Оксид меди (II), свойства, получение, химические реакции. Вторая индустриализация (2 марта 2018). Дата обращения: 22 июля 2025.
- ↑ Blossom N. Use of Copper-Based Antifouling Paint: A U.S. Regulatory Update (англ.). American Coatings Association. Дата обращения: 23 июля 2025.
- ↑ 18,0 18,1 Федеральный регистр потенциально опасных химических и биологических веществ. НИАЦ РПОХБВ ФБУН «ФНЦГ им. Ф. Ф.Эрисмана» Роспотребнадзора. Дата обращения: 22 сентября 2025.
- Знание.Вики:Cite web (не указан язык)
- Страницы, использующие волшебные ссылки ISBN
- Химические вещества по алфавиту
- Химические вещества без указания химической формулы
- Химические вещества без указания молярной массы
- Химические вещества без указания плотности
- Проект:Шаблоны статей
- Химия
- Неорганические вещества
- Соединения меди по алфавиту
- Оксиды
- Амфотерные вещества
- Неорганическая химия
- Вещества
- Химические вещества










![{\displaystyle {\ce {CuO + 2NaOH + H2O = Na2[Cu(OH)4]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a74e0fe755a640f572afb2310f21f1d29607bcee)
2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8ea86e9a21e97dc24a6ed0cf026f60c360a66b41)
![{\displaystyle {\ce {CuO + 4KCN + H2O = K2[Cu(CN)4] + 2KOH}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f35669ab6e497faf2aa13a4c984db187f225d70e)






















