Холестерин
| Холестерин | |
|---|---|
  | |
 Химическая формула холестерина Химическая формула холестерина | |
| Общие | |
| Систематическое наименование |
(10R,13R)-10,13-диметил-17-(6-метилгептан-2-ил)-2,3,4,7,8,9,11,12,14,15,16,17-додекагидро-1H-циклопента[a]фенантрен-3-ол |
| Традиционные названия |
холестерол, холестерин, (3β)-холест-5-ен-3-ол, 5-холестен-3β-ол |
| Хим. формула | C27H46O |
| Физические свойства | |
| Состояние | Твёрдое |
| Молярная масса | 386,654 г/моль |
| Плотность | 1,07 г/см³ |
| Термические свойства | |
| Температура | |
| • кипения | 360 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 0,095 г/100 мл |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Холестери́н (др.-греч. χολή «жёлчь» + др.-греч. στερεός «твёрдый») — органическое соединение, природный полициклический липофильный спирт, принадлежащий к классу стероидных соединений и выполняющий фундаментальные функции в метаболизме животных организмов. Данное органическое соединение с молекулярной формулой C₂₇H₄₆O было впервые научно охарактеризовано и получило своё современное наименование в начале XIX столетия[1].
Холестерин представляет собой ключевой структурный компонент клеточных мембран всех эукариотических организмов и служит биохимическим предшественником множества биологически активных молекул.
Молекулярные основы и химическая природа
Структурная организация молекулы
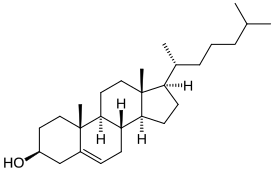
Молекула холестерина характеризуется сложной трёхмерной архитектурой, основанной на стероидном тетрациклическом ядре с присоединённой алифатической боковой цепью. Молекулярная масса соединения составляет 386,654 дальтона, что говорит о его принадлежности к высокомолекулярным липидным структурам. Кристаллическая решётка холестерина демонстрирует температуру плавления в диапазоне 148—150 °C, а температура термического разложения достигает 360 °C[2].
Пространственная конформация молекулы холестерина характеризуется транс-расположением циклических фрагментов, что придаёт основной части молекулы жёсткость и планарность, в то время как боковая алифатическая цепь сохраняет конформационную подвижность. Данная структурная особенность определяет уникальные физико-химические свойства соединения и его биологическую активность.
Стероидное ядро холестерина состоит из четырёх конденсированных циклических структур: трёх шестичленных циклогексановых колец (A, B, C) и одного пятичленного циклопентанового кольца (D). Гидроксильная группа при третьем углеродном атоме кольца A обеспечивает полярные взаимодействия с водной фазой, в то время как объёмная стероидная структура и восьмиуглеродная боковая цепь при семнадцатом положении формируют гидрофобный домен молекулы[3].
Растворимость и физико-химические характеристики
Холестерин обладает выраженными гидрофобными свойствами и почти не растворяется в воде: при стандартных условиях его растворимость составляет всего 0,095 мг на 100 мл. Плотность кристаллического холестерина составляет 1,07 грамма на кубический сантиметр[4]. Противоположностью гидрофобным характеристикам соединения является его высокая растворимость в органических растворителях неполярной природы, таких как ацетон, бензол, хлороформ, этанол и алифатические углеводороды.
Амфипатическая природа молекулы холестерина обусловлена наличием полярной гидроксильной группы при третьем углеродном атоме стероидного кольца и объёмной гидрофобной стероидной структурой. Эта молекулярная дихотомия определяет способность холестерина к интеграции в липидные мембраны и формированию супрамолекулярных комплексов.
Критическая концентрация мицеллообразования холестерина в водных растворах составляет приблизительно 25-40 нМ[5], что значительно ниже физиологических концентраций. Данная особенность объясняет тенденцию холестерина к агрегации и кристаллизации в биологических жидкостях, что клинически проявляется формированием холестериновых жёлчных камней при нарушении соотношения компонентов жёлчи.
Стереохимия и изомерия
Молекула холестерина содержит восемь асимметрических углеродных центров, что теоретически допускает существование 256 стереоизомерных форм. Однако значение имеют исключительно два энантиомера: природный холестерин (nat-холестерин) и его зеркальный изомер (ent-холестерин). В естественных биологических системах встречается исключительно nat-холестерин, что отражает эволюционную селекцию определённой стереохимической конфигурации[6].
Стереохимическая специфичность холестерина критически важна для его взаимодействия с ферментативными системами и мембранными рецепторами, поскольку биологическая активность стероидных соединений напрямую зависит от их пространственной структуры.
Биосинтез и метаболические пути
Количественные характеристики синтеза
Эндогенный синтез холестерина в организме человека представляет собой высокоинтенсивный метаболический процесс, характеризующийся суточной продукцией до 2,5 граммов холестерина при одновременном алиментарном поступлении приблизительно 0,5 грамма[7]. Организм взрослого человека массой 68 килограммов синтезирует около одного грамма холестерина ежесуточно, при этом общий холестериновый пул составляет приблизительно 35 граммов, преимущественно локализованных в составе клеточных мембран.
Основными анатомическими локусами холестеринового биосинтеза служат гепатоциты и энтероциты, обеспечивающие до 80 % общей продукции. Дополнительными участками активного синтеза являются нервная ткань, кора надпочечников и репродуктивные органы.
Клеточная локализация синтеза
Холестериновый биосинтез осуществляется всеми эукариотическими клетками, что подчёркивает фундаментальное значение данного соединения для клеточного метаболизма. В центральной нервной системе астроциты выполняют функцию синтеза и последующего транспорта к нейронам, поскольку гематоэнцефалический барьер препятствует проникновению периферического холестерина в мозговую ткань.
Основные стадии биосинтеза холестерина распределены между цитоплазмой, где реализуются начальные реакции, и эндоплазматическим ретикулумом, в котором протекают ключевые ферментативные процессы.
Интенсивность холестеринового синтеза демонстрирует выраженную циркадную ритмичность с максимальной активностью в ночные часы, что обусловлено гормональной регуляцией ключевых ферментов биосинтеза. Данная особенность имеет клиническое значение для оптимизации времени приёма статинов — ингибиторов ГМГ-КоА редуктазы[8].
Многоступенчатый процесс биосинтеза
Процесс содержит 37 последовательных ферментативных реакций. Инициальные стадии характеризуются конденсацией ацетильных фрагментов с образованием мевалоновой кислоты через промежуточное формирование 3-гидрокси-3-метилглутарил-коэнзима А[9]. Последующие этапы представлены фосфорилированием мевалоната, декарбоксилированием с образованием изопреноидных предшественников и полимеризацией шести изопреноидных единиц в линейный тритерпен сквален.
Циклизация сквалена осуществляется оксидосквален-циклазой, катализирующей формирование тетрациклической структуры ланостерола. Финальные 19 ферментативных стадий включают окислительную модификацию метильных групп с участием НАДФН и молекулярного кислорода, изомеризацию двойных связей посредством мутазных ферментов, и восстановление кетогрупп с участием НАДН[10].
Регуляторные механизмы
Холестериновый гомеостаз поддерживается механизмом обратной связи, при котором поступление холестерина с пищей сопровождается снижением его эндогенного синтеза. Ключевым регуляторным ферментом является ГМГ-КоА редуктаза, которая катализирует лимитирующую стадию мевалонатного пути и находится под многоуровневой регуляцией.
Транскрипционная регуляция холестеринового синтеза опосредуется стерол-регуляторными элемент-связывающими белками (SREBP), которые в условиях холестеринового дефицита активируют экспрессию генов ферментов биосинтеза. При избытке холестерина происходит протеосомная деградация ГМГ-КоА редуктазы и репрессия транскрипции соответствующих генов[11].
Биологические функции
Мембранная архитектура
Холестерин выполняет критическую роль в поддержании структурной целостности и функциональности биологических мембран. Интеркаляция молекул холестерина между фосфолипидными компонентами мембраны модулирует её текучесть в широком температурном диапазоне, предотвращая как чрезмерную ригидность при низких температурах, так и избыточную флюидность при физиологических условиях.
Холестерин присутствует во всех животных клеточных мембранах в концентрациях, варьирующих от 20 до 50 % от общего липидного состава. В прокариотических организмах он полностью отсутствует[12]. Молекула холестерина снижает проницаемость мембраны для низкомолекулярных гидрофильных соединений, ионов водорода и натрия, способствуя поддержанию трансмембранных градиентов.
Молекулярный механизм мембранного воздействия холестерина основан на его способности заполнять пространство между ацильными цепями фосфолипидов, увеличивая плотность упаковки липидного бислоя. Гидроксильная группа холестерина обращена к полярной поверхности мембраны, образуя водородные связи с фосфатными группами фосфолипидов, в то время как стероидное ядро и боковая цепь интегрируются в гидрофобную сердцевину бислоя.
Гормональный предшественник
Холестерин служит универсальным биохимическим предшественником всех стероидных гормонов, инициируя каскад биосинтеза половых гормонов и кортикостероидов. Ферментативное превращение холестерина включает синтез кортизола, альдостерона, прогестерона, эстрогенов и тестостерона, определяющих широкий спектр физиологических функций от метаболической регуляции до репродуктивных процессов.
Холестерин также является субстратом для синтеза витамина D через фотохимическое превращение 7-дегидрохолестерина в коже, а также для образования жёлчных кислот[13], необходимых для эмульгирования и всасывания липидов в пищеварительном тракте.
Нейрофизиологические аспекты
Основная функция холестерина в нервной системе заключается в формировании миелиновых оболочек, обеспечивающих проведение нервных сигналов. Высокая концентрация холестерина в миелине (до 25 % от сухой массы) критически важна для поддержания электрической изоляции нервных волокон.
Соединение участвует в организации липидных рафтов — специализированных мембранных доменов, концентрирующих сигнальные белки и обеспечивающих эффективную клеточную коммуникацию. Взаимодействие холестерина с ионными каналами, включая никотиновые ацетилхолиновые рецепторы и ГАМК-рецепторы, модулирует нейротрансмиссию и синаптическую пластичность[14].
Кожные барьерные функции
В эпидермисе холестерин формирует интегральный компонент липидной матрицы рогового слоя, составляя приблизительно 25 % от массы межклеточных липидов[15]. Совместно с церамидами и свободными жирными кислотами холестерин создаёт водонепроницаемый барьер, предотвращающий трансэпидермальную потерю влаги и проникновение патогенных агентов.
Сульфатированная форма соединения демонстрирует максимальную концентрацию в зернистом слое эпидермиса, участвуя в регуляции кератинизации и десквамации корнеоцитов.
Транспортные системы
Липопротеиновые комплексы
Транспорт холестерина в водной среде крови возможен только при участии специализированных транспортных механизмов, что связано с его гидрофобностью. Липопротеиновые частицы представляют собой сложные надмолекулярные образования, включающие липидное ядро, окружённое амфипатической оболочкой из фосфолипидов, холестерина и специфических аполипопротеинов[16].
Классификация липопротеинов основана на их плотности и включает хиломикроны, липопротеины очень низкой плотности (ЛПОНП), промежуточной плотности (ЛППП), низкой плотности (ЛПНП) и высокой плотности (ЛПВП). Каждый класс липопротеинов характеризуется специфическим аполипопротеиновым составом, определяющим их метаболические функции и тканевую специфичность.
Структурная организация липопротеиновых частиц обеспечивает эффективное солюбилизирование гидрофобных липидов в водной фазе плазмы. Внешняя монослойная оболочка, образованная фосфолипидами, свободным холестерином и аполипопротеинами, обращена полярными группами к водной среде, в то время как гидрофобное ядро содержит эфиры холестерина и триглицериды.
Механизмы доставки
Хиломикроны, содержащие аполипопротеины B-48, C и E, обеспечивают транспорт экзогенного холестерина от кишечника к периферическим тканям. ЛПОНП, синтезируемые печенью, транспортируют эндогенный холестерин и триглицериды к метаболически активным тканям[16].
ЛПНП представляют основную фракцию холестеринового транспорта в плазме и содержат около 1500 молекул холестериловых эфиров на частицу. Аполипопротеин B-100 обеспечивает узнавание ЛПНП специфическими рецепторами и последующий эндоцитозный захват клетками.
ЛПВП осуществляют обратный транспорт от периферических тканей к печени для утилизации или реэкспорта. Этот процесс критически важен для поддержания холестеринового гомеостаза и предотвращения атерогенного накопления вещества в сосудистой стенке.
Клинические аспекты
Нормативные показатели
Современные клинические рекомендации устанавливают референсные значения для липопротеинов высокой плотности в диапазоне 40-80 мг/дл для мужчин и 45-100 мг/дл для женщин. Концентрация ЛПНП менее 100 мг/дл считается оптимальной для большинства людей. Для пациентов высокого кардиоваскулярного риска целевые значения снижаются до уровня менее 70 мг/дл[16].
Общий холестерин плазмы менее 200 мг/дл классифицируется как допустимый уровень, значения 200—239 мг/дл относятся к пограничной зоне, а концентрации выше 240 мг/дл требуют терапевтического вмешательства.
Клиническая интерпретация липидного профиля требует комплексного анализа не только абсолютных концентраций отдельных фракций, но и их соотношений. Индекс атерогенности определяется формулой (общий холестерин — ЛПВП)/ЛПВП и служит суммарным показателем сердечно-сосудистого риска. Оптимальным считается уровень ниже 3,0.
Патологические состояния
Дислипидемии представляют значимый фактор риска сердечно-сосудистых заболеваний, при этом уровень холестерина демонстрирует прямую корреляцию с риском преждевременной смертности. Парадоксально, очень высокие концентрации ЛПВП (выше нормативных значений) ассоциируются с 80 % увеличением кардиоваскулярного риска, что указывает на нелинейную зависимость между холестериновыми фракциями и клиническими исходами.
Семейная гиперхолестеринемия встречается приблизительно у одного из 250 человек и связана с мутациями в рецепторе ЛПНП, гене PCSK9 или аполипопротеине B[16]. Данные моногенные нарушения приводят к выраженной гиперхолестеринемии и преждевременному развитию атеросклероза.
Терапевтические подходы
Фармакологическая коррекция дислипидемий основывается на применении статинов — ингибиторов ГМГ-КоА редуктазы, являющихся терапией первой линии. Клинические исследования демонстрируют, что снижение концентрации ЛПНП на 38,7 мг/дл сопровождается уменьшением риска кардиоваскулярных событий и инсультов на 21 %[16].
Альтернативные терапевтические опции включают ингибиторы абсорбции холестерина (эзетимиб), фибраты, секвестранты жёлчных кислот, ингибиторы PCSK9 и бемпедоевую кислоту. Комплексный подход включает модификацию образа жизни с ограничением насыщенных и трансжиров, увеличением физической активности и нормализацией массы тела.
Алиментарные источники
Животные продукты
Концентрация холестерина в продуктах животного происхождения варьирует в зависимости от тканевого источника. Наибольшие концентрации обнаруживаются в нервной ткани (мозг — около 2500 мг/100 г), почках (600 мг/100 г) и яичных желтках (450 мг/100 г). Морепродукты, включая икру (300 мг/100 г) и ракообразных (200 мг/100 г), также содержат значительные количества холестерина.
Молочные продукты демонстрируют умеренные концентрации холестерина, при этом сливочное масло содержит 215 мг/100 г, а цельное молоко — 14,4 мг/100 г. Грудное молоко человека содержит существенные количества холестерина, необходимого для нормального развития нервной системы младенцев.
Таблица 1. Содержание холестерина в основных пищевых продуктах[17]
| Продукт | Холестерин в среднем, мг/100 г | Холестерин, диапазон, мг/100 г |
| Мозг | 2500 | 1770-3300 |
| Почки | 600 | 300-800 |
| Яичный желток | 450 | 400-500 |
| Рыбья икра | 300 | 300 |
| Сливочное масло | 215 | 180-250 |
| Раки | 200 | 200 |
| Крабы и креветки | 150 | 150 |
| Карп | 185 | 100-270 |
| Жир свиной, говяжий | 110 | 100-120 |
| Сыр твёрдый | 100 | 80-120 |
| Свинина | 100 | 90-110 |
| Сметана 10-30 % | 100 | 100 |
| Говядина | 85 | 80-90 |
| Утка с кожей | 90 | 90 |
| Телятина | 80 | 80 |
| Курица без кожи (тёмное мясо) | 89,2 | 89,2 |
| Курица без кожи (белое мясо) | 78,8 | 78,8 |
| Утка | 60 | 60 |
| Индейка | 40 | 40 |
| Цыплёнок | 20 | 20 |
| Молоко 3 % | 14,4 | 14,4 |
| Творог 18 % | 57,2 | 57,2 |
| Творог 8 % | 32 | 32 |
| Творог обезжиренный | 8,7 | 8,7 |
Биологическая доступность алиментарного холестерина зависит от способа кулинарной обработки и сопутствующих пищевых компонентов. Термическая обработка может приводить к окислению холестерина с образованием оксистеролов, обладающих повышенной атерогенностью по сравнению с нативным холестерином.
Растительные альтернативы
Растительные продукты характеризуются минимальным содержанием холестерина, поскольку растительные клетки синтезируют преимущественно фитостеролы — структурные аналоги холестерина. Фитостеролы конкурируют с холестерином за абсорбцию в кишечнике, способствуя снижению холестеринемии.
Естественное потребление фитостеролов составляет 200—300 мг в сутки, что недостаточно для клинически значимого эффекта. Специально обогащённые продукты и пищевые добавки могут обеспечивать потребление до 2-3 граммов фитостеролов ежедневно, что сопровождается 10-15 % снижением концентрации ЛПНП[16].
Таблица 2. Содержание холестерина в растительных маслах
| Масло | Холестерин, мг/100 г |
| Кунжутное масло | 0,1 |
| Оливковое масло | 0,125 |
| Масло авокадо | 3,0 |
| Рапсовое масло | 5,3 |
| Подсолнечное масло | 1,4 |
| Арахисовое масло | 2,4 |
| Кукурузное масло | 5,5 |
| Соевое масло | 2,9 |
| Хлопковое масло | 4,5 |
| Кокосовое масло | 1,4 |
| Ядро пальмы | 1,7 |
| Пальмовое масло | 1,8 |
Диетические рекомендации
Современные диетологические рекомендации смещают акцент с ограничения холестерина к формированию здоровых пищевых паттернов. Американская кардиологическая ассоциация рекомендует средиземноморскую диету и диету DASH, характеризующиеся высоким содержанием ненасыщенных жиров, клетчатки и антиоксидантов при ограничении насыщенных и трансжиров.
Типичное потребление холестерина в развитых странах составляет 300—400 мг в сутки[17], при этом современные рекомендации призывают к минимизации алиментарного холестерина без установления жёстких численных ограничений.
Метаболическое взаимодействие
Микробиомные связи
Кишечная микрофлора играет активную роль в метаболизме холестерина, осуществляя биотрансформацию как пищевого, так и эндогенного холестерина. Ежедневно в толстую кишку поступает до одного грамма холестерина из различных источников, включая жёлчь, слущенные энтероциты и алиментарные липиды.
Анаэробные бактерии, преимущественно принадлежащие к родам Eubacterium и Lactobacillus[18], катализируют восстановление холестерина до копростанола — неабсорбируемого стерола, элиминируемого с фекалиями. Данный процесс представляет важный механизм холестеринового клиренса, эффективность которого зависит от состава и метаболической активности микробиома.
Элиминация и рециркуляция
Холестериновый гомеостаз поддерживается сложной системой рециркуляции, где печень выполняет центральную роль в метаболизме и экскреции. Гепатоциты секретируют холестерин в составе жёлчи как в свободной форме, так и в виде жёлчных кислот — продуктов ферментативного окисления стероидного кольца.
Энтерогепатическая циркуляция обеспечивает реабсорбцию приблизительно 95 % жёлчных кислот в терминальном отделе подвздошной кишки, что критически важно для поддержания пула жёлчных кислот и эффективности липидного пищеварения[19]. Нарушение данного процесса приводит к компенсаторному усилению холестеринового синтеза.
Оксидативные превращения
Холестерин подвержен неферментативному и ферментативному окислению с образованием оксистеролов — биологически активных производных, регулирующих холестериновый метаболизм. Автоокисление холестерина генерирует 7-кетохолестерол и 25-гидроксихолестерол, демонстрирующие цитотоксические свойства и участвующие в патогенезе атеросклероза.
Ферментативное окисление холестерина цитохромами P450 приводит к образованию регуляторных оксистеролов, включая 24S-гидроксихолестерол, элиминируемый из мозга, и 27-гидроксихолестерол, регулирующий экспрессию генов холестеринового метаболизма через ядерные рецепторы[20].
Эволюционные и сравнительные аспекты
Филогенетическое распространение
Холестерин является характерным компонентом эукариотических организмов и отсутствует у прокариот, за исключением микоплазм, которые не синтезируют его самостоятельно и получают из внешней среды. Данное филогенетическое распределение отражает эволюционную специализацию стероловых липидов в формировании сложных мембранных систем эукариот.
Растительные организмы синтезируют холестерин как промежуточный продукт биосинтеза фитостеролов и стероидных алкалоидов, при этом конечная концентрация холестерина в растительных тканях остаётся минимальной. Эволюционная дивергенция стероловых путей отражает адаптацию к различным экологическим нишам и метаболическим требованиям[21].
Генетические детерминанты
Генетические полиморфизмы ключевых генов холестеринового метаболизма демонстрируют значительную межпопуляционную вариабельность и ассоциацию с различными фенотипическими проявлениями. Ген APOE, кодирующий аполипопротеин E, проявляет плейотропные эффекты, где определённые аллели увеличивают риск диабета при одновременном снижении кардиоваскулярного риска[21].
Редкие мутации генов холестеринового биосинтеза приводят к тяжёлым врождённым нарушениям, включая синдром Смита-Лемли-Опица, характеризующийся множественными пороками развития вследствие холестеринового дефицита в эмбриогенезе.
Дискуссионные вопросы современной науки
Критический анализ липидной гипотезы
Современная кардиология подвергает переосмыслению классическую липидную гипотезу атеросклероза, основанную на прямой каузальной связи между холестеринемией и сердечно-сосудистыми заболеваниями. Критический анализ литературы выявляет методологические ограничения ключевых эпидемиологических исследований и альтернативные интерпретации наблюдаемых корреляций.
Альтернативная гипотеза рассматривает холестерин как репаративный агент, аккумулирующийся в участках сосудистого повреждения для восстановления эндотелиальной целостности. Данная концепция объясняет развитие атеросклероза у пациентов с нормохолестеринемией и ставит под сомнение эффективность изолированного снижения холестерина без устранения первичных причин сосудистого повреждения[22].
Эпидемиологические парадоксы
Эпидемиологические парадоксы холестерина представляют собой одну из наиболее интригующих и противоречивых областей современной кардиологии и липидологии, которая ставит под сомнение упрощенные представления о роли этого липида в развитии сердечно-сосудистых заболеваний. Традиционная липидная гипотеза долгое время постулировала прямую линейную зависимость между уровнем холестерина в крови и риском атеросклероза, однако масштабные эпидемиологические исследования последних десятилетий выявили гораздо более сложную картину. Анализ данных многочисленных когортных исследований демонстрирует U-образную или J-образную кривую зависимости между концентрацией общего холестерина и общей смертностью, где наиболее низкие показатели смертности наблюдаются при умеренно повышенных значениях холестерина (около 5,2-6,2 ммоль/л), в то время как как критически низкие (менее 3,9 ммоль/л), так и чрезмерно высокие (более 7,8 ммоль/л) уровни ассоциируются с увеличением риска смерти от различных причин.[23]
Особенно парадоксальными оказались результаты экспериментальных исследований на лабораторных животных, которые продемонстрировали явление, получившее название «компенсаторного холестериногенеза» или обратной корреляции между диетарным поступлением холестерина и его эндогенным синтезом. При увеличении потребления холестерина с пищей активность ключевого фермента его биосинтеза — 3-гидрокси-3-метилглутарил-КоА-редуктазы — подавляется через механизмы отрицательной обратной связи, что приводит к снижению собственной продукции холестерина в печени и, парадоксально, к стабилизации или даже снижению его плазменной концентрации. Этот механизм гомеостатической регуляции объясняет, почему у многих людей даже значительное увеличение потребления холестеринсодержащих продуктов не приводит к пропорциональному повышению его уровня в крови, что противоречит упрощенным диетологическим рекомендациям.
Гендерные различия в метаболизме холестерина добавляют ещё один уровень сложности к пониманию его роли в патогенезе сердечно-сосудистых заболеваний. У женщин репродуктивного возраста эстрогены оказывают кардиопротективное действие, повышая уровень «хорошего» холестерина липопротеинов высокой плотности (ЛПВП) и улучшая профиль аполипопротеинов, что объясняет более низкую частоту ишемической болезни сердца в этой группе даже при умеренно повышенных общих уровнях холестерина. После менопаузы эта защита исчезает, и влияние холестерина на риск становится более выраженным, хотя и остается менее предсказуемым по сравнению с мужчинами.
Возрастные парадоксы холестерина особенно ярко проявляются в пожилом возрасте, где многочисленные исследования обнаружили обратную связь между уровнем холестерина и смертностью — феномен, получивший название «холестериновый парадокс старения». У людей старше 70 лет более высокие уровни общего холестерина часто ассоциируются с лучшей выживаемостью, меньшей частотой инфекционных заболеваний и когнитивных нарушений. Это объясняется множественными ролями холестерина в организме: он является не только компонентом клеточных мембран и предшественником стероидных гормонов, но и важным элементом иммунной защиты, участвуя в нейтрализации бактериальных токсинов и поддержании целостности гематоэнцефалического барьера. Эти открытия подчеркивают необходимость индивидуализированного подхода к оценке липидного риска с учётом возраста, пола, сопутствующих заболеваний и генетических факторов, отходя от универсальных целевых значений холестерина в пользу персонализированной медицины.
Исторические вехи изучения
Научное изучение холестерина началось в XVIII веке с выделения «жирового воска» из жёлчных камней французским химиком Пулетье де ла Салем в 1769 году. Систематическое исследование данного соединения было инициировано Антуаном Фуркруа, выделившим холестерин в чистом виде в 1789 году, и продолжено Марселеном Бертло, установившим его принадлежность к классу спиртов в 1859 году[24].
Ключевую роль в понимании патологического значения холестерина сыграл российский патолог Николай Николаевич Аничков, впервые продемонстрировавший роль холестерина в развитии экспериментального атеросклероза в начале XX века. Современное понимание молекулярных механизмов холестеринового метаболизма было заложено работами Конрада Блоха и Феодора Лайнена, удостоенных Нобелевской премии в 1964 году за расшифровку путей биосинтеза холестерина и жирных кислот.
Клиническое значение холестериновых транспортных систем было раскрыто Майклом Брауном и Джозефом Голдстейном, получившими Нобелевскую премию в 1985 году за открытие рецепторов ЛПНП и механизмов регуляции холестеринового гомеостаза[25].
Литература
- Кольман Я. Наглядная биохимия / Я. Кольман, К.-Г. Рём; пер. с англ. Т. П. Мосоловой. — 6-е изд. — М.: Лаборатория знаний, 2019. — С. 509.
- Нельсон Д. Основы биохимии Ленинджера : в 3 Т. / Д. Нельсон, М. Кокс ; пер. с англ.. — 4-е изд. — М.: Лаборатория знаний, 2020. — Т. 1. — С. 704.
- Северин Е. С. Биохимия: учебник для студентов медицинских вузов / Е. С. Сиверин. — 5-е изд., испр.. — М.: ГЭОТАР-Медиа, 2015. — С. 768.
Примечания
- ↑ Шаланда А. Холестериновая страшилка, которая правит миром / А. Шаланда // Биомолекула. — 2013.
- ↑ Царегородцева Е. В. Биохимия мяса : учебное пособие для вузов / Е. В. Царегородцева. — М.: Юрайт, 2020. — С. 165.
- ↑ Ленинджер А. Основы биохимии. Биосинтез холестерина, стероидов и изопреноидов / А. Ленинджер. — М : Мир, 1985. — Т. 2.
- ↑ Справочник биохимика. Справочник биохимика / Под ред. Досона Р., Эллиота Д., Эллиота У., Джонса К.. — М.: Под ред. Досона Р., Эллиота Д., Эллиота У., Джонса К., 1991. — С. 544.
- ↑ Шубенкова Е. Г. Коллоидная химия. Мицеллярные растворы / Е. Г. Шубенкова. — Омск: Издат.-вл ОмГУ, 2014. — С. 22.
- ↑ Илиел Э. Основы органической стереохимии / Э. Илиел, С. Вайлен, М. Дойл. — М.: БИНОМ. Лаборатория знаний, 2007. — С. 703.
- ↑ 5 главных вопросов про холестерин // Управление Федеральной Службы по Надзору в Сфере Защиты Прав Потребителей и Благополучия Человека по городу Москве. — 2023.
- ↑ Лангсьон П. Х. № 9 // Медицинское применение ингибиторов ГМГ–КоА–редуктазы и сопутствующий дефицит коэнзима Q10. Обзор экспериментальных работ, выполненных на млекопитающих и человеке / П. Х. Лангсьон, А. M. Лангсьон. — РМЖ, 2007. — С. 747.
- ↑ Котович И. В. Основы динамической биохимии / И. В. Котович, В. П. Баран, Н. В. Румянцева. — Витебск: УО ВГАВМ, 2005. — С. 82.
- ↑ Емельянов В. В. Биохимия / В. В. Емельянов, Н. Е. Максимова, Н. Н. Мочульская. — Екатеринбург: Изд-во Урал. ун-та, 2016. — С. 132.
- ↑ Михайлова А. Д. Реконструкция и компьютерный анализ структурно-функциональной организации генной сети регуляции биосинтеза холестерина у человека / А. Д. Михайлов // Вавиловский журнал генетики и селекции. — 2022. — Т. 27. — № 8. — С. 866—875.
- ↑ Дунина-Барковская А. Я. Холестерин клеточных мембран и регуляция клеточных процессов: новое и хорошо забытое старое // Биологические мембраны. — 2024. — Т. 41. — № 5-6. — C. 454—472.
- ↑ Климов А. Н., Никульчева Н. Г. Обмен липидов и липопротеидов и его нарушения. — СПб.: Питер, 1999. — С. 512.
- ↑ Петров А. М. Метаболизм холестерина мозга и его нарушения: связь с нейродегенерацией и синаптической дисфункцией / А. М. Петров, М. Р. Касимов, А. Л Зефиров // Acta Naturae. — 2016. — Т. 8. — № 1. — С. 58-73.
- ↑ Свирщевская Е. В. Роль липидов в барьерных свойствах кожи / Е. В. Свирщевская, Е. В. Матушевская // Клиническая дерматология и венерология. — 2019. — Т. 18. — № 3. — С. 288—296.
- ↑ 16,0 16,1 16,2 16,3 16,4 16,5 Ежов М. В. Нарушения липидного обмена. Клинические рекомендации 2023 / М. В. Ежов, В. В. Кухарчук, И. В. Сергиенко и др. // Российский кардиологический журнал. — 2023. — Т. 28. — № 5. — С. 5471.
- ↑ 17,0 17,1 Латфуллин И. А. Атеросклероз (краткие сведения истории развития, причины, патогенез заболевания, факторы риска, принципы профилактики) / И. А. Латфуллин. — Казань: Изд-во Казан. ун-та, 2015. — С. 15–16.
- ↑ Sawicka-Śmiarowska E. Why Do These Microbes Like Me and How Could There Be a Link with Cardiovascular Risk Factors? / E. Sawicka-Śmiarowska, A. Moniuszko-Malinowska, K. A. Kamiński // J Clin Med. — 2022. — № 11 (3). — P. 599.
- ↑ Кузнецов Ю. Е. и др. Физиологические аспекты энтерогепатической циркуляции жёлчных кислот / Ю. Е. Кузнецов и др // Вестник НГАУ. — 2023. — № 3. — С. 67-74.
- ↑ https://vestngau.elpub.ru/jour/article/view/2099. 24s-Hydroxycholesterol : studies on regulatory mechanisms behind its formation in the brain and its potential use as a marker for neurodegeneration / M. Shafaati. — Karolinska Institutet, 2010. — С. 75.
- ↑ 21,0 21,1 Михайлова А. Д. Реконструкция и компьютерный анализ структурно-функциональной организации генной сети регуляции биосинтеза холестерина у человека и эволюционная характеристика участвующих в ней генов / А. Д. Михайлова // Вавиловский журнал генетики и селекции. — 2022. — Т. 27. — № 8. — С. 866—875.
- ↑ Сыров В. Н. Атеросклероз. Осмысление и поиск решения проблемы / В. Н. Сыров // Вестник хирургии Казахстана. — 2010. — № 4. — С. 4-15.
- ↑ Драпкина О. М. Половые и гендерные различия в здоровье и болезни. Часть I. Эволюционная / О. М. Драпкина, О. Т. Ким // Кардиоваскулярная терапия и профилактика. — 2023. — Т. 22. — № 8. — С. 3657.
- ↑ Alabdulgader A. № 13 // The Great Cholesterol Quandary and Global Consciousness Awakening / A. Alabdulgader. — World Journal of Cardiovascular Diseases, 2023. — С. 718—755.
- ↑ Конрад Эмиль Блох // Виртуальный музей Слонимского государственного медицинского колледжа.