Стерины
| Общая формула стеринов | |
|---|---|
 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
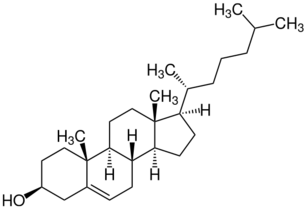
Стéрины (син. стеролы) — это высокомолекулярные тетрациклические соединения группы стероидов, производные циклопентанопергидрофенантрена. Они могут находиться в природе, как в свободном состоянии, так и в виде эфиров с высшими жирными кислотами (чаще всего пальмитиновой и стеариновой, а также олеиновой), образуя стериды. Стерины можно выделить преимущественно из неомыляемой фракции липидов, то есть жиров[1].
Общая характеристика
По своей химической структуре стерины являются представителями вторичных предельных или ненасыщенных спиртов.
Все представители класса стеринов содержат гидроксильную группу — (в β-ориентации), в основном у (не исключено и другое положение гидроксильной группы), а также разветвлённый алкильный радикал -.
В положении 5, 6 у некоторых представителей можно отметить наличие кратных связей.
В связи с этим можно классифицировать стерины на:
- Станолы — молекулы стеринов, в которых отсутствуют кратные связи, это полностью насыщенные соединения, связи между атомам С — С в молекуле ординарные (например: стигмастерин, холестенол).
- Стенолы — молекулы стеринов с наличием двойной связью (например: холестерин одна двойная связь, эргостерин — стерин содержащейся в дрожжах, имеет три двойные связи)[2].
Стерины довольно близки по строению и биогенетически являются родственными классу соединений тритерпеноидов. В свою очередь вещества тритерпеновой и стероидной природы принадлежат предшественникам — соединений ланостанового ряда.
Образованию углеродного скелета стеринов способствовало отщепление в циклическом остове ланостана трёх метильных () групп. Боковая цепь стеринов иногда может оставаться полностью в неизменном виде, то есть сохраняться, тогда такой углеродный скелет будет называться стерановый. В том случае, если в молекуле стерина нарушена боковая цепь или она деградирована, то стерины относят к стероидам. Чёткую границу между данными типами изопреноидов по-прежнему провести довольно затруднительно[3].
Химические свойства стеринов
Химические свойства стеринов очень схожи с алкенами и алициклическами спиртами. В строении стеринах присутствует стероидная структура, поэтому они могут образовывать труднорастворимые комплексы с дигитонином и некоторыми другими стероидными сапонинами. Ультрафиолетовые лучи солнца разрывают одно из колец стеринового ядра, что в некоторых случаях способно приводить к образованию витамина D.
Наличие кратных двойных связей у атомов и позволяет использовать стерины в синтезе целого ряда природных стероидов, а также их близких структурных представителей[4].
Физические свойства стеринов
Большинство стеринов являются кристаллическими спиртами (stereos = твердый). Это бесцветные молекулы, почти нерастворимые в воде, но достаточно хорошо растворимые в органических растворителях (это обусловлено наличием полярной группы — )[5].
Классификация стеринов
Стерины можно классифицировать по их происхождению, на следующие виды:
- зоостерины — это стерины, содержащиеся в липидах животных и человека (холестерин ((3β)-холест-5-ен-3-ол), копростанол);
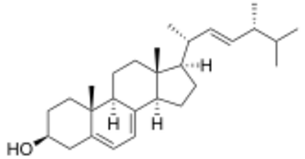
- фитостерины или растительные стерины содержатся в липидах растений (ситостерин, стигмастерин, брассикастерин, кампестерин, фукостерин);
- микостерины — это стерины, содержащиеся в дрожжах (эргостерин, зимостерин, фекостерин, аскостерин, эпистерин, фунгостерин)[6].
- морские стерины — это стерины, содержащиеся в морских грибах.
В природе также синтезируются минорные стерины, составляющие небольшую долю стеринов и встречающиеся только у единичных видах животный и растений.
Качественные реакции на стерины
Реакция Сальковского на холестерин
Данная реакция заключается в том, что если на молекулу холестерина подействовать концентрированной серной кислотой , произойдёт процесс дегидратации, а это приведёт в свою очередь к удалению гидроксильной группы и появлению в молекуле второй двойной связи[7]. Будет наблюдаться окрашивание раствора в красный цвет, маркер, характеризующий образование холестерилена.
Методика проведения анализа: К 2-3 мл хлороформного раствора холестерина осторожно, наслаивая по стенке, приливают равный объём концентрированной , после чего пробирку аккуратно встряхивают. Постепенно верхний слой окрашивается в красный или красно-фиолетовый оттенок, а после и вся пробирка приобретает такой цвет.
Реакция Либермана—Бурхарда
При взаимодействии молекулы холестерина с уксусным ангдиридом и серной кислотой произойдёт постепенное окрашивание раствора в сине-зелёный или зеленоватый цвет, что будет характеризовать образование сульфокислот холестерилена.
Методика проведения анализа: в сухую пробирку наливают 10 капель 1 % хлороформного раствора холестерина, после чего добавляют 3-5 капель и 1-2 капли концентрированной . Аккуратно встряхнув содержимое пробирки, её отправляют в баню при температуре 40 °С на 1-2 минуты, либо оставляют на 5-10 минут при комнатной температуре в вытяжном шкафу. Сначала будет наблюдаться красное окрашивание, которое спустя некоторое время будет сменяться на фиолетовый, синий и зелёный цвет соответственно. Если содержание холестерина в растворе будет незначительным, раствор сразу же приобретёт зеленую окраску[8].
Реакция Витби на наличие стеринов в растительных маслах
Метод основан на образовании окрашенных производных дегидратированного (после отщепления молекулы воды ) и окисленного холестерина под действием концентрированной .
Методика проведения анализа: в сухую пробирку наливают 1 мл хлороформа, после чего дополнительно 2—3 капли растительного масла и плавно встряхивают для его растворения. К образовавшемуся раствору прибавляют ровно 20 капель смеси концентрированной с формалином в соотношении (50:1) и аккуратно перемешивают.
При этом произойдёт окрашивание хлороформного слоя в яркий вишнево-красный цвет, а кислотного — в бледный красно-коричневый с зелёной подсветкой — флуоресценцией. Если из хлороформного слоя пипеткой отобрать буквально несколько капель и перенести их в другую пробирку, то после добавления двух капель уксусного ангидрида раствор окраситься в сине-зелёный цвет[9].
Литература
- Азимов, Айзек. Мир углерода / Пер. с англ. А. Иорданского. — Москва : Химия, 1978. — 206 с.
- Орлов, А. И. Стерины : Биосинтез и трансформация / А. И. Орлов. — СПб. : [б. и.], 2004. — 142 с. — ISBN 5-901739-18-3.
- Козьмина, А. Г. Стероиды : учебно-методическое пособие для самостоятельной работы студентов / А. Г. Козьмина, Е. В. Куваева ; Санкт-Петербургская гос. химико-фармацевтическая акад., Каф. органической химии. — Санкт-Петербург : СПХФА, 2011. — 28 с. — ISBN 978-5-8085-0297-0.
Примечания
- ↑ Чичибабин А. Е. Основные начала органической химии. Том 2 / Под ред. П. Г. Сергеева и А. Л. Либермана. — М.: Госхимиздат, 1957. — С. 169—175. — 771 с.
- ↑ Неницеску К. Д. Органическая химия.Том 2 / пер. с румынского Л. Бырлэдяну, под ред. акад. М.И. Кабачника. — М.: Издательство иностранной литературы, 1967. — С. 891—893. — 1047 с.
- ↑ Семенов А.А. Очерк химии природных соединений / под ред. Г.А. Толстикова;. — Новосибирск: Наука, 2000. — С. 262, 263—264. — 663 с. — ISBN 5-02-031642-3.
- ↑ Виды стеринов. Большая российская энциклопедия (научно-образовательный портал) (30 августа 2022). Дата обращения: 12 декабря 2023.
- ↑ Каррер П. Курс органической химии / под ред. М. Н. Колосова ; пер.: В. Э. Вассерберг, Э. М. Левина, Л. Д. Родионова.. — Л.: Госхимиздат. Ленингр. отд-ние, 1962. — С. 862—866. — 1216 с.
- ↑ Физер Л, Физер М. Химия природных соединений фенантренового ряда / под ред. акад. В. М. Родионова.. — М.,Л.: Госхимиздат, 1957. — С. 264—281. — 656 с.
- ↑ Гудман М., Морхауз Ф. Органические молекулы в действии / под ред. д-ра хим. наук А.П. Пурмаля; пер. с англ. канд. хим. наук М.П. Тетериной. — М.: Мир, 1977. — С. 147—149. — 335 с.
- ↑ Добрынина В. И.,Свешникова Е. А. Руководство к практическим занятиям по биологической химии. — М.: Медицина, 1967. — С. 147—148. — 343 с.
- ↑ Шапиро Д. К. Практикум по биологической химии : учеб. пособие для биолог. фак. вузов / под ред. А.С. Вечера. — Минск: Вышэйшая школа, 1972. — С. 181—184. — 286 с.
Данная статья имеет статус «готовой». Это не говорит о качестве статьи, однако в ней уже в достаточной степени раскрыта основная тема. Если вы хотите улучшить статью — правьте смело! |
Данная статья имеет статус «проверенной». Это говорит о том, что статья была проверена экспертом |
- Страницы, использующие волшебные ссылки ISBN
- Химические вещества по алфавиту
- Химические вещества без указания химической формулы
- Химические вещества без указания молярной массы
- Химические вещества без указания плотности
- Знание.Вики:Готовые статьи по науке
- Знание.Вики:Готовые статьи по алфавиту
- Стероиды
- Проверенная статья