Ретинол
| Ретинол | |
|---|---|
| Retinol | |
 Белые или бледно-желтые кристаллы со слабым запахом. Белые или бледно-желтые кристаллы со слабым запахом. | |
| Химическое соединение | |
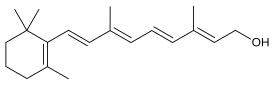
| ИЮПАК | (2E,4E,6E,8E)-3,7-Dimethyl-9-(2,6,6-trimethyl-1-cyclohexen-1-yl)-2,4,6,8-nonatetraen-1-ol (Retinol) |
| Брутто-формула | C20H30O |
| Молярная масса | 286.4516 |
| CAS | 68-26-8 |
| DrugBank | DB00162 |
| Состав | |
|
|
| Классификация | |
| АТХ | А11С А01 |
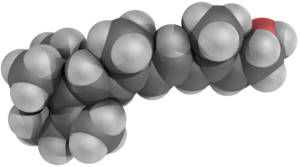
Рети́нол (также известный как витами́н A₁, молекулярная масса 286,459 г/моль) — жирорастворимое органическое соединение из группы ретиноидов, выполняющее ключевые биологические функции в живых организмах[1]. Характеризуется наличием полиеновой цепи с четырьмя двойными связями и циклогексенового кольца, что обусловливает его способность к различным конформационным изменениям и участию в светозависимых реакциях.
Химические свойства и структура
Молекулярная архитектура и номенклатура
Структурная организация ретинола базируется на изопреноидном скелете, включающем триметилциклогексеновое кольцо, соединённое с полиненасыщенной алифатической цепью. Молекула характеризуется формулой C₂₀H₃₀O с молекулярной массой 286,459 дальтон.
Кристаллическая структура ретинола представлена бледно-жёлтыми образованиями со слабо выраженным ароматом, что отражает его происхождение от каротиноидных пигментов. Номенклатурная система IUPAC определяет соединение как (2E,4E,6E,8E)-3,7-диметил-9-(2,6,6-триметил-1-циклогексен-1-ил)-2,4,6,8-нонатетраен-1-ол.
Реестровый номер CAS 68-26-8 обеспечивает его международную идентификацию в химических базах данных[2].
Структурные аналоги и изомерия
Группа ретиноидов включает несколько структурно родственных соединений, различающихся степенью окисления концевой функциональной группы. Ретинол подвергается ферментативным превращениям с образованием ретиналя (альдегидная форма) и ретиноевой кислоты (карбоксильная форма), каждая из которых выполняет специфические биологические функции.
Изомерное разнообразие ретиноидов обусловлено наличием четырёх потенциальных центров цис-транс изомеризации в полиеновой цепи. Цис-конфигурации характеризуются пониженной термодинамической стабильностью по сравнению с транс-формами, однако 11-цис-изомер ретиналя играет критическую роль в процессах фототрансдукции[3]. Дегидроретинол представляет собой аналог с дополнительной двойной связью в циклическом фрагменте, встречающийся у некоторых видов рыб.
История открытия витамина А
Первые исследования и выделение
Изучение ретинола берёт своё начало в 1909 году, когда это соединение было впервые описано. Последующее выделение в чистом виде произошло в 1931 году, а первый лабораторный синтез был осуществлён в 1947 году, что ознаменовало завершение начального этапа изучения витамина A[4].
Фундаментальный вклад в понимание биологической роли жирорастворимых факторов внёс Фредерик Гоуленд Хопкинс, который в 1912 году продемонстрировал необходимость неидентифицированных компонентов молока для нормального роста лабораторных животных. Данное открытие, отмеченное Нобелевской премией 1929 года, заложило основы витаминологии как научной дисциплины.
Параллельные исследования Элмера МакКоллума и Маргарет Дэвис в 1913 году подтвердили присутствие жирорастворимого фактора роста в сливочном масле и рыбьем жире. Работы Томаса Берра Осборна и Лафайета Менделя в Йельском университете того же периода установили существование данного нутриента в животных жирах.
Развитие научных представлений
Структура ретинола была установлена швейцарским химиком Паулем Каррером в 1931 году. Первый успешный синтез ретиноевой кислоты и ретинола был реализован голландскими исследователями Дэвидом Адриааном ван Дорпом и Йозефом Фердинандом Аренсом в период 1946–1947 годов.
Революционное понимание роли ретинола в зрении было достигнуто благодаря работам Джорджа Уолда, удостоенного Нобелевской премии 1967 года за исследования первичных физиологических и химических зрительных процессов[5]. Его открытия установили молекулярную основу фототрансдукции и роль 11-цис-ретиналя в качестве хромофора зрительных пигментов.
Механизмы действия в организме
Превращения в организме
Биохимическая активация ретинола происходит через каскад ферментативных реакций, инициируемых в пигментном эпителии сетчатки. Ключевую роль в данном процессе играет белок RPE65[6], катализирующий превращение ретинола в 11-цис-ретиналь.
Биосинтетический путь образования ретинола из растительных предшественников включает окислительное расщепление β-каротина ферментом β-каротин 15,15'-монооксигеназой. Данная реакция приводит к формированию эпоксидного интермедиата, который подвергается гидратации с образованием диольного производного.
Последующее окисление спиртовых групп до альдегидов при участии NAD-зависимых дегидрогеназ генерирует ретиналь, восстанавливаемый до ретинола специфическими редуктазами.
Внутриклеточный метаболизм регулируется системой цитоплазматических связывающих белков, обеспечивающих транспорт и компартментализацию различных форм соединения. Окислительные превращения ретинола до ретиноевой кислоты проходят через промежуточное образование ретиналя и контролируются клеточными потребностями в транскрипционно активных метаболитах.
Молекулярные взаимодействия
Транскрипционная активность ретиноидов реализуется через семейство ядерных рецепторов, функционирующих как лиганд-зависимые факторы транскрипции. Ретиноевая кислота выполняет основную функцию в регуляции генной экспрессии и процессах клеточной дифференцировки в ходе эмбрионального развития.
Молекулярный механизм фототрансдукции базируется на формировании ковалентного комплекса между 11-цис-ретиналем и опсиновыми белками через основание Шиффа. Световая активация индуцирует изомеризацию хромофора от 11-цис к транс-конфигурации, инициируя конформационные изменения в белковой матрице и активацию фототрансдукционного каскада[7].
Физиологические функции в организме
Система зрительного восприятия
Зрительная функция ретинола реализуется через его участие в многоступенчатом фотохимическом цикле. Процесс начинается с ферментативного превращения ретинола в 11-цис-ретиналь в клетках пигментного эпителия сетчатки, откуда данный изомер транспортируется в фоторецепторные сегменты палочек и колбочек.
Фотоизомеризация 11-цис-ретиналя в транс-конфигурацию под действием световых квантов запускает каскад внутриклеточных сигнальных событий, приводящих к генерации нервного импульса[8]. Эффективность данного процесса определяет способность к ночному зрению, поскольку родопсин палочковых клеток обладает максимальной светочувствительностью среди зрительных пигментов.
Каротиноидные компоненты зрительной системы, включая лютеин и зеаксантин, выполняют протективную функцию, защищая макулярную область от фотоокислительного повреждения и снижая риск дегенеративных изменений центральной сетчатки.
Влияние на иммунитет
Иммуномодулирующая активность ретинола опосредована его влиянием на дифференцировку и функциональную активность клеток врождённого и адаптивного иммунитета. Ретиноевая кислота является важным фактором в поддержании кишечных иммунных барьеров и регуляции баланса между провоспалительными и регуляторными T-клеточными популяциями.
Эпителиальные барьерные функции усиливаются под действием ретиноидов через стимуляцию продукции антимикробных пептидов кератиноцитами и поддержание целостности слизистых мембран. Фагоцитарная активность макрофагов и нейтрофилов возрастает при адекватной обеспеченности витамином A[9], что способствует эффективному клиренсу патогенных микроорганизмов.
Действие на кожу
Дерматологическое применение ретинола основано на его способности модулировать пролиферацию и дифференцировку кератиноцитов. Эффективность в коррекции возрастных изменений кожи включает уменьшение выраженности морщин и улучшение текстуры эпидермиса.
Связь между дефицитом витамина A и повышенной восприимчивостью к дерматологическим инфекциям хорошо документирована. Ретиноиды стимулируют синтез коллагеновых волокон и ускоряют процессы репаративной регенерации при повреждениях кожного покрова.
Себорегулирующие свойства соединения обусловлены его влиянием на активность сальных желёз, что имеет терапевтическое значение при лечении акне и себорейных дерматозов. Топическое применение ретиноидных препаратов модифицирует микробиом кожи через изменение состава кожного сала[10].
Роль в росте и репродукции
Репродуктивная физиология тесно связана с адекватной обеспеченностью ретинолом, который участвует в сперматогенезе и овогенезе. Витамин A играет критическую роль в эмбриональном развитии и поддержании репродуктивных функций у обоих полов.
Влияние на метаболизм железа реализуется через регуляцию синтеза транспортных белков и мобилизацию его запасов в тканях. Данное взаимодействие имеет особое значение для профилактики анемических состояний в популяциях с множественными нутритивными дефицитами.
Стероидогенез включает ретинол-зависимые этапы биосинтеза половых гормонов, включая прогестерон, что объясняет нарушения репродуктивных функций при гиповитаминозе A[11]. Антагонистические взаимодействия с тироидными гормонами влияют на метаболические процессы и энергетический баланс организма.
Пищевые источники и усвоение
Источники поступления в организм
Пищевые источники ретинола включают преимущественно продукты животного происхождения. Источниками с наибольшим содержанием являются:
- рыбий жир;
- печень млекопитающих и птиц;
- молочные продукты с высоким содержанием жира;
- икра различных видов рыб.
Сведения о содержании витамина A в различных пищевых продуктах позволяют планировать диеты с адекватным поступлением ретинола. Растительные источники содержат каротиноиды-провитамины, требующие ферментативного превращения для получения биологически активного ретинола.
Овощи и фрукты оранжевой и жёлтой окраски характеризуются высоким содержанием β-каротина, эффективность конверсии которого в ретинол составляет приблизительно 12:1 по массе[12]. Зелёные листовые овощи также содержат значительные количества каротиноидов, маскируемых хлорофилловыми пигментами.
Процессы усвоения и метаболизма
Абсорбция ретинола в кишечнике возможна только при участии пищевых липидов и жёлчных кислот. Жирорастворимая природа витамина A определяет его эмульгирование в составе смешанных мицелл для эффективного всасывания в тонком кишечнике[13].
Печёночное депонирование ретинола происходит в форме ретинил эфиров в звёздчатых клетках, создавая значительные тканевые резервы, достаточные для обеспечения физиологических потребностей в течение нескольких месяцев при отсутствии поступления с пищей. Мобилизация из депо регулируется ретинол-связывающим белком плазмы.
Медицинское применение
Дефицитные состояния
Клиническая картина авитаминоза A характеризуется прогрессирующими нарушениями зрительной функции, начиная с гемералопии и завершаясь необратимыми изменениями роговицы. Ежегодно от 250 000 до 500 000 детей в развивающихся регионах теряют зрение вследствие дефицита витамина A[14].
Терапевтические подходы к коррекции дефицитных состояний включают высокодозную витаминотерапию. Применение ретинола для профилактики ксерофтальмии и других осложнений гиповитаминоза A является стандартным протоколом в педиатрической практике.
Эпидемиологические исследования демонстрируют значительное снижение материнской смертности при периодическом назначении высоких доз ретинола беременным женщинам в регионах с эндемическим дефицитом. Неонатальная витаминопрофилактика дозой 50 000 МЕ в первые двое суток жизни эффективно снижает младенческую смертность.
Токсикологические характеристики
Токсикологический профиль ретинола характеризуется дозозависимыми эффектами при превышении физиологических потребностей. Исторические случаи отравления, включая случай швейцарского исследователя Ксавье Мерца в 1913 году[15], связаны с употреблением печени арктических животных с экстремально высокими концентрациями витамина A.
Токсичность печени полярных млекопитающих для человека обусловлена адаптационными механизмами к экстремальным условиям среды обитания. Концентрации ретинола в печени белых медведей и тюленей могут превышать безопасные уровни в сотни раз.
Тератогенный потенциал избыточных доз ретинола во время беременности подтверждается клиническими наблюдениями врождённых аномалий развития. Мета-анализ выявил статистически значимое увеличение смертности на 5 % при добавках β-каротина и на 16 % при добавках витамина A в фармакологических дозах.
Терапевтическое применение
Клинические протоколы применения ретинола включают лечение и профилактику коревой инфекции. Иммуномодулирующие свойства витамина A способствуют снижению тяжести течения и частоты осложнений вирусных инфекций у детей[16].
Фармакокинетические характеристики ретинола обеспечивают возможность как перорального, так и парентерального введения. Внутримышечная инъекционная форма используется при нарушениях всасывания или необходимости быстрого восполнения дефицита.
Дерматологические применения ретинола включают терапию возрастных изменений кожи, акне и других воспалительных дерматозов. Топические ретиноидные препараты модулируют эпидермальную дифференцировку и стимулируют коллагеногенез в дермальном слое.
Единицы измерения и рекомендуемые дозы
Эволюция систем количественной оценки витамина A отражает совершенствование понимания биодоступности различных ретиноидных форм. В 2001 году была введена концепция эквивалентов активности ретинола (RAE), заменившая предыдущие системы измерения.
Российские нормативные документы устанавливают национальные стандарты физиологических потребностей в витамине A для различных демографических групп. Британская система нормирования предусматривает суточное потребление 700 мкг для мужчин и 600 мкг для женщин.
Конвертация между различными единицами измерения учитывает биодоступность каротиноидных предшественников[17]:
- 1 RAE соответствует 1 мкг ретинола.
- 1 RAE соответствует 2 мкг растворённого в липидах β-каротина.
- 1 RAE соответствует 12 мкг пищевого β-каротина.
- 1 RAE соответствует 24 мкг других провитаминных каротиноидов.
Рекомендуемые суточные дозы составляют 900 мкг для взрослых мужчин и 700 мкг для взрослых женщин. Потребности возрастают до 750–770 RAE в период беременности и 1200–1300 RAE во время лактации, отражая повышенные метаболические требования.
Педиатрические нормативы варьируют от 400 мкг для младенцев до 600 мкг для подростков, учитывая интенсивность процессов роста и формирования тканевых депо[18]. Верхние безопасные пределы потребления установлены на уровне 3000 мкг для предотвращения токсических эффектов.
Историческая динамика рекомендуемых доз демонстрирует тенденцию к снижению: с 5000 МЕ (1500 мкг) в 1968 году до современных 900 RAE (900 мкг) для взрослых мужчин, что отражает уточнение представлений о физиологических потребностях и биодоступности различных форм витамина A.
Промышленное производство
Методы синтеза
Промышленное производство ретинола базируется на технологиях полного химического синтеза, разработанных в течение 75-летнего периода. Современные процессы используют либо методологию BASF, либо реакцию Гриньяра, оптимизированную компанией Hoffmann-La Roche.
Исходным материалом для всех синтетических маршрутов служит β-ионон, получаемый из ацетона через серию конденсационных реакций. Стратегии удлинения углеродного скелета включают формирование характерной полиеновой системы ретинола.
Первый промышленный синтез, реализованный Hoffmann-La Roche в 1947 году, инициировал развитие глобальной витаминной индустрии[19]. Последующие десятилетия характеризовались разработкой восьми альтернативных технологических процессов различными фармацевтическими компаниями.
Технологические особенности производства включают необходимость защиты от окислительной деградации через применение инертных атмосфер и низкотемпературных режимов. Коммерческие препараты стабилизируются в форме эфирных производных — ретинил ацетата или ретинил пальмитата.
Рынок и экономика производства
Фармацевтическое значение ретинола подтверждается его включением в Перечень основных лекарственных средств ВОЗ. Витамин A занимает 298-ю позицию среди наиболее назначаемых препаратов в США с объёмом более 500 000 рецептов в 2021 году[20].
Структура глобального рынка характеризуется доминированием кормовых применений (87 % объёма), при этом пищевые добавки и фармацевтические препараты составляют 13 % производства. Крупнейшими производителями являются DSM и BASF, контролирующие значительную долю мирового выпуска.
Антимонопольные расследования Европейской комиссии в 2001 году выявили картельные соглашения между ведущими производителями витаминов, датируемые 1989 годом, что привело к наложению штрафов на общую сумму 855,22 млн евро. Реструктуризация отрасли включала продажу витаминного подразделения Roche компании DSM в 2003 году.
Примечания
- ↑ Заболотнева А. А., Шатова О. П., Микин И. Е., Бриль Д. В., Румянцев С. А. Регуляторная роль и потенциальные антиканцерогенные свойства некоторых активных форм витаминов и витаминоподобных веществ // Вопросы питания. — 2022. — Т. 91, № 1. — С. 53-64. — ISSN 0042-8833.
- ↑ All-trans-Retinol (CAS 68-26-8). Glentham Life Sciences. Дата обращения: 1 октября 2025.
- ↑ Островский М. А. Молекулярная физиология зрительного пигмента родопсина: актуальные направления // Российский физиологический журнал им. И. М. Сеченова. — 2020. — Т. 106, № 4. — С. 401—420.
- ↑ Semba R. D. On the «discovery» of vitamin A // Ann Nutr Metab. — 2012. — Vol. 61(3). — P. 192—198.
- ↑ Уолд Джордж // Лауреаты Нобелевской премии / отв. ред. Е. Ф. Губский. — М.: Прогресс, 1992. — С. 852. — ISBN 5-01-002539-6.
- ↑ Kiser P. D. Retinal Pigment Epithelium 65 kDa Protein (RPE65): An Update // Prog Retin Eye Res. — 2022. — № 88. — P. 64. — ISSN 1350-9462.
- ↑ Островский М. А. Молекулярные механизмы взаимодействия белков, участвующих в трансдукции фоторецепторного сигнала // Успехи биологической химии. — 2005. — Т. 45, № 4. — С. 174-204.
- ↑ Фельдман Т. Б. Функции ретиналя - хромофора зрительного пигмента родопсина, в норме и при патологии. Автореф. дис. на соискание учёной степени кандидата биологических наук : 03.01.02. — Москва: Ин.-т. хим. физики им Н. Н. Семёнова РАН, 2013. — 375 с.
- ↑ Моносова О. Ю., Шарапова К. Г. Витамины, микро- и макронутриенты и их влияние на иммунную систему // Эффективная фармакотерапия в педиатрии. — 2012. — № 2. — С. 6–11.
- ↑ Шарова А. А. Омоложение кожи под управлением ретинола: преимущества топического ухода // Косметика и медицина : журнал. — 2023. — № 4.
- ↑ Manna P. R. Up-regulation of steroid biosynthesis by retinoid signaling: Implications for aging // Mech Ageing Dev. — 2015. — Август (№ 150). — С. 74–82.
- ↑ Коденцова В. М., Рисник Д. В. Каротиноиды: пищевые источники, уровень потребления и клинически эффективные дозы // Медицинский совет. — 2023. — № 6. — С. 299–310.
- ↑ Lidén M. Understanding retinol metabolism: structure and function of retinol dehydrogenases // Journal of Biological Chemistry. — 2006. — Т. 281, № 19. — С. 13001–13004.
- ↑ Ключников С. О., Гнетнева Е. С., Нечаева Н. Л. Витамин а и β каротин: целесообразность применения в педиатрической практике // Педиатрия. Журнал им. Г. Н. Сперанского. — 2007. — № 6. — С. 117–122.
- ↑ Carrington-Smith D. Mawson and Mertz: a re-evaluation of their ill-fated mapping journey during the 1911—1914 Australasian Antarctic Expedition // Med J Aust. — 2005. — Vol. 183 (11—12). — P. 638–641.
- ↑ Корь. Всемирная организация здравоохранения (14 ноября 2024). Дата обращения: 1 октября 2025.
- ↑ Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium, and Zinc // National Academies Press. — Washington (DC), 2001.
- ↑ Студеникин В. М. Потребность в витаминах и минеральных веществах у детей разного возраста // Лечащий врач / В. М. Студеникин. — 2014. — № 6. — С. 29–33.
- ↑ Bonrath W. 75 Years of Vitamin A Production: A Historical and Scientific Overview of the Development of New Methodologies in Chemistry, Formulation, and Biotechnology // Organic Process Research & Development. — 2023. — № 27(9). — P. 1557–1584.
- ↑ Davis K. Sample Design of the 2014 Medical Expenditure Panel Survey Insurance Component. Methodology Report #30. — Rockville: Agency for Healthcare Research and Quality, 2014. — 21 с.