Ферритин
Феррити́н — многофункциональный белковый комплекс железопротеидной природы (молекулярная масса 474–510 кДа, содержащий до 4500 атомов железа в кристаллическом ядре[1]), выполняющий ключевую роль в поддержании железного гомеостаза живых организмов.
Основные свойства
Железосодержащий протеин характеризуется способностью накапливать металл в биологически доступной форме, предотвращая его токсическое воздействие на клеточные структуры. Белковый комплекс демонстрирует универсальность распространения среди представителей всех царств живой природы — от архебактерий и прокариот до высших эукариотических организмов, включая растения и млекопитающих.
Функциональная значимость молекулы определяется её способностью увеличивать растворимость железа в клеточной среде в колоссальных масштабах. Протеиновая структура повышает концентрацию доступного железа с базового уровня 10-18 M до 10-4 M[2].
Молекулярная структура и химический состав
Архитектура белкового комплекса
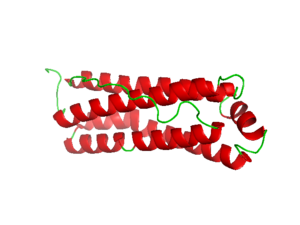
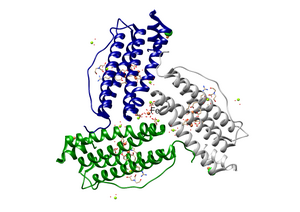
Пространственная организация железосодержащего протеина представляет собой глобулярную конструкцию, состоящую из 24 полипептидных цепей, формирующих полую сферическую наноструктуру. Нативный апоферритин характеризуется молекулярной массой в диапазоне 480–510 килодальтон.
Геометрические параметры белковой капсулы включают внешний диаметр порядка 12 нанометров при внутренней полости около 8 нанометров. Каждая составляющая субъединица обладает молекулярной массой 18,5–21 килодальтон, а центральная камера диаметром 5–8 нанометров служит резервуаром для железосодержащего минерального ядра[3].
Кристаллографические исследования детально описали трёхмерную архитектуру мышиного ферритинового комплекса, выявив особенности активных центров лёгких цепей с разрешением 1,2 ангстрема.
Типы субъединиц и изоформы
Полипептидная композиция демонстрирует выраженную гетерогенность, включающую до 20 различных изоферритиновых вариантов. Основу структурного разнообразия составляют два типа субъединиц: тяжёлые (H-цепи, 21 кДа) с ферроксидазной активностью и лёгкие (L-цепи, 19 кДа), участвующие в процессинге железа[4].
Амфибии обладают дополнительной промежуточной M-субъединицей, расширяющей функциональный спектр белкового комплекса. Аминокислотные последовательности H- и L-цепей демонстрируют приблизительно 50 % гомологии, что указывает на их общее эволюционное происхождение от единого предкового гена.
Гетерополимерная природа цитозольного ферритина обеспечивается различными соотношениями H- и L-субъединиц, формирующих полую сферическую наноклетку вокруг кристаллического железного ядра. Тканевая специфичность выражается в преобладании L-богатых изоформ в селезёнке и печени, характеризующихся большей основностью по сравнению с H-богатыми вариантами сердца и эритроцитов.
Железосодержащее ядро
Минеральная составляющая представлена кристаллитами гидроксифосфата трёхвалентного железа, структурно напоминающими ферригидрит (5Fe2O3·9H2O)[5]. Каждый атом железа в кристаллической решётке окружён шестью атомами кислорода, образуя октаэдрическую координацию.
Накопительная ёмкость единичной молекулы варьирует от 4000 до 4500 атомов железа[1], концентрирующихся в виде гидроксидных кристаллов внутри белковой оболочки. Процесс минерализации инициируется поступлением двухвалентного железа через специализированные каналы с последующим окислением до трёхвалентной формы.
Специализированные формы ферритина
Митохондриальный ферритин
Субклеточная локализация железосвязывающего белка включает специализированную митохондриальную изоформу, открытую в 2001 году. Ген FTMT кодирует уникальный вариант протеина, характеризующийся отсутствием интронных последовательностей[6].
Данная изоформа синтезируется как предшественник (про-белок), подвергающийся протеолитическому процессингу при транспорте в митохондриальный матрикс. Структурные особенности включают гомополимерную организацию исключительно из H-типа субъединиц и преимущественно α-спиральную конформацию с минимальным содержанием β-структур.
Растительные ферритины
Ботанические варианты железосвязывающего протеина характеризуются специфической архитектурой. Центральное железосодержащее ядро окружено белковой оболочкой толщиной 2–3 нанометра, состоящей из 24 глобулярных субъединиц[7].
Биосинтетический процесс включает первоначальное формирование апоферритина — белковой структуры, лишённой металлического компонента. Субъединичная самосборка создаёт центральную полость, которая впоследствии заполняется ионами двухвалентного железа с последующей кристаллизацией.
Метаболическая трансформация растительного ферритина в фитосидерин представляет собой сложный биохимический процесс, обеспечивающий долгосрочное депонирование железа в растительных тканях.
Специализированные биологические формы
Метаболическая классификация включает анаболический вариант, формирующийся из алиментарного железа, и катаболический тип, образующийся при гемолизе эритроцитов. Гипоксические условия индуцируют синтез SH-ферритина, обладающего вазопаралитическими свойствами[8].
Репродуктивная специализация у гастропод проявляется в формировании желточного ферритина с уникальной генетической последовательностью, отличающейся от соматических изоформ. Биосинтез осуществляется железами средней кишки с последующей секрецией в гемолимфу и транспортом к развивающимся яйцеклеткам.
Физиологические функции
Депонирование и метаболизм железа
Центральная метаболическая роль железосвязывающего протеина заключается в накоплении до 30% общих железных запасов организма при расходовании лишь 0,1% от депонированного количества[9]. Транспортная функция обеспечивает перемещение металла через кишечную стенку и плацентарный барьер, выступая посредником между трансферрином и внутриклеточными потребностями.
Молекулярный механизм железосвязывания основан на способности апоферритина захватывать свободные двухвалентные ионы с последующим депонированием в трёхвалентной форме. Данный процесс предотвращает накопление токсичного свободного железа в цитоплазме клеток.
Антиоксидантная защита
Цитопротективная функция железосвязывающего протеина реализуется через предотвращение образования высокотоксичных гидроксильных радикалов посредством реакции Фентона. Исследования продемонстрировали выраженный антирадикальный эффект ферритина, включающий снижение концентрации ОН-радикалов в клеточной среде[10].
Защитный механизм основан на секвестрации свободного железа, которое в противном случае катализировало бы образование активных кислородных метаболитов из перекиси водорода. Данная функция приобретает особую значимость в условиях окислительного стресса и воспалительных процессов.
Ферроксидазная активность
Каталитическая функция H- и M-субъединиц обеспечивает конверсию двухвалентного железа в трёхвалентную форму, предотвращая накопление потенциально токсичных Fe2+ ионов[11]. Активный центр локализован в дижелезном связывающем сайте в центральной части каждой тяжёлой субъединицы.
Механизм ферроксидазной реакции включает метастабильное состояние Fe3+ продукта в каталитическом центре с последующим вытеснением двухвалентным железом. Данный циклический процесс обеспечивает непрерывное окисление поступающего металла. Лёгкие цепи, лишённые ферроксидазной активности, специализируются на электронном транспорте через белковую оболочку, обеспечивая эффективное функционирование каталитического механизма.
Регуляция синтеза и метаболизма
Факторы регуляции
Биосинтетический контроль железосвязывающего протеина осуществляется на уровне стабильности и количества матричной РНК, включая модификации процессов её хранения и трансляционной эффективности. Присутствие железа в клеточной среде служит основным стимулом для активации ферритинового синтеза, за исключением желточных изоформ Lymnaea sp.[12], лишённых железочувствительных регуляторных элементов.
Ответ на стресс и воспаление
Острофазовая природа железосвязывающего белка проявляется в резком возрастании его концентрации при инфекционных процессах и онкологических заболеваниях. Эндотоксины бактериального происхождения активируют транскрипцию ферритинового гена, вызывая многократное повышение синтеза протеина.
Парадоксальная реакция наблюдается при инфицировании Pseudomonas[13], где, несмотря на присутствие эндотоксинов, концентрация плазменного ферритина значительно снижается в первые 48 часов. Данный феномен рассматривается как защитный механизм, лишающий патогенные микроорганизмы доступа к железным запасам хозяина.
Клиническое значение и диагностика
Нормальные референсные значения
Современные клинические стандарты определения нормальных концентраций железосвязывающего протеина были пересмотрены Американской гастроэнтерологической ассоциацией в 2020 году, установившей референтный диапазон 45–120 нг/мл[14]. Всемирная организация здравоохранения в своих рекомендациях 2020 года определила пороговые значения дефицита железа: менее 12 нг/мл для детей до пяти лет и менее 15 нг/мл для лиц старше пятилетнего возраста.
Возрастная динамика характеризуется максимальными концентрациями у новорождённых (до 600 мкг/л в первые два месяца) с последующим снижением до 55–210 мкг/л в период от двух месяцев до полугода. Стабилизация показателей в диапазоне 8–143 мкг/л наблюдается до 15-летнего возраста.
Половые различия проявляются в пубертатном периоде: референсные значения для юношей составляют 21–250 мкг/л, тогда как для девушек характерны более низкие концентрации 10–125 мкг/л. Типичные диапазоны для взрослых включают 40–300 нг/мл для мужчин и 20–200 нг/мл для женщин.
Лабораторные методы исследования
Аналитическое определение железосвязывающего протеина осуществляется с использованием метода Клочкова на основе сульфата кадмия[15], а также иммуногистохимических подходов со специфическими антисыворотками. Гистохимическая детекция применяет реакцию берлинской лазури (образование железосинеродистого железа) или модификацию Перльса для выявления оксидов трёхвалентного железа.
Количественные измерения проводятся в нанограммах на миллилитр или эквивалентных микрограммах на литр в рамках комплексного исследования железного статуса. Сывороточные концентрации рассматриваются как интегральный показатель общих железных запасов организма в стационарных условиях.
Подготовка к анализу
Стандартизированная преаналитическая подготовка включает соблюдение восьмичасового голодания перед венепункцией для исключения алиментарных влияний на результаты. Трёхсуточная отмена железосодержащих препаратов необходима для предотвращения ложного завышения показателей.
Физическое и эмоциональное напряжение должно быть исключено за 30–40 минут до забора биоматериала во избежание стресс-индуцированных изменений эндокринного статуса, влияющих на биохимический состав сыворотки крови[16].
Патологические состояния
Дефицит железа и анемии
Диагностическая значимость снижения концентрации железосвязывающего протеина была установлена в 2015 году: уровень менее 30 нг/мл указывает на железодефицитное состояние, тогда как концентрация ниже 10 нг/мл свидетельствует о развитии железодефицитной анемии[17].
Клиническая специфичность низких сывороточных концентраций при анемических состояниях превосходит чувствительность, поскольку воспалительные процессы и хронические заболевания могут маскировать истинный дефицит железа повышением ферритина. Ложноположительные результаты крайне редки, но могут возникать вследствие hook-эффекта измерительных систем при экстремально высоких концентрациях.
Избыток железа
Гиперферритинемия может отражать как истинную перегрузку железом, так и острую воспалительную реакцию с мобилизацией белка независимо от железного статуса. Наследственный гемохроматоз, множественные гемотрансфузии и парентеральное введение железа составляют основные причины накопления металла.
Диагностическая точность определения нарушений железного метаболизма достигает 95 % при использовании коэффициента насыщения трансферрина (отношение сывороточного железа к общей железосвязывающей способности) свыше 60% у мужчин и 50% у женщин[18]. Данный подход особенно ценен для ранней диагностики наследственного гемохроматоза при ещё нормальных уровнях ферритина.
Воспалительные заболевания
Исследования установили значительное повышение концентрации железосвязывающего протеина при COVID-19 с корреляцией между уровнем ферритина и тяжестью клинических проявлений[19]. Сочетание с интерлейкином-6 рассматривается как потенциальный биомаркер тяжёлых и фатальных форм коронавирусной инфекции.
Респираторные и урогенитальные инфекции, аутоиммунные процессы сопровождаются реактивным повышением ферритина, которое может маскировать сопутствующий дефицит железа. Болезнь Стилла взрослых, порфирии и гемофагоцитарный лимфогистиоцитоз характеризуются экстремальным возрастанием концентраций протеина.
Заболевания печени
Гепатологические нарушения демонстрируют сложные взаимоотношения с железным метаболизмом, включающие как перегрузку, так и дефицит металла у пациентов с циррозом[20]. Этиологические факторы включают снижение синтеза гепсидина при нарушении функциональной способности печени и хронические кровотечения вследствие портальной гипертензии.
Воспалительный компонент продвинутых стадий хронических гепатопатий обусловливает стабильное повышение как печёночных, так и сывороточных концентраций ферритина. Прогностическая значимость проявляется в ассоциации высоких уровней протеина с повышенным риском краткосрочной летальности при острой декомпенсации и острой-на-хронической печёночной недостаточности.
Генетические аспекты
Наследственные нарушения
Молекулярно-генетические дефекты ферритинового метаболизма включают мутации гена FTL, кодирующего лёгкую цепь протеина. Исследования идентифицировали связь данных мутаций с развитием взрослой болезни базальных ганглиев (OMIM 606159), известной также как нейроферритинопатия[21]. Альтернативным проявлением генетических нарушений служит синдром гиперферритинемии с катарактой (OMIM 600886), характеризующийся сочетанием повышенных концентраций протеина с офтальмологическими поражениями.
Структурная организация генов железосвязывающего белка у позвоночных характеризуется консервативной архитектурой: три интрона разделяют четыре экзона в позициях между аминокислотными остатками 14–15, 34–35 и 82–83. Функциональная значимость тирозинового остатка в 27-й позиции связана с процессами биоминерализации.
Специальные состояния
Беременность и развитие
Гестационные изменения железного метаболизма характеризуются прогрессивным снижением концентрации ферритина относительно показателей небеременных женщин. Физиологическая норма составляет приблизительно 50 % от исходных значений в первом триместре, 30 % во втором и не менее 12 % в третьем триместре[22].
Репродуктивная биология беспозвоночных демонстрирует специализированные механизмы железного транспорта: синтез желточного ферритина в железах средней кишки с последующей секрецией в гемолимфу и направленным транспортом к развивающимся гаметам.
Нарушения питания
Метаболические расстройства пищевого поведения проявляют парадоксальные изменения концентрации железосвязывающего протеина. Нервная анорексия сопровождается повышением ферритина в периоды острого недоедания, предположительно вследствие перераспределения железа в депо при снижении объёма циркулирующей крови[23].
Катаболическая природа анорексических расстройств способствует высвобождению изоферритинов с неспецифическими защитными функциями, включая антиоксидантную активность. Иммунологические методы детекции регистрируют данные изоформы, не отражая истинный статус железных запасов.
Терапевтические подходы
Диетическая коррекция
Нутритивная оптимизация железного статуса при недостаточности ферритина включает употребление богатых гемовым железом продуктов[24]:
Растительные источники:
Фруктово-ягодная группа включает чёрную смородину, вишню, гранаты и яблоки, тогда как орехи представлены миндалём и грецкими орехами. Овощная группа дополняется томатами, свёклой, шпинатом и листовой зеленью.
Клиническая эффективность железосодержащих добавок продемонстрирована у женщин с симптомами усталости при концентрации ферритина менее 50 нг/мл, что превышает традиционные пороговые значения анемии.
Мониторинг и контроль
Лабораторный контроль железного статуса в стационарных условиях основан на корреляции сывороточного ферритина с общими железными запасами организма. Это делает данный показатель удобным инструментом оценки депо металла.
Исключение острофазовых влияний достигается параллельным определением C-реактивного белка: нормальные значения последнего подтверждают отсутствие воспалительной природы изменений ферритина[25].
Литература
- Розанова Л. С. Исследование гипотензивных свойств железа в условиях экспериментальной почечной гипертонии: К вопросу о роли ферритина : диссертация … кандидата биологических наук: 03.00.00. — М., 1958. — С. 222.
Примечания
- ↑ 1,0 1,1 Harrison P. M., Arosio P. Molecular properties, iron storage function and cellular regulation of ferritins (англ.) // Biochimica et Biophysica Acta. — 1996. — Vol. 1275, № 3. — С. 161–203.
- ↑ Розанова Л. С. Исследование гипотензивных свойств железа в условиях экспериментальной почечной гипертонии: К вопросу о роли ферритина : диссертация … кандидата биологических наук: 03.00.00. — М., 1958. — С. 222.
- ↑ Theil E.C. Ferritin protein nanocages-the story (англ.) // Nanotechnology. — 2013. — Vol. 24, № 1.
- ↑ Громова О. А., Торшин И. Ю., Чучалин А. Г. Ферритин как биомаркер старения: геропротекторные пептиды стандартизированного гидролизата плаценты человека // Терапевтический архив. — 2024. — Т. 96, № 7. — С. 567–575.
- ↑ Arosio P., Levi S. Ferritin, iron homeostasis, and oxidative damage (англ.) // Free Radical Biology and Medicine. — 2002. — Vol. 33, № 4. — С. 457–463.
- ↑ Levi S., Corsi B., Bosisio M. A human mitochondrial ferritin encoded by an intronless gene (англ.) // Journal of Biological Chemistry. — 2001. — Vol. 276, № 27. — С. 24437–24440.
- ↑ Zancani M., Peresson C., Birschmann I. Evidence for the presence of ferritin in plant mitochondria // European Journal of Biochemistry. — 2004. — Vol. 271, № 18. — С. 3657–3664.
- ↑ Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека: в 2 томах / пер. с англ.. — М.: Мир, 1993. — Т. 2. — С. 415.
- ↑ Северин Е.С. Биохимия: учебник для вузов / под ред. Е.С. Северина.. — М.: ГЭОТАР-Медиа, 2004. — С. 779.
- ↑ Theil E.C. Ferritin iron minerals are chelator targets, antioxidants, and coated, dietary iron (англ.) // Journal of Nutritional Biochemistry. — 2013. — Vol. 24, № 6. — С. 1003–1008.
- ↑ Bradley J.M., Svistunenko D.A., Lawson T.L. The Ferroxidase Centre of Escherichia coli Bacterioferritin Plays a Key Role in the Reductive Mobilisation of the Mineral Iron Core (англ.) // Angewandte Chemie. — 2024. — Vol. 136, № 19. — PMID e202401379.
- ↑ von Darl M., Harrison P.M., Bottke W. cDNA cloning and deduced amino acid sequence of two ferritins: soma ferritin and yolk ferritin, from the snail Lymnaea stagnalis L (англ.) // European Journal of Biochemistry. — 1994. — Vol. 222, № 2. — С. 353–366.
- ↑ Birgegård G., Hallgren R., Caro J. Serum Ferritin during Infection (англ.) // Scandinavian Journal of Haematology. — 1978. — Vol. 21, № 4. — С. 333-340.
- ↑ Ko C.W., Siddique S.M., Patel A. AGA Clinical Practice Guidelines on the Gastrointestinal Evaluation of Iron Deficiency Anemia (англ.) // Gastroenterology. — 2020. — Vol. 159, № 3. — С. 1085–1094.
- ↑ Хромопротеиды // Учебные материалы по биохимии СПбГПМУ.
- ↑ Анализ крови на ферритин. Privatklinik. Дата обращения: 27 сентября 2025.
- ↑ Железодефицитная анемия. Справочник MSD Профессиональная версия. Дата обращения: 27 сентября 2025.
- ↑ Трансферрин, коэффициент насыщения трансферрина //. SYNLAB Eesti — клинико-диагностическая лаборатория. Дата обращения: 27 сентября 2025.
- ↑ Полушин Ю. С., Шлык И. В., Гаврилова Е. Г. Роль ферритина в оценке тяжести COVID-19 // Вестник анестезиологии и реаниматологии. — 2021. — Т. 18, № 4. — С. 20–28.
- ↑ Kowdley K.V. The Role of Iron and Iron Overload in Chronic Liver Disease (англ.) // Gastroenterology Clinics of North America. — 2016. — Vol. 45, № 2. — С. 317–331.
- ↑ Hamosh A. Mutation in the gene encoding ferritin light polypeptide causes dominant adult-onset basal ganglia disease (англ.) // Nature Genetics. — 2001. — Vol. 28, № 4. — С. 350–354.
- ↑ Бобров С. А., Репина М. А., Клиценко О. А. Сывороточный ферритин как фактор прогноза развития железодефицитной анемии у беременных женщин // Журнал акушерства и женских болезней. — 2011. — Т. 60, № 3. — С. 32–37.
- ↑ Tran J., Story C., Moore D. Unexpected increased ferritin concentration in patients with anorexia nervosa (англ.) // Annals of Clinical Biochemistry. — 2013. — Vol. 50, № 6. — С. 569–572.
- ↑ Favrat B., Balck K., Breymann C. Effect of iron supplementation on fatigue in nonanemic menstruating women with low ferritin: a randomized controlled trial (англ.) // Canadian Medical Association Journal. — 2012. — Vol. 184, № 11. — С. 1247–1254.
- ↑ Physiology, Acute Phase Reactants (англ.) // StatPearls — NCBI Bookshelf.