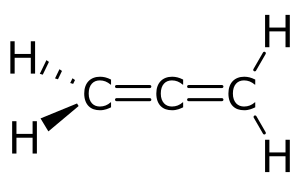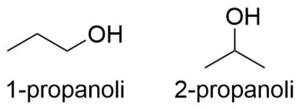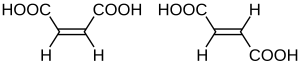Изомерия
Изомери́я (от др.-греч. «ἴσος» — равный, греч. «μέρος» — доля, часть) — явление, заключающееся в существовании химических соединений, одинаковых по составу, с одинаковой молекулярной массой, но различающихся по структуре. Такие соединения называются изомерами. Изомеры могут превращаться друг в друга в результате реакций изомеризации[1].
Структурные различия обусловливают различное взаимное влияние атомов в молекулах и предопределяют разные физические и химические свойства изомеров. Изомерия чрезвычайно распространена в органической химии и является одной из основных причин разнообразия и многочисленности органических соединений. В неорганической химии изомерия встречается в основном для комплексных соединений[2].
История появления
Термин «изомерия» был введён в 1830 году Й. Я. Берцелиусом, опираясь на результаты исследований винной и виноградной кислот, после завершения полемики по вопросу существования двух резко отличающихся по свойствам веществ, имеющих один и тот же состав AgCNO — цианата и фульмината серебра между учёными-химиками Ф. Вёлером и Ю. фон Либихом[2].
Позднее сущность явления изомерии была объяснена в теории химического строения органических веществ[2].
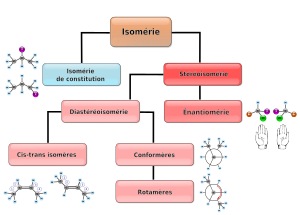
Виды изомерии
Под изомерией органических соединений в химии понимают явление существования веществ-изомеров. Изомерами называют соединения, имеющие одинаковый качественный и количественный состав, то есть молекулярную формулу, но разное строение и свойства, то есть структурную формулу.
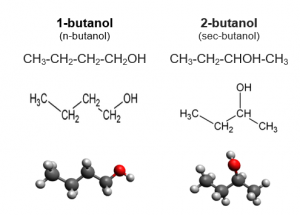
Молекулярная формула вещества показывает только количество и тип атомов. Например, C4H9OH, бутанол[3].
Структурная формула отражает взаимное расположение атомов в молекуле. Приведенная молекулярная формула может принадлежать сразу нескольким веществам, так как гидроксильная группа (-ОН) может располагаться у разных атомов. Под формулой может скрываться бутанол-1 CH3-CH2-CH2-CH2-OH, бутанол-2 CH3-CH2-CH2-CH(OH)-CH3 или бутанол-3 CH3-CH2-CH(OH)-CH3. Эти вещества называются изомерами и имеют разное взаимное расположение атомов[3].
В органической химии выделяют 2 основных вида изомерии:
- структурную;
- пространственную (стереоизомерию).
Структурные изомеры различаются химическим строением — порядком связей атомов в молекуле. Пространственные изомеры (стереоизомеры) различаются взаимным расположением атомов в пространстве при одинаковом порядке связей атомов в молекуле[3].
Различия в свойствах скелетных изомеров проявляются в разнице их температур кипения (изомеры с нормальной углеродной цепью кипят при более высокой температуре, чем изомеры с разветвлённой цепью), плотности и др. Алканы в отличие от разветвлённых изомеров, обладают меньшей детонационной стойкостью, образуют комплексы с мочевиной, называемые клатратами[2].
Структурная изомерия
Структурная изомерия подразумевает различный порядок расположения атомов в молекуле. Делится на несколько типов[2][3]:
- углеродного скелета;
- положения кратной связи;
- положения функциональной группы;
- межклассовая;
- взаимного расположения заместителей;
- метамерия;
- таутомерия.
Типы структурной изомерии представлены в таблице 1[1].
| Класс | Общая формула | Примеры | |
|---|---|---|---|
| Алкены | СnН2n | C6H12 | |
| Циклоалканы | |||
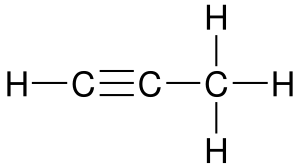
| Алкины | СnH2n-2 | C3H4 | |
| Алкадиены | |||
| Спирты | CnH2n+2O | C3H8O | |
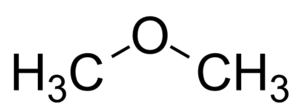
| Простые эфиры | |||
| Карбоновые кислоты | CnH2nO2 | C2H4O2 | |
| Сложные эфиры | |||
| Альдегиды | CnH2nO | С3Н6О | |
| Кетоны | |||
Изомерия углеродного скелета
В изомерах углеродного скелета различный порядок связей углеродных атомов, образующих скелет молекулы. Для конкретизации структурных особенностей изомеров скелетная изомерия подразделяется[3]:
- на изомерию углеродной цепи;
- изомерию цикла;
- изомерию боковой цепи.
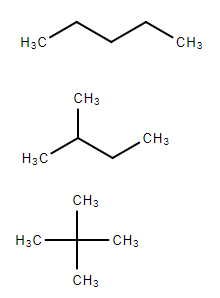
Так, изомерия углеродной цепи характерна для алканов, начиная с четвёртого члена гомологического ряда бутана C4H10, у которого два структурных изомера[3]:
- н-бутан CH3−CH2−CH2−CH3;
- изобутан (2-метилпропан) CH3−CH(CH3)−CH3.
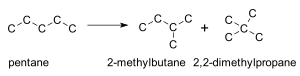
Пентан C5H12 — пятый член ряда алканов имеет три изомера[2]:
- CH3−CH2−CH2−CH2−CH3 — н-пентан,
- CH3−CH(CH3)−CH2−CH3 — изопентан (2-метилбутан)
- CH3−(CH3)2−CH3 — неопентан (2,2-диметилпропан)
С удлинением углеродной цепи число возможных изомеров возрастает: у декана C10H22 — 75 структурных изомеров, тридекана C13H28 — 802 изомеров, для эйкозана C20H42 — более 366 000 изомеров[2].
Для алициклических соединений характерны изомерия цикла и изомерия боковой цепи. Например, среди скелетных изомеров с содержанием более четырёх углеродных атомов: метилциклопентан (I), циклогексан (II) и пропилциклопропан (III), которые являются являются циклическими изомерами, а пропилциклопропан (III) и изопропилциклопропан (IV) — изомерами боковой цепи[3].
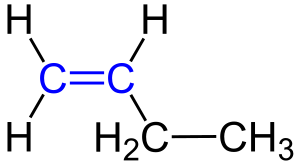
Изомерия положения кратной связи
Характерна для соединений, содержащих кратные связи, двойные (например, алкены) или тройные (например, алкины). Например: бутен-1, бутен −2[1].
Изомерия функциональной группы
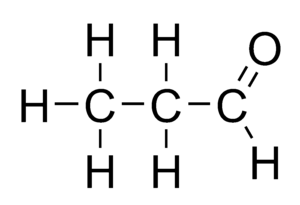
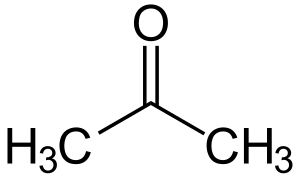
Заместитель или функциональная группа могут находиться в разных местах молекулы, то есть могут быть присоединены к разным атомам углерода в цепи органического соединения. В основном она встречается в кетонах, альдегидах, эфирах насыщенных карбоновых кислот и насыщенных алифатических карбоновых кислотах[1].
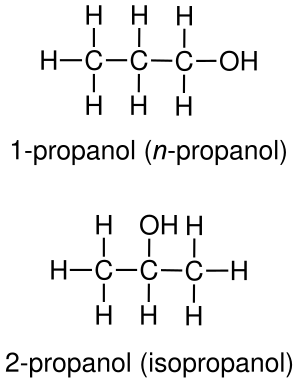
Например: изомерами на основе функциональных групп являются пропанол-1 и пропанол-2[1]:
Межклассовая изомерия
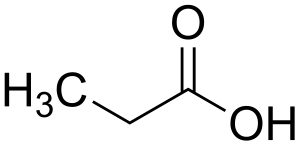
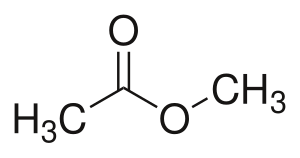
Вид структурной изомерии при которой органические вещества разных классов имеют одну общую формулу. К таким изомерам относятся: алкины и алкадиены, алкены и циклоалканы, спирты и простые эфиры, альдегиды и кетоны, сложные эфиры и карбоновые кислоты. Например: метилацетат CH3-COO-CH3 и пропановая кислота CH3-CH2-COOH[1].
Метамерия
Различное положение гетероатома (O, N, S) в углеродной цепи объясняют наличие метамерии. Например, метамерами являются диэтиловый эфир CH3−CH2−O−CH2−CH3 и метилпропиловый эфир CH3−O−CH2−CH2−CH3, метилпропиламин CH3−NH−CH2−CH2−CH3 и диэтиламин CH3−CH2−NH−CH2−CH3[2].
Метамерия имеет место у алифатических простых эфиров, сложных эфиров, аминов и тиоспиртов.
Таутомерия
Особым видом структурной изомерии является таутомерия (равновесная динамическая изомерия). В этом случае различающиеся функциональными группами изомеры, легко переходят друг в друга до достижения равновесия, при котором вещество одновременно содержит молекулы таутомеров в определённом соотношении[2].
Химические соединения, способные к таутомерии, представляют собой смесь двух или нескольких структурно различных соединений, находящихся в состоянии быстрого равновесия. Такое явление называется таутомерией. Когда такое явление имеет место, происходит быстрый перенос атома от одной молекулы к другой и обратно. Почти во всех случаях таким подвижным атомом является водород. Широко распространена таутомерия между карбонильными соединениями, содержащими атом водорода в α- положении, и их енольной формой[4].
Пространственная изомерия
Пространственная изомерия — вид изомерии, при котором молекулы, обладающие одинаковым составом, имеют разное положение в пространстве[1]. Пространственная изомерия связана с различным взаимным расположением атомов в молекуле. При этом сама структура остается прежней. Пространственная изомерия подразделяется на геометрическую (цис-транс-, син-анти- и E-Z-изомерию) и оптическую[3].
Геометрическая изомерия
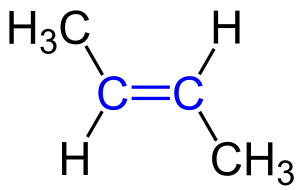
Геометрическая (цис-; транс-) изомерия обусловлена различным положением заместителей при двойной связи или при цикле и характерна алкенам, в молекулах которых атомы углерода при двойной связи не связаны с одинаковыми атомами или группами атомов.
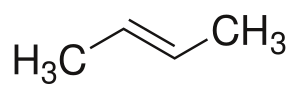
Если заместители расположены по одну сторону от двойной связи, их называют цис-изомерами, а изомерию — цис-изомерией. Если заместители расположены по разные стороны от двойной связи — транс-изомерами и транс-изомерией. Например: цис-2-бутен и транс-2-бутен[1].
Оптическая изомерия (энантиомерия)
Оптическая изомерия возникает при вращении атомов вокруг кратной связи. Она характерна для алкенов и алкинов. Аналогичное явление обнаружено у циклов с несколькими заместителями.
Оптическая изомерия характеризуется различным расположением молекул относительно одного атома и определяет разные химические свойства изомеров. Это должен быть асимметричный углерод — с четырьмя разными заместителями. Он называется хиральным центром. Изомеры являются зеркальным отражением друг друга, как правая и левая рука[3].
Диастереомерия
Любые комбинации пространственных изомеров, не составляющие пару оптических антиподов, считаются диастереомерными. Это стереоизомеры, которые не являются зеркальными изображениями друг друга. Различают σ- и π-диастереомеры[5][6].
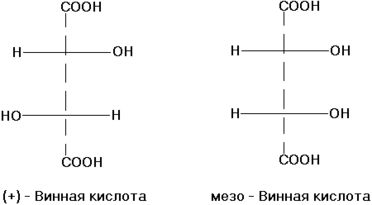
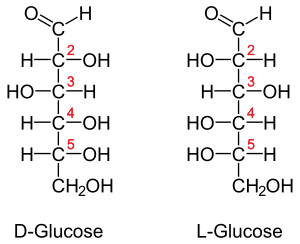
Если геометрические изомеры отличаются друг от друга конфигурацией части имеющихся в них элементов хиральности, то их называют σ-диастереомеры. Например, к диастереомерам относят (+)-винную кислоту и мезо-винную кислоту, D-глюкозу и D-маннозу[5]:
Если геометрические изомеры имеют различия пространственного расположения заместителей относительно плоскости двойной связи (чаще всего С=С и С=N) или цикла, их относят к π-диастереомерам. Например, (Е)- и (Z)-бензальдоксимы, малеиновая и фумаровая кислоты, цис- и транс-1,2-диметилциклопентаны[6].
Поворотная изомерия (конформационная изомерия)
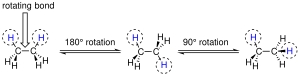
Поворотная изомерия (конформационная изомерия) — явление в химии, при котором молекулы могут принимать различные пространственные формы в результате внутримолекулярного вращения вокруг одной или нескольких простых связей. Такие формы называют конформациями или поворотными изомерами (конформерами). Например, в молекуле этана (Н3С-СН3) при вращении одной группы (-СН3) относительно другой возникает множество неодинаковых форм, среди которых выделяют две характерные конформации (А и Б), отличающиеся поворотом на 60 °[7].
Электронная плотность σ-связи (сигма-связь) распределена симметрично относительно оси, соединяющей ядра связываемых атомов (цилиндрическая или вращательная симметрия). Поэтому при вращении атомов вокруг σ-связи её разрыва не происходит. Теоретически молекула может принимать бесчисленное множество конформаций, но реализуются энергетически выгодные. С увеличением атомов углерода в молекуле увеличивается число различимых конформаций. Например, в н-бутане вращение по центральной С-С (углерод-углерод) связи приводит к четырём поворотным изомерам, наиболее устойчивым из которых является конформер, в котором группы (-СН3) максимально удалены друг от друга[7].
Изомеризация
Изомеризация — процесс превращения химических соединений в изомеры — соединения другого строения, без изменения состава и молекулярной массы. При изомеризации может измениться углеродный скелет молекулы, природа функциональных групп или их положение в молекуле, геометрическая конфигурация комплексного соединения, положение кратных связей, пространственное расположение атомов или атомных групп относительно плоскости кратной связи, вокруг асимметричного центра. Также возможно образование или раскрытие, сужение или расширение цикла[8].
Реакции изомеризации применяются при изомеризации углеводородов, крекинге нефти, риформинге, для получения более качественного моторного топлива, для получения капролактама изомеризацией оксима циклогексанона, который используется в качестве сырья для производства капрона. Многие процессы изомеризации названы по имени учёных-химиков, которые впервые их осуществили: перегруппировка Бекмана, перегруппировка Коупа[8].
Литература
- Пальм В. А. Введение в теоретическую органическую химию. — М.: Высшая школа, 1974. — 446 с.
- Потапов В. М. Стереохимия. — М.: Химия, 1988. — 464 с. — ISBN 5-7245-0376-Х.
- Соколов В. И. Введение в теоретическую стереохимию. — М.: Наука, 1979. — 243 с.
- Сланина 3. Теоретические аспекты явления изомерии в химии. Пер. с чешского. — М.: Мир, 1984. — С. 166.
- Физер Л., Физер М. Органическая химия. Углубленный курс. пер. с англ. / под ред. Вульфсона Н. С.. — М.: Химия, 1969. — Т. 1. — 688 с.
- Химия: Большой энциклопедический словарь / под ред. ред. И. Л. Кнунянц. — М.: Химическая энциклопедия словаря, 1998. — 790 с. — ISBN 5-85270-253-6.
Примечания
- ↑ 1,0 1,1 1,2 1,3 1,4 1,5 1,6 1,7 Изомерия. Естественнонаучный институт Самарского университета. Химический факультет. Дата обращения: 6 декабря 2025.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 2,7 2,8 Изомерия. Большая российская энциклопедия. Дата обращения: 6 декабря 2025.
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 3,7 3,8 Органическая химия 1: изомерия и номенклатура. Российский университет дружбы народов (РУДН). Дата обращения: 6 декабря 2025.
- ↑ Зуев В. В. Определение константы равновесия кетоно-енольной таутомерии ацетоуксусного эфира в раствореРА В РАСТВОРЕ. Санкт-Петербургский национальный исследовательский университетинформационных технологий, механики и оптики. Дата обращения: 6 декабря 2025.
- ↑ 5,0 5,1 Зыкова М. В. Органическая химия. Пространственное строение органических соединений. — Томск: СибГМУ, 2016. — 86 с.
- ↑ 6,0 6,1 Диастереомеры. Большая российская энциклопедия. Дата обращения: 6 декабря 2025.
- ↑ 7,0 7,1 Стереоизомерия. Южный Федеральный университет. Химический факультет. Дата обращения: 6 декабря 2025.
- ↑ 8,0 8,1 Изомеризация. Большая российская энциклопедия. Дата обращения: 6 декабря 2025.