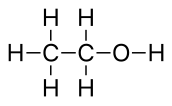
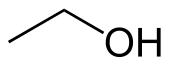
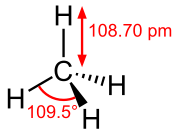Структурная формула
Структу́рная формула́ — изображение, отражающее качественный, количественный и пространственный состав вещества[1]. В отличие от химических формул, которые лишь в общих чертах характеризуют состав вещества, структурные формулы предоставляют более точное и полное представление о геометрическом строении молекул. Многие химические соединения существуют в различных изомерных формах, которые, несмотря на то, что имеют разные энантиомерные структуры, обладают одной и той же химической формулой[2].
История развития стереохимии
Концепция структурной формулы представляет собой краеугольный камень стереохимии — науки, изучающей пространственное строение веществ[3]. В XVII веке стало известно, что при прохождении света через исландский шпат или кварц возникают два луча: «обыкновенный» и «необыкновенный». В 1808 году Эдмунд Малюс обнаружил, что аналогичным образом ведёт себя и отражённый свет. Он назвал его поляризованным[3].
В 1815 году французский физик Жан-Батист Био совершил открытие, которое оказало значительное влияние на развитие химии. Он обнаружил, что некоторые органические жидкости, такие как скипидар и лимонное масло, а также растворы определённых кристаллических веществ, например, камфоры, способны вращать плоскость поляризованного света. Открытие привлекло внимание химиков к оптической активности новых соединений[3].
В 1848 году в Париже учёный Луи Пастер, занимаясь исследованиями в области кристаллографии, сделал ряд открытий, которые легли в основу стереохимии. Изучая соли винной и виноградной кислот, он смог объяснить явление оптической активности. Пастер знал эмпирическую формулу этих кислот и то, что винная кислота обладает оптической активностью, а виноградная — нет. Кроме того, он заметил, что виноградная кислота менее растворима, чем винная. Луи Пастер изучал 19 видов солей винной кислоты и обнаружил, что у них отсутствует плоскость симметрии — они похожи на половинки целого. Такие кристаллы напоминают правую и левую руки: они выглядят одинаково, но не совпадают при наложении. Так как виноградная кислота не проявляла оптических свойств, Пастер думал, что её кристаллы должны быть симметричными[3].
При температуре до 27 °C Луи Пастер получил два вида кристаллов. Используя лупу и пинцет, он разделил их на две группы. Оказалось, что растворы этих кристаллов по-разному влияют на свет: одни поворачивают его вправо, другие — влево. Так доказано, что виноградная кислота состоит из двух разных форм винной кислоты: одна поворачивает свет вправо, другая — влево. Этот результат положил начало новой науке — стереохимии[3].
В 1854 году Луи Пастер обнаружил, что ферменты могут избирательно воздействовать на разные формы одной и той же молекулы. Он показал это на примере грибка, который разлагал определённые виды винной кислоты. К 1860 году Пастер разработал методы разделения подобных смесей на отдельные компоненты и предположил, что способность вещества влиять на свет связана с его асимметрией[3].
В 1861 году Александр Михайлович Бутлеров создал теорию строения, которая обосновала существование структурных изомеров органических соединений, но не объясняла оптическую изомерию. Для решения этой задачи в 1874 году создана первая стереохимическая теория, сформулированная Якобом Вант-Гоффом и Жозефом Ашилем Ле Белём. Независимо друг от друга оба учёных создали теорию пространственного расположения атомов в молекуле, основой которой стала тетраэдрическая модель асимметрического атома углерода. В 1893 году Альфред Вернер построил аналогичную теорию для стереохимии комплексных соединений, основанную на октаэдрической модели атома металла[3].
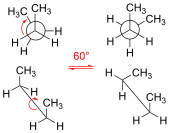
Исследование стереохимии реакций началось с открытия Паулем Вальденом в 1895 году обращения конфигурации атома углерода при бимолекулярном нуклеофильном замещении. В конце XIX века Адольф фон Байер ввёл представление о напряжении циклических систем, которое легло в основу гипотезы о неплоском строении циклов. Развитие этих идей привело к возникновению конформационного анализа[3].
Отражение связей
Различные типы химических связей оказывают существенное воздействие на физические и химические характеристики молекул. Одинарные связи, как правило, более гибкие и позволяют молекулам вращаться вокруг своей оси, в то время как двойные и тройные связи являются более жёсткими и ограничивают подвижность атомов. Это влияет на реакционную способность молекул и их поведение в различных химических реакциях[2].
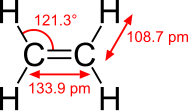
В качестве примера рассмотрены молекулы этана и этена. Этан содержит только прочные одинарные связи, в то время как этен содержит двойную связь между атомами углерода. Двойная связь менее прочна, чем одинарная. Этан участвует в реакциях замещения по месту разрыва связи С-Н. Этен обладает большей химической активностью и склонен к реакциям присоединения по месту разрыва связи[2].
Геометрия молекулы
Пространственное строение молекулы, определяющее взаимное расположение атомов в трёхмерном пространстве, включает в себя углы между связями, которые оказывают значительное влияние на физические и химические свойства вещества[4]. В качестве иллюстрации можно привести молекулу воды H2O, углы между связями в которой составляют примерно 104,5°, что придаёт ей характерную V-образную форму и определяет её полярность и способность к образованию водородных связей. Основываясь на структурной формуле воды, можно объяснить строение кристаллов льда и гидратных оболочек ионов[4].
Углы между связями в молекулах определяются гибридизацией атомных орбиталей и могут варьироваться в зависимости от типа атомов и их окружения. В органической химии, например, углы между связями в молекулах алканов таких, как метан (CH₄), составляют около 109,5°, что соответствует тетраэдрической геометрии. Эта симметричная структура объясняет равномерное распределение заряда и низкую реакционную активность метана[5].
Различие изомеров
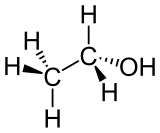
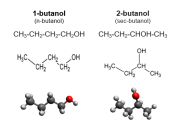
Для соединений, имеющих одинаковую химическую формулу, но различающихся по своей структуре, структурные формулы служат визуальным представлением этих различий. С помощью структурной формулы можно легко отличить один изомер от другого и объяснить особенности их свойств. Например: диметиловый эфир и этиловый спирт имеют одинаковый состав (C2H6O), но разное строение и свойства. Диметиловый эфир имеет химическую формулу CH3OCH3 и состоит из двух метиловых групп (CH3), связанных через кислородный атом (O). Этанол имеет химическую формулу CH3CH2OH и состоит из этиловой группы (C2H5-), связанной с гидроксильной группой (OH)[6].
Физические свойства этих соединений также различаются. Диметиловый эфир при комнатной температуре находится в газообразном состоянии, его температура кипения составляет −24.9 °C, а температура плавления составляет −141 °C. Этанол, напротив, является жидкостью при комнатной температуре с температурой кипения 78,4 °C и температурой плавления −114.1 °C. Химические свойства диметилового эфира и этанола также различаются. Диметиловый эфир менее реакционноспособен по сравнению с этанолом и используется в качестве пропеллента в аэрозолях, растворителя и топлива. Этанол более реакционноспособен и может участвовать в реакциях этерификации, окисления и дегидратации. Он широко используется в пищевой промышленности для производства алкогольных напитков, в медицине как антисептик, в промышленности как растворитель и в качестве биотоплива[6].
Типы структурных формул
Существует два основных типа структурных формул: плоскостная (2D) и пространственная (3D)[2].
- Плоскостная (2D)[2]:
- Представляет молекулу в двух измерениях, показывая порядок связи атомов и углы между ними.
- Часто используется для простоты представления, хотя она может не полностью отображать реальную трёхмерную структуру.
- Пространственная (3D)[2]:
- Более точно передаёт реальное положение атомов в пространстве, включая все три измерения.
- Применяется там, где важны точные сведения о пространственной конфигурации молекулы, например, при изучении биологической активности веществ[2].
Виды структурных формул
Структурные формулы органических веществ могут быть представлены в различных формах. Каждая форма имеет свои особенности и области применения. Имеется три основных типа структурных формул.
Развернутая структурная формула
Развёрнутая структурная формула представляет собой подробное изображение всех атомов и связей между ними в органическом веществе. В этой форме формулы видны все связи углерода с водородом (C-H). Запись таких формул требует значительного времени[7].
Сокращённая структурная формула
Сокращённая структурная формула похожа на развёрнутую, но в ней скрыты связи атомов углерода с атомами водорода (C-H). Оставляются на виду только связи между атомами углерода и гетероатомами, такими как кислород, азот и другие[7].
Скелетная формула
Скелетная формула отображает строение молекулы ломанной линией, в которой каждый «уголок» и «окончание» являются атомами углерода. Атомы водорода не прописываются. Если в структуре вещества есть гетероатомы (кислород, азот и так далее), то они отображаются[7].
Каждый вид структурной формулы имеет свои преимущества и используется в зависимости от контекста и целей исследования. Развёрнутая формула предоставляет полное представление о молекуле, сокращённая формула упрощает запись, а скелетная формула делает акцент на основном каркасе молекулы, опуская детали[7].
Примечания
- ↑ Structural formula (S06061). IUPAC (24 февраля 2014). Дата обращения: 28 ноября 2024. Архивировано 4 июня 2024 года.
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 2,6 Михалюк Н. А. Структурная формула. Большая российская энциклопедия (3 ноября 2022). Дата обращения: 28 ноября 2024. Архивировано 15 июня 2024 года.
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 3,6 3,7 Зыкова М.В., Жолобова Г.А., Прищепова О.Ф. Органическая химия. Пространственное строение органических соединений: учебное пособие. — Томск: Сибирский государственный медицинский университет, 2016. — С. 4—6. — 86 с.
- ↑ 4,0 4,1 Мануйлов А. В., Родионов В. И. §3.6 Пространственная форма молекул.. Новосибирский государственный университет. Дата обращения: 30 ноября 2024.
- ↑ 2.3 Пространственная структура молекулТИ. Заочная физико-техническая школа (ЗФТШ) Московского физико-технического института (национального исследовательского университета) (МФТИ). Дата обращения: 30 ноября 2024.
- ↑ 6,0 6,1 Ерёмин В. В., Антипин Р. Л., Дроздов А. А., Карпова Е. В., Рыжова О. Н. Химия: углублённый курс подготовки к ЕГЭ. — М.: Эксмо, 2020. — С. 472—478. — 608 с. — ISBN 978-5-04-104070-3.
- ↑ 7,0 7,1 7,2 7,3 Виды формул органических веществ. Химия. База данных. Дата обращения: 30 ноября 2024.
Данная статья имеет статус «готовой». Это не говорит о качестве статьи, однако в ней уже в достаточной степени раскрыта основная тема. Если вы хотите улучшить статью — правьте смело! |




![{\displaystyle {\ce {CH3-CH3 + Cl2 ->[hv] CH3-CH2Cl + HCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/118728f69578f12b02dc0a636989f03b73de300d)