Сложное вещество
Сло́жное вещество́ — представляет собой химическое соединение, образованное двумя или более элементами, атомы которых связаны между собой посредством химических связей. Состав таких соединений традиционно выражается с помощью химических формул, а их структура может быть представлена посредством структурных формул. Большинство химических соединений подчиняется законам постоянства состава и кратных отношений. Однако существуют вещества с переменным составом[1].
Физико-химические свойства соединений существенно отличаются от характеристик исходных компонентов. Они обладают характерными параметрами, такими как плотность, температура плавления и кипения, растворимость и другие физические константы[1].
Соединения, обладающие одинаковым составом, но отличающиеся строением молекул, называются изомерами. Изомеры могут иметь различные физико-химические характеристики[1].
Все вещества классифицируются на две большие группы. Неорганические соединения — включают в себя все вещества, за исключением углеводородов и их производных. Органические соединения — состоят преимущественно из углерода и водорода, хотя могут включать в себя атомы других элементов, таких как кислород, азот, фосфор, сера и другие[1].
Закон постоянства состава
Закон постоянства состава является фундаментальным принципом в химии, утверждающим, что в каждом химическом соединении, вне зависимости от способа его получения, соотношение масс составляющих элементов остаётся постоянным. Закон сформулирован французским химиком Жозефом Луи Прустом в начале XIX века. Пруст привёл множество примеров, подтверждающих этот закон. Например, окись железа из южного и северного полушарий имеет одинаковый состав, киноварь из Японии и Испании также имеет идентичный состав, а хлористое серебро, полученное в Перу и Сибири, также обладает одинаковым составом[2]. Благодаря этому закону стало возможным представлять состав веществ посредством уже известных обозначений — символов химических элементов и числовых значений, отражающих соотношение атомов в веществе (индексов)[3].
Однако в начале XX века российский химик Николай Курнаков, основываясь на результатах физико-химического анализа различных сплавов, показал, что существуют соединения переменного состава, которые не подчиняются закону постоянства состава. Это открытие привело к тому, что закон постоянства состава утратил свой универсальный характер и теперь рассматривается как частный случай общих закономерностей, описывающих состав химических соединений[2].
Закон кратных отношений
Закон кратных отношений, сформулированный Джоном Дальтоном в 1808 году, представляет собой фундаментальный принцип химии, согласно которому массы элементов, сочетающихся с фиксированной массой другого элемента, находятся в отношении небольших целых чисел. Закон играет ключевую роль в понимании состава химических соединений[4].
Рассмотрено два примера: угарный газ (CO) и углекислый газ (CO2), образованные элементами углеродом (C) и кислородом (O). В угарном газе один атом углерода соединяется с одним атомом кислорода, а в углекислом газе один атом углерода соединяется с двумя атомами кислорода. Если взять фиксированную массу углерода, например, 12 граммов, то массы кислорода, сочетающиеся с этой массой углерода, будут[4]:
- Для угарного газа (CO): 16 граммов кислорода (1 моль кислорода).
- Для углекислого газа (CO2): 32 грамма кислорода (2 моля кислорода).
Соотношение масс кислорода в этих двух соединениях будет 16:32, что упрощается до 1:2. Это и есть пример кратных отношений, где массы кислорода относятся как небольшие целые числа (1 и 2)[4]. Закон кратных отношений подтверждает, что атомы соединяются в определённых пропорциях, и это открытие стало важным шагом в развитии атомно-молекулярного учения и химической стехиометрии[4].
Химическая формула
Химические формулы представляют собой ключевой инструмент в арсенале химиков, позволяющий точно описывать состав и строение веществ[4][5][6]. Химическая формула представляет собой способ изображения качественного и количественного состава вещества с помощью символов химических элементов, чисел и вспомогательных знаков (тире, точки, скобки и тому подобное). Она показывает, какие элементы входят в состав вещества, и в каком количестве. Химические формулы могут быть различных типов, в зависимости от уровня детализации и информации, которую они предоставляют[4][5][6].
Основные типы химических формул[4][5][6]:
Эмпирическая формула
Эмпирическая формула показывает простейшее соотношение атомов в соединении. Пример: оксид натрия имеет эмпирическую формулу Na₂O, так как соотношение количества атомов натрия к кислороду в ионном кристалле 2:1[4][5][6].
Молекулярная формула
Молекулярная формула показывает точное количество атомов каждого элемента в одной молекуле вещества. Пример: глюкоза (C₆H₁₂O₆) имеет молекулярную формулу, которая указывает на точное количество атомов углерода, водорода и кислорода в одной молекуле глюкозы[4][5][6].
Структурная формула
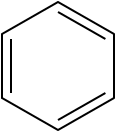
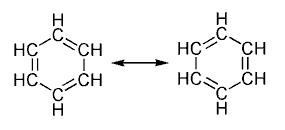
Структурная формула показывает, как атомы соединены друг с другом в молекуле, включая расположение двойных и тройных связей. Пример: структурная формула бензола (C₆H₆) показывает шестичленный углеродный цикл с чередующимися одинарными и двойными связями[4][5][6].
Конденсирован формула
Конденсированная формула показывает группы атомов, соединённых вместе, без изображения всех связей. Пример: конденсированная формула этанола показывает группы атомов, соединённые вместе. Гидроксогруппа (ОН) показана как связанная с группой СН2[4][5][6].
Скелетная формула
Скелетная формула чаще используется в органической химии и показывает углеродный каркас молекулы, где углеродные атомы и водородные атомы, связанные с ними, не всегда явно указываются. Пример: скелетная формула бензола (C₆H₆) изображается как шестичленный цикл с чередующимися одинарными и двойными связями, без явного указания атомов водорода[4][5][6].
Химические формулы являются важным инструментом в химии, так как они позволяют химикам быстро и точно передавать информацию о составе и структуре веществ[4][5][6].
Примечания
- ↑ 1,0 1,1 1,2 1,3 Раков Э. Г. Химические соединения. Большая российская энциклопедия (25 июля 2022). Дата обращения: 27 ноября 2024. Архивировано 15 июня 2024 года.
- ↑ 2,0 2,1 Трифонов Д. Н,. Закон постоянства состава. Большая российская энциклопедия (30 июня 2023). Дата обращения: 28 ноября 2024. Архивировано 15 июня 2024 года.
- ↑ Химия. Российская электронная школа. Дата обращения: 28 ноября 2024. Архивировано 5 октября 2022 года.
- ↑ 4,00 4,01 4,02 4,03 4,04 4,05 4,06 4,07 4,08 4,09 4,10 4,11 4,12 Ильин А. П. Lecture_1-2.pdf. Корпоративный портал ТПУ. Дата обращения: 28 ноября 2024. Архивировано 28 ноября 2024 года.
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 5,6 5,7 5,8 Раков Э. Г. Химические формулы. Большая российская энциклопедия (3 ноября 2022). Дата обращения: 28 ноября 2024. Архивировано 2 октября 2024 года.
- ↑ 6,0 6,1 6,2 6,3 6,4 6,5 6,6 6,7 6,8 Метельский А. В. Химические формулы. Энциклопедия MPlast.by (19 марта 2016). Дата обращения: 28 ноября 2024.
Данная статья имеет статус «готовой». Это не говорит о качестве статьи, однако в ней уже в достаточной степени раскрыта основная тема. Если вы хотите улучшить статью — правьте смело! |
Данная статья имеет статус «проверенной». Это говорит о том, что статья была проверена экспертом |