Электрохимия
| Наука | |
| Электрохимия | |
|---|---|
| англ. Electrochemistry | |
 | |
| Предмет изучения | подвижные ионы |
| Период зарождения | XX век |
| Основные направления | физическая химия, химия |
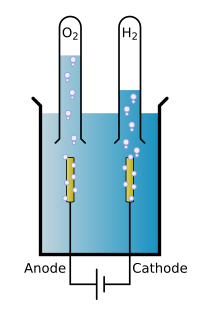
Электрохимия — раздел физической химии, предметом изучения которого являются объёмные и поверхностные свойства твёрдых и жидких тел, содержащих подвижные ионы, и механизмы процессов с участием ионов на границах раздела и в объёме тел. Практическое значение электрохимических процессов, их роль в живом организме, своеобразие экспериментальной техники привели к выделению электрохимии в самостоятельный раздел науки.
История развития электрохимии
В XVI век английский ученый Уильям Гильберт исследует магнетизм и, в некоторой степени, электричество. Его исследования оказали огромное влияние на развитие знаний о магнетизме и электричестве. Он стал известен как «Отец магнетизма». В 1663 году немецкий физик Отто фон Герике создаёт первый электрический генератор, который вырабатывал статическое электричество благодаря трению. Генератор представлял собой стеклянный шар с рукояткой, покрытый толстым слоем серы. Шар раскручивался вручную и при трении о подушечки пальцев, образовывалась электрическая искра. Заряженный шар использовали в экспериментах по электричеству. В середине XVIII века французский физик Шарль Франсуа Дюфе делает вывод о существовании двух видов статического электричества. Он высказывает мнение о том, что электричество состоит из двух флюидов — положительного и отрицательного. В противовес этой теории Бенджамин Франклин предполагает что статическое электричество состоит из одного «флюида», а заряд объясняется избытком или недостатком такого флюида. В 1781 году Шарль Огюстен Кулон излагает закон Кулона, описывающий взаимодействие заряженных тел[1][2].
В 1800 году Алессандро Вольта построил первый источник длительного постоянного тока (Вольтов столб). Вольта связывал возникновение электродвижущей силы с соприкосновением разнородных металлов. С помощью вольтова столба английские учёные Уильям Никольсон и Антоний Карлейль электролизом осуществили разложение воды на водород и кислород. В 1807 году английским учёным Гемфри Дэви электролизом увлажнённого едкого кали получил металлический калий, это было первое применение электрохимического метода для получения нового вещества. Начало работам по Электрохимии в России положил Василий Петров (электровосстановление металлов из их окислов, 1803). В 1833—1834 годах Майкл Фарадей установил важнейшие количеств, закономерности Электрохимии — Фарадея законы. Он же ввёл и вводит такие понятия как электрод, электролит, анод, катод, анион, катион. Фарадей показал, что генерирование электрической энергии гальваническим элементом всегда сопровождается химическим процессом. К тому же периоду относится открытие английским учёным Джоном Даниелом первого гальванического элемента и открытие Борисом Якоби гальванопластики — первого широко использованного метода прикладной электрохимии (гальванотехника)[1][2].
В 1884 году Сванте Август Аррениус публикует исследования гальванической проводимости электролитов, описывая что электролиты распадаются при растворении на положительные и отрицательные ионы. В 1886 году Поль-Луи-Туссен Эру и Чарльз Мартин Холл, одновременно и независимо, разрабатывают промышленный способ получения алюминия путём электролиза на основе законов Фарадея. В 1894 году Вильгельм Фридрих Оствальд завершает важные исследования электропроводности и электродиссоциации органических кислот. В 1888 году Вальтер Нернст развивает теорию электродвижущей силы первичного элемента, состоящего из двух электродов, разделённых раствором электролита. Он выводит уравнение, известное как Уравнение Нернста — уравнение зависимости электродвижущей силы и концентрации ионов. Возможность существования свободных ионов сделалась понятной после введения представления об энергии сольватации (для водных растворов — гидратации). На необходимость учёта такого химического взаимодействия указал впервые Иван Каблуков. Петер Дебай и немецкий учёный Эрих Хюккель нашли в 1923 году, что свойства разбавленных растворов сильных электролитов в растворителях с высокой диэлектрической проницаемостью могут быть количественно истолкованы в предположении их полной диссоциации при учёте электростатического взаимодействия между заряженными частицами. В дальнейшем разрабатывалась теория, применимая к более высоким концентрациям, изучались неводные растворы и расплавленные электролиты. Особое внимание в последние десятилетия уделяется твёрдым электролитам с высокой ионной проводимостью. При исследовании взаимодействия ионов между собой и с растворителем используются новые физические методы (химическая физика)[1][2].
Разделы электрохимии
Электрохимию разделяют на теоретическую, прикладную и отдельный раздел[3][1][2].:
- Теоретическая электрохимия, на основе законов, которым подчиняется поведение электрохимических цепей, позволяет сделать рациональный выбор системы и установить наиболее оптимальный режим работы источника тока или электролизера. Кроме того, электрохимия имеет фундаментальное общетеоретическое значение, поскольку рассматривает закономерности перехода электронов при протекании химических и электрохимических реакций. Делится на электрохимию гетерогенных систем и теорию электролитов:
- Электрохимия гетерогенных систем — изучает общие условия равновесия на заряженных границах раздела фаз, строение этих границ, механизм и кинетические закономерности пере хода заряженных частиц через межфазные границы (в этом случае иногда употребляют термин электродика). Которая в свою очередь делится на:
- Теория электролитов — занимается изучением как равновесных, так и неравновесных свойств гомогенных систем — электролитов (иногда этот раздел называют ионикой). В свою очередь делится на:
- Прикладная электрохимия, электрохимия имеет много практических применений. При помощи первичных гальванических элементов (элементов одноразового действия), соединенных в батареи, преобразуют химическую энергию в электрическую. Вторичные источники тока – аккумуляторы – запасают электрическую энергию. Топливные элементы — первичные источники тока, которые генерируют электричество благодаря непрерывной подаче реагирующих веществ (например, водорода и кислорода). Эти принципы лежат в основе портативных источников тока и аккумуляторов, применяющихся на космических станциях, в электромобилях и электронных приборах. На электрохимическом синтезе основано крупнотоннажное производство многих веществ. При электролизе рассола в хлор-щелочном процессе образуются хлор и щелочь, которые затем применяются для получения органических соединений и полимеров, а также в целлюлознобумажной промышленности. Электроэкстракцией получают важные в промышленном отношении металлы: алюминий, магний, литий, натрий и титан. Соответственно делится на:
На применении электрохимических процессов основан отдельный раздел аналитической химии — электрохимические методы анализа:
- Электрохимические методы анализа — группа методов количественного химического анализа, основанные на использовании электролиза. Разновидностями метода являются электрогравиметрический анализ (электроанализ), внутренний электролиз, контактный обмен металлов (цементация), полярографический анализ, кулонометрия и др. В частности, электрогравиметрический анализ основан на взвешивании вещества, выделяющемся на одном из электродов. Метод позволяет не только проводить количественные определения меди, никеля, свинца и другие, но и разделять смеси веществ. Кроме того, к электрохимическим методам анализа относят методы, основанные на измерении электропроводности (кондуктометрия) или потенциала электрода (потенциометрия). Некоторые электрохимические методы применяются для нахождения конечной точки титрования (амперометрическое титрование, кондуктометрическое титрование, потенциометрическое титрование, кулонометрическое титрование) Делятся на прямые и косвенные методы:
- Прямые методы — это методы, основанные на использовании функциональной зависимости измеряемого параметра от концентрации определяемого вещества:
- Косвенные методы — это методы, в которых Е (I,R,Q) измеряют с целью нахождения конечной точки титрования определяемого вещества подходящим титрантом:
Практическое значение электрохимии
Электрохимические методы широко используются в различных отраслях промышленности. В химической промышленности это электролиз — важнейший метод производства хлора и щелочей, многочисленных окислителей, получение фтора и фторорганических соединений. Возрастающее значение приобретает электросинтез самых различных химических соединений. На электрохимических методах основано получение алюминия, магния, натрия, лития, бериллия, тантала, титана, цинка, рафинирование меди (электрометаллургия). Водород получают электролизом воды в относительно ограниченных масштабах, однако по мере использования запасов природного топлива и увеличения производства электроэнергии значение этого метода получения водорода будет возрастать. В различных отраслях техники применяются защитные и декоративные гальванические покрытия, а также гальванические покрытия с заданными оптическими, механическими и магнитными свойствами. Анодное растворение металлов успешно заменяет механическую обработку твёрдых и сверхтвёрдых металлов и сплавов. В технике всё шире применяются электрохимические преобразователи информации (хемотроника). Большое значение имеет скорейшее решение проблемы электромобиля. Быстро растущий спрос на автономные источники электроэнергии для техники, освоения космоса и бытовых применений стимулирует поиски новых электрохимических систем повышенной удельной мощности, энергоёмкости и сохранности. Всё более широкое распространение получают различные Электрохимические методы анализа, электрофизические и электрохимические методы обработки. Понимание важнейших биологических процессов, например усвоения и использования энергии пищи, распространения нервного импульса, восприятия зрительного образа, невозможно без учёта электрохимических звеньев, связанных в первую очередь с функционированием биологических мембран. Решение этих проблем ставит перед теоретической электрохимией новые задачи, а в будущем должно оказать существенное влияние и на медицинскую практику[2].
Примечания
- ↑ 1,0 1,1 1,2 1,3 Электрохимия / И. Корыта, И. Дворжак, В. Богачкова ; Пер. с чеш. канд. хим. наук А.Б. Эршлера ; Под ред. проф., д-ра техн. наук В.С. Багоцкого. — Москва : Мир, 1977. — 472 с.
- ↑ 2,0 2,1 2,2 2,3 2,4 Электрохимия / Большая советская энциклопедия // Глав. ред. А. М. Прохоров. — 3-е изд. — Москва : Сов. энциклопедия, Т. 30: Экслибрис-ЯЯ. — 1978. — 631 с.
- ↑ Электрохимия // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Литература
- Электрохимия / Большая Российская энциклопедия // научно-редакционный совет: председатель - Ю. С. Осипов и др. — Москва : Большая Российская энциклопедия, Т.35: Шервуд - Яя. — 2017. — 798 с. — ISBN 978-5-85270-373-6
- Электрохимия / Большая советская энциклопедия // Глав. ред. А. М. Прохоров. — 3-е изд. — Москва : Сов. энциклопедия, Т. 30: Экслибрис-ЯЯ. — 1978. — 631 с.
- Электрохимия // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Данная статья имеет статус «готовой». Это не говорит о качестве статьи, однако в ней уже в достаточной степени раскрыта основная тема. Если вы хотите улучшить статью — правьте смело! |
Данная статья имеет статус «проверенной». Это говорит о том, что статья была проверена экспертом |


