Физическая химия
| Наука | |
| Физическая химия (от др.-греч. φύσις — природа и λόγος — слово) | |
|---|---|
| Физхимия | |
 | |
| Предмет изучения | изучение макроскопических, атомных, субатомных и дисперсных явлений в химических системах с точки зрения законов и концепций физики |
| Основные направления | физика, химия |
Физическая химия — наука объясняющий химические явления и устанавливающая их закономерности на основе общих принципов физики; изучает взаимосвязи химических и физических явлений в природе.
История
Название науки Физическая химия, её предмет и задачи были впервые сформулированы Михаилом Ломоносовым, который с 1752 года в Московском университете читал курс «Введение в истинную физическую химию». Им был установлен один из основных законов, на котором базируется Физическая химия, — закон постоянства массы при химических превращениях. В 1755 году Ломоносов писал в письме Леонарду Эйлеру:
Все встречающиеся в природе изменения происходят так, что если к чему-либо нечто прибавилось, то это отнимается у чего-то другого. Так, сколько материи прибавляется к какому-либо телу, столько же теряется у другого, сколько часов я затрачиваю на сон, столько же отнимаю от бодрствования[1]
В 1840 году Германом Гессом был открыт закон постоянства сумм тепла при химических превращениях, также явившийся одним из фундаментальных законов Физической химии. Существенный вклад в развитие Физической химии в середине XIX века был внесён Пьером Бертло и Хансом Томсеном благодаря их фундаментальным термохимическим исследованиям, введению представлений о теплотах реакции как мере химического сродства реагирующих веществ, установлению связи между теплотами образования и составом веществ. Первую кафедру Физической химии организовал в 1887 году в Лейпцигском университете Вильгельм Оствальд, он же основал первый физико-химический журнал[2][3].
Выделение Физической химии в самостоятельную отрасль науки произошло лишь в конце XIX века. Этому способствовал общий рост разнообразных химических производств и создание химической промышленности, выдвинувшей множество проблем, для успешного разрешения которых было недостаточно эмпирических правил и знания качественных соотношений. Для развития Физической химии во второй половине XIX и начале XX века характерно применение главным образом термодинамических методов, изучение макроскопических, то есть непосредственно наблюдаемых, характеристик систем и процессов, использование представлений классической физики и классической теории химического строения при исследовании связи свойств и строения молекул. Окончательно устанавливается уравнение состояния для идеальных газов. Разрабатываются приложения термодинамики к химическим и фазовым равновесиям, основы макроскопической («формальной») кинетики, вводится представление об энергии активации реакций. Получают дальнейшее развитие представления о катализе, ведущие своё начало от Майкла Фарадея. Устанавливаются основные законы адсорбции. Развивается термодинамическая теория разбавленных растворов. Создаётся теория электролитической диссоциации. Для гальванических элементов вводится понятие электродных потенциалов. Результаты исследований, достигнутые на этом этапе развития Физической химии, внедряются в промышленность (синтез аммиака, разработка соляных месторождений, некоторые металлургические процессы, перегонка, ректификация)[2][3].
Крупнейшие открытия естествознания в конце XIX и начале XX века — открытие рентгеновских лучей, электрона, явления радиоактивности, развитие спектроскопии — создали предпосылки для нового этапа Физической химии. Установление законов движения электронов в атомах и молекулах (законов квантовой механики) привело к возникновению квантовой химии, что создало принципиально новые возможности теоретической трактовки химической связи, валентности, строения химических соединений[2][3].
Главная особенность современной Физической химии, начало которой относят к 20-м годам XX века, — широкое применение разнообразных физических методов экспериментального исследования, стремление выяснить детальный молекулярный механизм химических реакций. Физическая химия даёт теоретические основы для исследований как в областях неорганической, органической и аналитической химии, так и в разработке химической технологии. В 50–70-х годах наблюдается быстрое развитие многих разделов Физической химии и зарождение новых направлений, связанных с детальным изучением поведения молекул, ионов, радикалов при различных химических и физических процессах, в том числе под влиянием мощных энергетических воздействий (γ-излучение, потоки частиц больших энергий, лазерное излучение). Исследуются энергии диссоциации, ионизации и фотоионизации. Успешно изучаются реакции в электрических разрядах, процессы в низкотемпературной плазме (плазмохимия), влияние поверхностных явлений на свойства твёрдых тел (физико-химическая механика), развиваются физическая химия полимеров, электрохимия газов[2][3].
Предмет физической химии
Основными предметами изучения Физической химии являются строение атомов и молекул, природа химических связей, химическое равновесие и кинетика, катализ, теория газов, жидкостей и растворов, структура и химические свойства кристаллов и полимеров, термодинамика и тепловые эффекты химических реакций (термохимия), поверхностные явления (поверхностное натяжение), свойства рецепторов электролитов, электродные процессы (электроды) и электродвижущие силы, коррозия металлов, фотохимические и радиационные процессы[4][5]. Большинство теорий Физической химии базируется на законах статики, квантовой (волновой) механики и термодинамики. При изучении поставленных проблем в Физической химии широко применяют различные сочетания экспериментальных методов физики и химии, так называемые физико-химические методы анализа, основы которырых были разработаны в 1900—1915 годах[4][5].
Разделы физической химии
Главными разделами Физической химии являются:
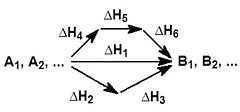
- Химическая термодинамика — раздел изучающий процессы взаимодействия веществ методами термодинамики. Применение термодинамического подхода к химическим реакциям основано на том, что в фундаментальном уравнении Гиббса в качестве переменных можно использовать как массы или количества независимых компонентов, — если условия задачи не требуют детального рассмотрения химического равновесия, — так и массы (количества) составляющих веществ совместно с уравнениями связи, описывающими химические реакции, — когда требуется подробное описание химического равновесия[6].
- Химическая кинетика — раздел изучающий закономерности протекания химических реакций во времени, зависимости этих закономерностей от внешних условий, а также механизмы химических превращений.
- Учения о Катализе — избирательное ускорение одного из возможных термодинамически разрешённых направлений химической реакции под действием катализатора(ов), который, согласно теории промежуточных соединений, многократно вступает в промежуточное химическое взаимодействие с участниками реакции и восстанавливает свой химический состав после каждого цикла промежуточных химических взаимодействий.
- Поверхностные явления — совокупность явлений, обусловленных особыми свойствами тонких слоёв вещества на границе соприкосновения фаз. К поверхностным явлениям относятся процессы, происходящие на границе раздела фаз, в межфазном поверхностном слое и возникающие в результате взаимодействия сопряжённых фаз.
- Раствор — однородная (гомогенная) система, в состав которой входят молекулы (атомы, ионы) двух или более типов, причём доля частиц каждого типа может непрерывно меняться в определённых пределах.
- Квантовая химия — направление рассматривающее строение и свойства химических соединений, реакционную способность, кинетику и механизм химических реакций на основе квантовой механики.
Физическая химия в качестве своих, в значительной мере самостоятельных, разделов включает также:
- Коллоидная химия — наука о дисперсных системах и поверхностных явлениях, возникающих на границе раздела фаз. Изучает адгезию, адсорбцию, смачивание, коагуляцию, электро-поверхностные явления в дисперсных системах.
- Электрохимия — раздел химической науки, в котором рассматриваются системы и межфазные границы при протекании через них электрического тока, исследуются процессы в проводниках, на электродах (из металлов или полупроводников, включая графит) и в ионных проводниках (электролитах). Электрохимия исследует процессы окисления и восстановления, протекающие на пространственно-разделённых электродах, перенос ионов и электронов.
- Фотохимия — раздел который изучает превращения химических веществ (химия возбужденных состояний молекул, фотохимические реакции), протекающие под действием электромагнитного излучения в ультрафиолетовом, видимом и ближнем инфракрасном диапазонах.
- Кристаллохимия — наука о кристаллических структурах и их связи с природой вещества. Кристаллохимия изучает пространственное расположение и химическую связь атомов в кристаллах, а также зависимость физических и химических свойств кристаллических веществ от их строения.
- Радиационная химия — изучает химические процессы, вызываемые воздействием ионизирующих излучений на вещество.
- Физико-химический анализ — комплекс методов анализа физико-химических систем путём построения и геометрического анализа диаграмм состояния и диаграмм состав-свойство[2][5].
Физико-химические методы
К наиболее распространенным физико-химическим методам относятся:
- Электронный парамагнитный резонанс
- Ядерный магнитный резонанс
- Масс-спектрометрия
- Ядерный гамма-резонанс
- Радиоспектроскопия
- Спектрофотометрия
- Флюориметрия
- Рентгеноструктурный анализ
- Электронная микроскопия
- Ультрацентрифугирование
- Хроматография
- Электрофорез
- Изоэлектрическое фокусирование
- Полярография
- Потенциометрия
- Кондуктометрия
- Осмометрия
- Эбуллиометрия[4].
Научные учреждения
Научную работу по Физической химии в Советском Союзе и России проводят:
- Институт физической химии и электрохимии имени А. Н. Фрумкина РАН,
- Институт общей и неорганической химии имени Н. С. Курнакова РАН,
- Институт химической физики имени Н. Н. Семёнова РАН[2].
Галерея
- Основоположники физической химии
Михаил Ломоносов (1711—1765)
Герман Гесс (1802—1850)
Пьер Бертло (1827—1907)
Ханс Томсен (1826—1909)
Примечания
- ↑ Избранные философские произведения / М. В. Ломоносов ; под общ. ред. и с предисл. Г. С. Васецкого ; Московский гос. ун-т им. М. В. Ломоносова, Каф. истории русской философии. — Москва : Госполитиздат, 1950. — 759 с. — С.155-163
- ↑ 2,0 2,1 2,2 2,3 2,4 2,5 Физическая химия / Большая советская энциклопедия // Глав. ред. А. М. Прохоров. — 3-е изд. — Москва : Сов. энциклопедия, Т. 27: Ульяновск-Франкфорт. — 1977. — 622 с.
- ↑ 3,0 3,1 3,2 3,3 Очерки по истории физической химии / Акад. наук СССР. Ин-т истории естествознания и техники. — Москва : Наука, 1964. — 342 с
- ↑ 4,0 4,1 4,2 Физическая химия / Большая медицинская энциклопедия // гл. ред. акад. Б. В. Петровский ; [Акад. мед. наук СССР]. — 3-е изд. — Москва : Сов. энциклопедия, Т. 26: Углекислые воды - Хлор. — 1985. — 560 с
- ↑ 5,0 5,1 5,2 Курс физической химии. — 3-е изд., перераб. и доп. — Москва : Химия, 1975. — 775 с.
- ↑ Термодинамика / АН СССР. Моск. о-во испытателей природы. Секция физики. — Москва : Наука, 1971. — 375 с
Литература
- Физическая химия / Большая Российская энциклопедия // научно-редакционный совет: председатель - Ю. С. Осипов и др. — Москва : Большая Российская энциклопедия, Т. 33: Уланд - Хватцев. — 2017. — 798 с. — ISBN 978-5-85270-370-5
- Физическая химия / Большая советская энциклопедия // Глав. ред. А. М. Прохоров. — 3-е изд. — Москва : Сов. энциклопедия, Т. 27: Ульяновск-Франкфорт. — 1977. — 622 с.
- Физическая химия / Большая медицинская энциклопедия // гл. ред. акад. Б. В. Петровский ; [Акад. мед. наук СССР]. — 3-е изд. — Москва : Сов. энциклопедия, Т. 26: Углекислые воды - Хлор. — 1985. — 560 с.
- Курс физической химии. — 3-е изд., перераб. и доп. — Москва : Химия, 1975. — 775 с.
Данная статья имеет статус «готовой». Это не говорит о качестве статьи, однако в ней уже в достаточной степени раскрыта основная тема. Если вы хотите улучшить статью — правьте смело! |
Данная статья имеет статус «проверенной». Это говорит о том, что статья была проверена экспертом |