Опухоль
О́пухоль (др.-греч. -ομα, лат. tumor) — неоплазия, новообразование, представляет собой патологический процесс, характеризующийся новообразованной тканью, в которой изменения генетического аппарата клеток приводят к нарушению регуляции их роста и дифференцировки[1]. Опухолевые образования отличаются неконтролируемым ростом, который продолжается даже после устранения первоначального воздействия. Опухолевые процессы затрагивают все живые организмы и представляют одну из наиболее серьёзных медицинских проблем современности.
Происхождение терминов
Медицинская терминология, описывающая новообразования, имеет древние корни. Слово «рак» берёт начало от древнегреческого καρκίνος, что означает «краб» и «опухоль»[2]. Такое наименование возникло благодаря внешнему сходству злокачественных образований с этими членистоногими — разветвлённые кровеносные сосуды вокруг опухоли напоминали клешни и лапки краба.
Термин «неоплазма» составлен из греческих элементов neo (новый) и plasma (сформированный, созданный), что точно отражает суть процесса — образование новых, аномальных тканевых структур. В англоязычной медицинской практике используется написание tumor, тогда как в странах британского содружества принято tumour. Римский врач Цельс в первом веке нашей эры описал четыре основных признака воспаления: tumor (опухание), dolor (боль), calor (жар) и rubor (покраснение).
Основные характеристики
Свойства опухолевых процессов
Опухолевые образования обладают пятью классическими характеристиками: атипизмом (как тканевым, так и клеточным), органоидностью строения, способностью к прогрессии, относительной автономностью функционирования и неограниченным ростом[3]. Эти свойства отличают истинные опухоли от других патологических процессов, таких как воспалительные реакции или регенеративные изменения.
Тканевый атипизм проявляется в нарушении пространственных и количественных соотношений между компонентами ткани. Клеточный атипизм характеризуется изменениями морфологии клеток: увеличением ядер, изменением соотношения ядра и цитоплазмы, появлением аномальных митозов. Органоидность строения означает, что опухоль частично сохраняет структурные особенности той ткани, из которой она происходит.
Современная онкология выделяет шесть ключевых признаков злокачественных опухолей: способность к росту и делению без соответствующих сигналов; продолжение размножения даже при наличии ингибирующих факторов; избегание запрограммированной клеточной смерти; неограниченное количество клеточных делений; стимулирование образования кровеносных сосудов; способность к инвазии тканей с формированием метастазов.
Молекулярные основы
Каждая клетка человеческого организма ежедневно подвергается более чем 10 000 повреждений ДНК[4], что является естественным следствием клеточного метаболизма и воздействия факторов окружающей среды. В норме специальные системы репарации эффективно устраняют эти повреждения, однако при их недостаточности накапливаются мутации, которые могут привести к опухолевой трансформации.
Система антибластомной резистентности включает ферменты репарации ДНК, антионкогены и NK-клетки (естественные киллерные клетки). Недостаточность этой системы может возникать при интенсивном канцерогенном воздействии, иммунодефицитных состояниях, врождённых дефектах ферментов репарации ДНК или рубцовом уплотнении ткани.
Приблизительно 70 % злокачественных новообразований развиваются спонтанно, без видимой наследственной предрасположенности[5]. Эти «спорадические» формы рака обычно возникают вследствие накопления генетических и эпигенетических изменений в течение жизни человека. Ключевую роль в канцерогенезе играют онкогены, способствующие клеточному росту, и гены-супрессоры опухолей, в норме предотвращающие неконтролируемое деление.
Процесс малигнизации включает этап инициации, когда происходит соматическая мутация и в геноме клеток появляются онкогены, и этап промоции, когда начинается размножение изменённых клеток. Типичным примером клеточного онкогена является ген белка p53, мутация которого приводит к образованию онкогена.
Классификация
Морфологические типы
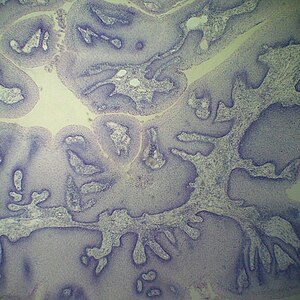
Доброкачественные опухоли характеризуются медленным экспансивным ростом, чёткими границами и отсутствием способности к метастазированию. Типичными примерами служат миомы матки, остеофиты и меланоцитарные невусы. При значительных размерах миомы возможно механическое воздействие на соседние органы с нарушением их функций, а вероятность рецидива после хирургического удаления достигает 30 %[6].
Для доброкачественных опухолей характерны следующие особенности: клетки сохраняют высокую степень дифференцировки, позволяющую определить ткань происхождения; рост происходит путём равномерного увеличения массы; отсутствует инвазия в окружающие ткани; не оказывают общего воздействия на организм. Однако некоторые доброкачественные опухоли могут проявлять признаки агрессивности, включая быстрый рост в различных направлениях, и способны к малигнизации под воздействием канцерогенов, ионизирующего излучения или механической травмы.
Потенциально злокачественные образования, включающие карциному in situ, занимают промежуточное положение. Они остаются локализованными и не проникают в окружающие ткани, однако со временем могут трансформироваться в инвазивные формы рака. К этой категории относятся также различные степени интраэпителиальной неоплазии.
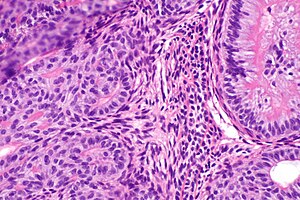
Злокачественные опухоли отличаются агрессивным инфильтрирующим ростом, способностью к метастазированию и общим негативным воздействием на организм. Они состоят из умеренно-, мало- и недифференцированных клеток, которые могут утратить сходство с тканью происхождения. Процесс их развития включает четыре основные стадии: первичную малигнизацию; формирование предынвазивной опухоли; инвазию окружающих тканей; метастазирование.
Для злокачественных опухолей характерны как клеточный атипизм (изменение базальной мембраны, нарушение соотношения объёмов цитоплазмы и ядра, увеличение числа митозов), так и тканевой атипизм (нарушение соотношений между стромой и паренхимой, сосудами и стромой).
Классификация по происхождению
Современная классификация основывается на происхождении опухолевых клеток и включает несколько основных групп[7]. Эпителиальные опухоли делятся на органонеспецифические и органоспецифические, включающие новообразования экзо- и эндокринных желёз.
- Карциномы развиваются из эпителиальных тканей и составляют большинство злокачественных новообразований внутренних органов. Среди них выделяют аденокарциномы, происходящие из железистого эпителия, которые наиболее часто встречаются в молочной железе, простате, лёгких, поджелудочной железе и толстой кишке.
- Саркомы происходят из соединительнотканных элементов, включая кости, хрящи, мышцы и жировую ткань. К мезенхимальным опухолям относятся также миосаркомы, развивающиеся из мышечной ткани.
- Лимфомы и лейкемии формируются из кроветворных клеток и характеризуются особенностями распространения через кровеносную и лимфатическую системы. Гемобластозы представляют опухоли системы крови с различными клиническими проявлениями.
Отдельные группы составляют опухоли из меланинобразующей ткани, новообразования нервной системы и оболочек мозга, а также тератомы, возникающие в результате нарушений развития с дифференцировкой двух или трёх зародышевых листков.
Для точной характеристики распространённости заболевания используется международная система TNM, где T обозначает характеристики первичной опухоли, N — состояние регионарных лимфатических узлов, M — наличие или отсутствие отдалённых метастазов. Дополнительно применяются параметры P (степень прорастания стенки полых органов) и G (степень дифференцировки клеток).
Механизмы роста и распространения
Типы роста
Неопластические образования демонстрируют три основных варианта роста. Экспансивный рост характеризуется равномерным увеличением объёма с оттеснением окружающих структур, что типично для доброкачественных опухолей. Инфильтрирующий рост предполагает проникновение опухолевых клеток в соседние ткани с их разрушением — характерная особенность злокачественных процессов. Аппозиционный рост происходит за счёт неопластической трансформации клеток окружающих тканей.
Сосудистые новообразования, включая гемангиомы и лимфангиомы, формируются из элементов кровеносной или лимфатической системы. Они имеют особенности строения, связанные с их происхождением[8].
Метастазирование
Распространение опухолевых клеток за пределы первичного очага происходит пятью основными путями. Гематогенный путь предполагает перенос через кровеносную систему, лимфогенный — через лимфатические сосуды. Имплантационное метастазирование происходит при непосредственном контакте с серозными оболочками, интраканикулярное — по естественным анатомическим пространствам, а периневральное — вдоль нервных стволов[8].
Способность к метастазированию представляет ключевое отличие злокачественных новообразований, поскольку именно отдалённые очаги часто определяют прогноз заболевания. Различные типы опухолей демонстрируют предпочтительные органы-мишени для метастазирования, что связано с особенностями взаимодействия опухолевых клеток с микроокружением различных тканей.
Причины возникновения
Внешние факторы
Образ жизни и воздействие окружающей среды определяют приблизительно 33 % всех смертей от злокачественных новообразований[9]. Ключевые факторы риска включают курение табака, злоупотребление алкоголем, избыточную массу тела, недостаточное потребление фруктов и овощей, а также низкую физическую активность.
Табакокурение остаётся ведущей предотвратимой причиной рака, вызывая 90 % случаев рака лёгких[10]. Табачный дым содержит более пятидесяти установленных канцерогенов, включая нитрозамины и полициклические ароматические углеводороды, которые вызывают повреждения ДНК и способствуют накоплению мутаций.
Алкоголь повышает вероятность развития новообразований молочной железы, горла, печени, пищевода, ротовой полости, гортани и толстой кишки. В странах Западной Европы 10 % случаев рака у мужчин и 3 % у женщин связаны с употреблением спиртных напитков[11].
Инфекционные агенты
Инфекционные заболевания обуславливают приблизительно 18 % смертей от злокачественных новообразований в мире[12]. Различные патогены способствуют канцерогенезу через разные механизмы: прямое повреждение ДНК, хроническое воспаление или нарушение иммунного надзора.
Вирусно-генетическая теория отводит решающую роль онкогенным вирусам, включая вирус Эпштейна-Барр (лимфома Беркитта), папилломавирусы (рак шейки матки), ретровирусы (хронический лимфолейкоз), вирусы гепатитов B и C (рак печени). Интеграция генома вируса с генетическим аппаратом клетки может привести к опухолевой трансформации.
Физические воздействия
Ультрафиолетовое излучение солнца вызывает специфические повреждения ДНК, играющие критическую роль в развитии меланомы[13] и других форм рака кожи. Ионизирующая радиация также повышает онкологический риск, причём дети демонстрируют в два раза большую чувствительность к радиационно-индуцированному лейкозу по сравнению с взрослыми.
Асбестовые волокна вызывают мезотелиому — злокачественное поражение серозных оболочек, чаще всего плевры. Длительный контакт с промышленными химикатами, включая PFOA (используемую в производстве тефлона), также ассоциирован с повышенным онкологическим риском.
Генетические аспекты
Наследственная предрасположенность
Наследственные генетические дефекты обуславливают 5-10 % всех злокачественных новообразований[14]. Носителями мутаций с выраженным влиянием на онкологический риск являются менее 0,3 % населения, однако для них вероятность развития рака может достигать 75 % и выше. Мутации генов BRCA1 и BRCA2 ассоциированы с повышенным риском рака молочной железы и яичников, превышающим 75 %. Филадельфийская хромосома — результат транслокации между 9-й и 22-й хромосомами — характерна для хронического миелогенного лейкоза и служит примером специфических хромосомных нарушений в онкологии.
Полевые дефекты и морфогенез
Концепция «полевых дефектов» описывает области внешне нормальной ткани, содержащие множественные генетические и эпигенетические изменения[15]. Эти зоны служат предшественниками злокачественных новообразований и объясняют феномен мультицентрического роста опухолей.
Термин «канцеризация поля» впервые использован в 1953 году для описания предрасположенных к малигнизации участков эпителия. Современные исследования показывают, что более 80 % соматических мутаций в опухолях толстой кишки накапливаются ещё до начала финальной клональной экспансии, подтверждая значимость предопухолевых изменений.
Развитие злокачественной опухоли может происходить двумя путями. Развитие de novo представляет «скачкообразную» эволюцию без предшествующих видимых предопухолевых изменений. Стадийный онкогенез предполагает развитие опухоли на месте предопухолевых изменений, для обозначения которых в случае рака используется термин «предрак».
Выделяют две формы предрака. Облигатный предрак рано или поздно трансформируется в злокачественную опухоль (например, изменения кожи при пигментной ксеродерме). Факультативный предрак трансформируется в рак не во всех случаях (лейкоплакия, бронхит курильщиков, хронический атрофический гастрит).
Морфологическим выражением облигатного предрака является тяжёлая дисплазия клеток, наиболее детально изученная в случаях прекарциноматозных поражений категории «интраэпителиальной неоплазии III степени» наряду с карциномой in situ.
Геномная нестабильность
Опухоли характеризуются геномной нестабильностью или мутаторным фенотипом. Белок-кодирующая ДНК в ядре составляет около 1,5 % от общей геномной ДНК. Средний рак молочной железы или толстой кишки может иметь около 60-70 белок-изменяющих мутаций, из которых около 3-4 могут быть «драйверными» мутациями, а остальные — «пассажирскими»[15].
Среднее количество мутаций ДНК во всём геноме в образце ткани рака молочной железы составляет около 20 000, в то время как в образце меланомы общее количество мутаций достигает 80 000. Это контрастирует с очень низкой частотой мутаций около 70 новых мутаций во всём геноме между поколениями у здоровых людей.
Большие полевые дефекты вокруг раков толстой кишки простираются примерно на 10 см с каждой стороны от опухоли. Нарушения репарации ДНК вызывают увеличенные частоты мутаций, что может привести к формированию селективного преимущества и развитию полевого дефекта.
Эпидемиология
Глобальная картина
В 2015 году злокачественными новообразованиями в мире страдали около 90,5 миллионов человек[16]. К 2019 году ежегодная заболеваемость достигла 23,6 миллиона новых случаев при 10 миллионах смертей, что отражает как рост продолжительности жизни, так и изменения в образе жизни населения развивающихся стран.
Экономическое бремя онкологических заболеваний оценивается в 1,16 триллиона долларов США ежегодно по состоянию на 2010 год, включая как прямые медицинские расходы, так и непрямые потери от снижения трудоспособности и преждевременной смертности.
Возрастные и половые особенности
Риск развития злокачественных новообразований значительно возрастает с возрастом[17], что связано с накоплением генетических повреждений, снижением эффективности систем репарации ДНК и изменениями в иммунном надзоре. У детей наиболее частыми формами являются острый лимфобластный лейкоз и опухоли головного мозга.
Структура онкологической заболеваемости различается между полами. У мужчин преобладают рак лёгких, предстательной железы, колоректальный рак и рак желудка. У женщин чаще встречаются новообразования молочной железы, колоректальный рак, рак лёгких и шейки матки.
Пятилетняя выживаемость детей с онкологическими заболеваниями в развитых странах достигает 80 %. Общая пятилетняя выживаемость в США составляет 66 % для всех возрастных групп.
Влияние опухоли на организм
Опухоли оказывают как местное, так и общее воздействие на организм. Местное влияние заключается в сдавливании или разрушении окружающих тканей и органов в зависимости от типа роста. Конкретные проявления зависят от локализации опухоли — например, рак лёгкого может блокировать бронх, вызывая кашель или пневмонию.
Общее влияние на организм характерно для злокачественных опухолей и проявляется различными нарушениями метаболизма вплоть до развития кахексии. Синдром анорексии-кахексии у онкологических больных характеризуется отвращением к пище (особенно мясной), быстрой потерей массы тела и представляет защитную реакцию организма на агрессивный рост опухоли.
Некоторые системные симптомы рака вызываются гормонами или другими молекулами, продуцируемыми опухолью, что называется паранеопластическими синдромами. Общие паранеопластические синдромы включают гиперкальциемию и гипонатриемию[18].
Современные подходы к лечению
Основные методы лечения
Лечение опухолей базируется на комбинации хирургических, лекарственных и лучевых методов[19]. Выбор конкретных методов зависит от типа, локализации и стадии опухоли, а также общего состояния пациента.
Хирургическое лечение остаётся основным способом лечения локализованных солидных опухолей, обеспечивая возможность радикального удаления патологической ткани. Хирургия играет важную роль в диагностике через биопсию, определении стадии заболевания и паллиативном лечении. При локализованном раке хирургическое вмешательство часто включает удаление всей опухолевой массы вместе с региональными лимфатическими узлами.
Химиотерапия использует цитотоксические противоопухолевые препараты как часть стандартизированного режима лечения. Традиционные химиотерапевтические средства действуют путём уничтожения быстроделящихся клеток — критического свойства большинства опухолевых клеток. Комбинированная терапия несколькими препаратами показала преимущества в статистике выживаемости и ответе на лечение по сравнению с монотерапией.
Таргетная терапия представляет форму химиотерапии, нацеленную на специфические молекулярные различия между опухолевыми и нормальными клетками. Первые таргетные препараты блокировали эстрогеновые рецепторы, подавляя рост рака молочной железы. Ингибиторы Bcr-Abl используются для лечения хронического миелогенного лейкоза.
Лучевая терапия применяет ионизирующее излучение для повреждения ДНК опухолевых клеток, вызывая митотическую катастрофу и гибель раковых клеток. Для защиты нормальных тканей используются формированные лучевые пучки, направленные под разными углами и пересекающиеся в области опухоли. Излучение используется примерно в половине случаев лечения рака и может быть внутренним (брахитерапия) или внешним.
Иммунотерапия представляет революционное направление, использующее собственную иммунную систему пациента для борьбы с опухолью. Методы включают применение моноклональных антител, терапию блокаторами иммунных контрольных точек, адоптивный перенос клеток и CAR T-клеточную терапию.
Лазерная терапия использует высокоинтенсивный свет для уменьшения или разрушения опухолей. Лазеры наиболее часто применяются для лечения поверхностных раков кожи или слизистых оболочек внутренних органов. Лазерная интерстициальная термотерапия использует гипертермию для повреждения опухолевых клеток.
Паллиативная помощь
Паллиативная медицина направлена на улучшение качества жизни пациентов независимо от стадии заболевания и прогноза[20]. Этот подход включает контроль симптомов, психологическую поддержку и помощь в принятии медицинских решений.
Современная концепция предполагает раннее включение паллиативных мер в план лечения. Это улучшает не только качество жизни, но и может положительно влиять на продолжительность жизни пациентов с распространёнными формами рака.
Профилактика
Первичная профилактика
Предотвращение злокачественных новообразований основывается на устранении или снижении воздействия известных факторов риска[21]. Более 30 % смертей от рака можно предотвратить, избегая основных факторов риска.
Отказ от курения, ограничение употребления алкоголя, поддержание нормальной массы тела и регулярная физическая активность способны предотвратить значительную долю онкологических заболеваний. Связь между питанием, физической неактивностью, ожирением и 30-35 % смертей от рака[22] подчёркивает важность модификации образа жизни.
Некоторые лекарственные препараты могут использоваться для профилактики рака в определённых обстоятельствах. Аспирин снижает риск смерти от рака примерно на 7 %.
Вакцинация и скрининг
Вакцинация против вируса папилломы человека эффективно предотвращает рак шейки матки, а прививка от гепатита B снижает риск первичного рака печени. Эти меры представляют наиболее успешные примеры специфической профилактики онкологических заболеваний[23].
Программы скрининга направлены на выявление предраковых изменений или ранних стадий злокачественных новообразований у бессимптомных людей. Маммография для выявления рака молочной железы, цитологическое исследование шейки матки и колоноскопия для диагностики колоректального рака доказали свою эффективность в снижении смертности.
Литература
- Галицкий В. А. Канцерогенез и механизмы внутриклеточной передачи сигналов // Вопросы онкологии. — 2003.
- Давыдовский И. В. Общая патологическая анатомия. — М., 1969.
- Общая онкология / Под ред. Н. П. Напалкова. — Л., 1989.
- Пальцев М. А., Аничков Н. М. Патологическая анатомия. — М.: Медицина, 2007.
- Склянская Е. И. Аденома простаты. — М.: ГЭОТАР Медицина, 1999.
- Струков А. И., Серов В. В. Патологическая анатомия. — М.: Медицина, 1995.
- DeVita V. T., Lawrence T. S., Rosenberg S. A. Cancer: Principles and Practice of Oncology. — Wolters Kluwer, 2018.
- Holland-Frei Cancer Medicine. — Wiley, 2016.
- Mukherjee S. The Emperor of All Maladies: A Biography of Cancer. — Simon & Schuster, 2010.
- Weinberg R. A. The Biology of Cancer. — Garland Science, 2013.
Примечания
- ↑ Birbrair A, Zhang T, Wang ZM, Messi ML, Olson JD, Mintz A, Delbono O (July 2014). «Type-2 pericytes participate in normal and tumoral angiogenesis». Am. J. Physiol., Cell Physiol. 307 (1): C25-38. doi: 10.1152/ajpcell.00084.2014. PMC 4080181. PMID 24788248.
- ↑ Harper D. Cancer // Online Etymology Dictionary.
- ↑ Robbins S. L., Cotran R. S., Kumar V. Robbins. Pathologic Basis of Disease. — 9th ed. — Philadelphia: Elsevier Saunders, 2014. — С. 265–310.
- ↑ Ames BN, Shigenaga MK, Hagen TM (September 1993).«Oxidants, antioxidants, and the degenerative diseases of aging». Proc Natl Acad Sci U S A. 90 (17): 7915-22. Bibcode: 1993PNAS…90.7915A. doi: 10.1073/pnas.90.17.7915. PMC 47258. PMID 8367443.
- ↑ Lichtenstein P, Holm NV, Verkasalo PK, Iliadou A, Kaprio J, Koskenvuo M, Pukkala E, Skytthe A, Hemminki K (July 2000).«Environmental and heritable factors in the causation of cancer—analyses of cohorts of twins from Sweden, Denmark, and Finland». N. Engl. J. Med. 343 (2): 78-85. doi: 10.1056/NEJM200007133430201. PMID 10891514.
- ↑ Миома матки Архивная копия от 19 марта 2012 на Wayback Machine.
- ↑ Christopher D. M. Diagnostic Histopathology of Tumors. — Edition, 4. — Elsevier Health Sciences, 2013.
- ↑ 8,0 8,1 Enzinger F. M., Weiss S. W. Soft Tissue Tumors. — 6th ed.. — St. Louis: Mosby Elsevier. — С. 703–780.
- ↑ Anand P, Kunnumakkara AB, Sundaram C, Harikumar KB, Tharakan ST, Lai OS, et al. (September 2008).«Cancer is a preventable disease that requires major lifestyle changes». Pharmaceutical Research. 25 (9): 2097—116. doi: 10.1007/s11095-008-9661-9. PMC 2515569. PMID 18626751.
- ↑ Biesalski HK, Bueno de Mesquita B, Chesson A, Chytil F, Grimble R, Hermus RJ, et al. (1998).«European Consensus Statement on Lung Cancer: risk factors and prevention. Lung Cancer Panel». CA: A Cancer Journal for Clinicians. 48 (3): 167-76, discussion 164-66. doi: 10.3322/canjclin.48.3.167. PMID 9594919. S2CID 20891885.
- ↑ Schütze M, Boeing H, Pischon T, Rehm J, Kehoe T, Gmel G, et al. (April 2011). «Alcohol attributable burden of incidence of cancer in eight European countries based on results from prospective cohort study». BMJ. 342: d1584. doi: 10.1136/bmj.d1584. PMC 3072472. PMID 21474525.
- ↑ de Martel C, Georges D, Bray F, Ferlay J, Clifford GM (15 February 2020).«Global burden of cancer attributable to infections in 2018: a worldwide incidence analysis». The Lancet Global Health. 8 (2): e180 — e190. doi: 10.1016/S2214-109X(19)30488-7. PMID 31862245.
- ↑ Kanavy HE, Gerstenblith MR (December 2011). «Ultraviolet radiation and melanoma». Semin Cutan Med Surg. 30 (4): 222-8. doi:10.1016/j.sder.2011.08.003 (inactive 12 July 2025). PMID 22123420.
- ↑ «World Health Organization — IARC Monographs evaluate consumption of red meat and processed meat» (PDF). International Agency for Research on Cancer. Archived (PDF) from the original on 26 October 2015. Retrieved 26 October 2015.
- ↑ 15,0 15,1 Bernstein C., Bernstein H., Payne C. M. et al. Field defects in progression to gastrointestinal tract cancers. — Cancer Letters, 2008. — С. 1–10.
- ↑ GBD, et al. (Disease and Injury Incidence and Prevalence Collaborators) (8 October 2016).«Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990—2015: a systematic analysis for the Global Burden of Disease Study 2015». The Lancet. 388 (10053): 1545—1602. doi: 10.1016/S0140-6736(16)31678-6. PMC 5055577. PMID 27733282.
- ↑ Ward EM, Thun MJ, Hannan LM, Jemal A (September 2006). «Interpreting cancer trends». Annals of the New York Academy of Sciences. 1076 (1): 29-53. Bibcode: 2006NYASA1076…29W. doi: 10.1196/annals.1371.048. PMID 17119192. S2CID 1579801.
- ↑ Галицкий В. А. Канцерогенез и механизмы внутриклеточной передачи сигналов // Вопросы онкологии. — 2003.
- ↑ DeVita V. T., Lawrence T. S., Rosenberg S. A. Cancer: Principles and Practice of Oncology. — Philadelphia: Wolters Kluwer, 2018. — С. 150–195.
- ↑ Ferris F. D., Bruera E., Cherny N. et al. Palliative cancer care a decade later: accomplishments, the need, next steps // Journal of Clinical Oncology. — 2019. — Т. 27, № 18. — С. 3052–3058.
- ↑ Doll R., Peto R. The causes of cancer: quantitative estimates of avoidable risks of cancer in the United States today // Journal of the National Cancer Institute. — 1981. — Т. 66, № 6. — С. 1191–1308.
- ↑ Kushi LH, Doyle C, McCullough M, Rock CL, Demark-Wahnefried W, Bandera EV, et al. (2012).«American Cancer Society Guidelines on nutrition and physical activity for cancer prevention: reducing the risk of cancer with healthy food choices and physical activity». CA: A Cancer Journal for Clinicians. 62 (1): 30-67. doi: 10.3322/caac.20140. PMID 22237782.
- ↑ Общая онкология. / Под ред. Н. П. Напалкова. — Л., 1989.