Поджелудочная железа человека
Поджелу́дочная железа́ челове́ка (лат. páncreas) — орган пищеварительной системы, обладающий внешнесекреторной и внутрисекреторной функциями. Этот относительно небольшой орган массой 70-80 граммов[1] играет фундаментальную роль в поддержании жизнедеятельности организма, контролируя как процессы переваривания пищи, так и углеводный обмен.
Анатомическое строение и топография
Строение железы
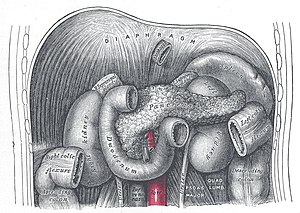
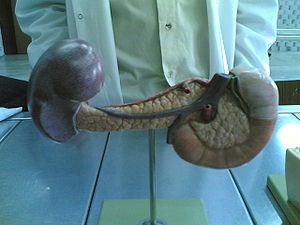
Железа имеет удлинённую дольчатую структуру серовато-розоватого оттенка, протяжённостью 14-22 сантиметра. Ширина варьирует от 3 до 9 сантиметров в области головки, при толщине 2-3 сантиметра[2]. Орган условно подразделяется на три анатомически различимые части.
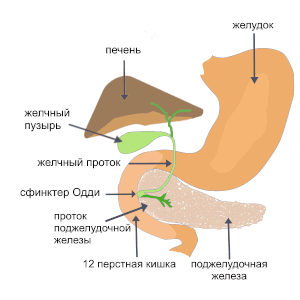
Головка располагается в изгибе двенадцатиперстной кишки, которая охватывает её подобно подкове. Проекция головки на позвоночный столб охватывает область от двенадцатого грудного до четвёртого поясничного позвонка. От головки отходит дополнительный проток, который, согласно исследованиям Маева И. В. и Кучерявого Ю. А., в 60 % случаев сливается с главным протоком, а в остальных случаях самостоятельно впадает в двенадцатиперстную кишку[3].
Тело железы характеризуется трёхгранной конфигурацией с тремя поверхностями и соответствующими краями. Передняя поверхность обращена к желудку и содержит сальниковый бугор. Задняя поверхность контактирует с жизненно важными структурами: позвоночником, аортой, нижней полой веной и почечными сосудами. Нижняя поверхность ориентирована книзу и кпереди.
Хвост имеет коническую или грушевидную форму, простираясь влево и вверх до селезёночных ворот. Положение хвоста варьирует от одиннадцатого грудного до второго поясничного позвонка.
Система каналов и трубочек
Главный вирсунгов проток, описанный в 1642 году, пронизывает всю длину органа и открывается в нисходящую часть двенадцатиперстной кишки через большой дуоденальный сосочек[4]. Система протоков образует древовидную структуру, начинающуюся от вставочных протоков в ацинусах и заканчивающуюся общим панкреатическим протоком.
Клеточное строение под микроскопом
Железа представляет собой сложную альвеолярно-трубчатую структуру, покрытую тонкой соединительнотканной капсулой. Основное вещество разделено на дольки соединительнотканными перегородками, содержащими протоки, сосуды и нервные элементы.
Ацинусы служат структурно-функциональными единицами экзокринной части. Каждый ацинус представляет округлое образование диаметром 100—150 микрометров, содержащее секреторный отдел с 8-12 экзокринными панкреатоцитами и начальную часть протоковой системы[5].
Островки Лангерганса составляют эндокринную часть железы. Эти компактные скопления клеток, пронизанные густой сетью фенестрированных капилляров, содержат пять типов эндокриноцитов, каждый из которых специализируется на выработке определённых гормонов.
Физиология пищеварительной функции
Пищеварительные ферменты и их роль
Экзокринная часть железы синтезирует мощный комплекс пищеварительных ферментов. Протеолитические ферменты трипсин и химотрипсин расщепляют белковые молекулы, панкреатическая липаза обеспечивает переваривание жиров, а амилаза разрушает сложные углеводы.
Критически важным механизмом защиты является синтез протеолитических ферментов в неактивной форме зимогенов. Трипсиноген и химотрипсиноген активируются только при контакте с энтерокиназой в просвете кишечника, что предотвращает самопереваривание железистой ткани[6].
Механизмы контроля пищеварительной секреции
Панкреатическая секреция контролируется сложной нейрогуморальной системой. Парасимпатическая иннервация через блуждающие нервы стимулирует базальную секрецию, а симпатические волокна из чревного сплетения модулируют этот процесс.
Гормональная регуляция осуществляется через секретин и холецистокинин, вырабатываемые энтероэндокринными клетками двенадцатиперстной кишки в ответ на поступление кислого химуса и питательных веществ. Секретин стимулирует выделение бикарбонатов для нейтрализации желудочной кислоты, а холецистокинин активирует секрецию ферментов[6].
Эндокринная система железы
Эндокринные клетки островков Лангерганса
Приблизительно миллион панкреатических островков общей массой около одного грамма рассеяны по всей паренхиме железы. Каждый островок представляет высокоорганизованную эндокринную единицу с характерным расположением клеток:
- Бета-клетки составляют около 75 % островковой ткани и локализуются в центральной части островков[7].
- Альфа-клетки располагаются преимущественно по периферии островков и производят глюкагон.
- Дельта-клетки секретируют соматостатин, который подавляет высвобождение как инсулина, так и глюкагона.
- D1-клетки вырабатывают вазоактивный интестинальный пептид (ВИП).
- PP-клетки продуцируют панкреатический полипептид, участвующий в регуляции пищеварения.
Гормональный контроль обмена веществ
Открытие инсулина в 1921 году стало революционным событием в медицине, спасшим жизни миллионов пациентов с сахарным диабетом[8]. Инсулин играет центральную роль в энергетическом гомеостазе, контролируя утилизацию глюкозы, аминокислот и жирных кислот.
После приёма пищи концентрация инсулина возрастает в 5-10 раз, стимулируя поглощение глюкозы печенью, мышечной и жировой тканями. Одновременно инсулин подавляет глюконеогенез и гликогенолиз в печени, а также тормозит липолиз в адипоцитах.
Глюкагон выполняет противоположные функции, активируя мобилизацию энергетических субстратов при голодании. Он стимулирует расщепление гликогена и образование глюкозы из неуглеводных предшественников в печени.
Метаболические состояния организма
Период после приёма пищи
В течение нескольких часов после еды организм находится в анаболическом состоянии. Повышенная секреция инсулина направляет поступившие нутриенты в депо[9]:
- глюкозу — для синтеза гликогена;
- аминокислоты — для белкового синтеза;
- жирные кислоты — для формирования липидных запасов.
Период между приёмами пищи
Через 12-14 часов после приёма пищи наступает катаболическая фаза. Снижение инсулина и нарастание глюкагона активируют мобилизацию энергетических субстратов. Печень начинает продукцию глюкозы из гликогена, а затем из аминокислот и глицерола[9].
Метаболические изменения при голодании
При продолжительном воздержании от пищи организм переключается на альтернативные источники энергии. Интенсификация липолиза обеспечивает массивное поступление жирных кислот, которые в печени конвертируются в кетоновые тела. Мозг адаптируется к использованию кетонов, получая более половины энергетических потребностей из этого субстрата, что существенно снижает потребность в глюконеогенезе и сохраняет мышечную ткань[9].
Онтогенез и возрастные особенности
Формирование железы в период эмбриогенеза
Закладка железы происходит на третьей неделе эмбриогенеза в виде выпячивания энтодермальной стенки первичной кишки[10]. Дифференцировка на экзокринную и эндокринную части инициируется с третьего месяца внутриутробного развития. Ацинарные структуры и протоковая система формируются параллельно с образованием эндокринных островков, которые первоначально представляют собой почки на выводных протоках, а затем обособляются от них.
Рост и созревание железы после рождения
У новорождённых железа имеет миниатюрные размеры: длина составляет 3-6 сантиметров при массе 2,5-3 грамма. Орган располагается несколько выше взрослого положения и характеризуется относительной подвижностью из-за слабой фиксации к задней брюшной стенке.
Интенсивный рост происходит в первые годы жизни: к трёхлетнему возрасту масса достигает 20 граммов, а к 10-12 годам — 30 граммов. Окончательные пропорции и топография, характерные для взрослого организма, устанавливаются к 5-6 годам[11].
Возрастные изменения структуры железы
С возрастом происходит постепенное изменение соотношения между экзокринной и эндокринной частями железы в сторону уменьшения числа островков. Этот процесс может способствовать развитию возрастной инсулинорезистентности[11].
Сосудистое обеспечение и иннервация
Система артериального кровоснабжения
Кровоснабжение осуществляется через систему панкреатодуоденальных артерий, формирующих богатую васкуляризацию. Верхние панкреатодуоденальные артерии отходят от гастродуоденальной артерии (ветви печёночной артерии), а нижние — от верхней брыжеечной артерии[1].
Артериальные сосуды, разветвляясь в междольковой строме, образуют плотные капиллярные сети, оплетающие ацинусы и проникающие в островковую ткань. Особенностью островкового кровотока является высокая плотность фенестрированных капилляров, обеспечивающих эффективный транспорт гормонов.
Венозный отток крови от железы
Венозный отток происходит через панкреатодуоденальные вены в систему воротной вены. Позади тела железы происходит слияние верхней брыжеечной и селезёночной вен с образованием воротной вены печени[1].
Лимфатический дренаж органа
Лимфатические капилляры, берущие начало вокруг ацинусов и островков, формируют сеть лимфатических сосудов, сопровождающих кровеносные. Лимфа собирается в 2-8 панкреатических лимфатических узлах, расположенных по краям железы[1].
Иннервация и нервный контроль функций
Парасимпатическая иннервация обеспечивается ветвями блуждающих нервов, преимущественно правого. Симпатические волокна происходят из чревного сплетения и сопровождают сосуды. В толще железы располагаются интрамуральные ганглии, обеспечивающие местную регуляцию[1].
Эволюционные аспекты
Эволюционное развитие эндокринной системы
Эндокринные функции поджелудочной железы имеют древние эволюционные корни. У примитивных позвоночных клетки, производящие инсулиноподобные пептиды, рассеяны в стенке кишечника. Прогрессивная концентрация этих клеток в отдельные структуры характеризует эволюционное усложнение эндокринной системы[12].
Сравнительный анализ эндокринных функций
У всех позвоночных железа производит инсулин, глюкагон и соматостатин, демонстрируя консервативность основных регуляторных механизмов[13]. Однако соотношение различных типов клеток варьирует: у рептилий и птиц преобладают глюкагон-продуцирующие клетки, в отличие от млекопитающих с доминированием бета-клеток.
Специфические эволюционные адаптации
Рыбы обладают специализированными эндокринными структурами, отсутствующими у наземных позвоночных: тельцами Станниуса в почках и урофизом в основании хвоста, производящими специфические регуляторные пептиды[12].
Патофизиология и клинические аспекты
Спектр заболеваний железы включает[13]:
- воспалительные процессы (острый и хронический панкреатит);
- опухолевые поражения;
- наследственные болезни (муковисцидоз);
- эндокринные нарушения (сахарный диабет);
- кистозные образования;
- некротические процессы.
Экзокринная недостаточность проявляется нарушением переваривания жиров (стеатореей) и других нутриентов. Эндокринная недостаточность ведёт к развитию сахарного диабета различных типов.
Историческое познание железы
Начальные этапы изучения анатомии железы
Первичные упоминания поджелудочной железы в письменных источниках демонстрируют интуитивное понимание древними анатомами особой значимости данного органа. В талмудических текстах железа получила метафорическое наименование «палец бога»[14] (на арамейском языке — «эцба д’элаха»), что отражало представление о её божественном предназначении в человеческом организме. Данная терминология свидетельствует о том, что древние исследователи, несмотря на ограниченность методологического аппарата препарирования, интуитивно распознавали критическую роль органа в жизнедеятельности.
Эллинистическая анатомическая школа Александрии, представленная работами Герофила (335—280 гг. до н. э.) и Эрасистрата (304—250 гг. до н. э.), заложила методологические основы систематического изучения внутренних органов[15]. Их дискрипции, хотя и не содержали детального анализа панкреатической морфологии, установили принципиальные подходы к анатомическому исследованию абдоминальных структур через секционный метод.
Становление научной морфологии XVI—XVII веков
Эпоха научной революции ознаменовалась принципиальным пересмотром методологических подходов к анатомическому исследованию. Андреас Везалий (1514—1564) в своём фундаментальном труде De humani corporis fabrica (1543) впервые применил метод прямого анатомического наблюдения, отказавшись от схоластической традиции некритического воспроизведения галеновских описаний[16].
XX века в эндокринологии
Открытие инсулина в 1921 году представляло кульминацию многолетних исследований в области экспериментальной эндокринологии. Фредерик Бантинг (1891—1941) и Чарльз Бест (1899—1978), работавшие в лаборатории Джона Маклеода в Университете Торонто, разработали методологию экстракции биологически активного вещества из панкреатических островков собак.
Первое клиническое применение инсулинового экстракта состоялось 11 января 1922 года при лечении четырнадцатилетнего пациента Леонарда Томпсона, страдавшего сахарным диабетом первого типа. Драматическое улучшение клинического состояния больного продемонстрировало терапевтическую эффективность гормональной заместительной терапии и открыло новую эпоху в эндокринологической медицине.
Нобелевская премия по физиологии и медицине 1923 года, присуждённая Бантингу и Маклеоду, признала революционное значение открытия инсулина для медицинской науки[17]. Последующие исследования Дороти Ходжкин (1910—1994), удостоенной Нобелевской премии по химии 1964 года за расшифровку кристаллической структуры инсулина методом рентгеноструктурного анализа, заложили молекулярные основы современной протеиновой эндокринологии.
Литература
- Везалий А. О строении человеческого тела. — 1954. — Т. 2. — С. 960.
- Губергриц Н. Б. Панкреатология: от прошлого к будущему // Вестник клуба панкреатологов. — 2009. — № 2. — С. 13–23.
- Лепорский Н. И. Болезни поджелудочной железы. — М., 1951.
Примечания
- ↑ 1,0 1,1 1,2 1,3 1,4 Pandol S.J. The Exocrine Pancreas. — San Rafael: Morgan & Claypool Life Sciences, 2010.
- ↑ Kaplan E.L. Normal pancreatic dimensions in the adult human / E.L. Kaplan, P. Meier, R.L. Rossi. — The American Journal of Surgery, 1994.
- ↑ Маев И.В. Болезни поджелудочной железы / И.В. Маев, Ю.А. Кучерявый. — М.: ГЭОТАР-Медиа, 2009. — 736 с.
- ↑ Howard J.M. Johann Georg Wirsüng (1589-1643) and the pancreatic duct / J.M. Howard, W. Hess, W. Traverso. — Journal of the American College of Surgeons, 1998. — Vol. 187, № 2. — P. 201–211.
- ↑ Anatomy and Histology of the Pancreas. Pancreapedia : специализированная научная база знаний.
- ↑ 6,0 6,1 Physiology, Secretin / StatPearls. — Treasure Island: StatPearls Publishing, 2023.
- ↑ Pancreatic β-Cell Electrical Activity and Insulin Secretion // PubMed Central. — PMID PMC5866358.
- ↑ Rosenfeld L. Insulin: discovery, controversy, and tragedy / L. Rosenfeld. — Archives of Internal Medicine, 2002. — Vol. 162, № 21. — P. 2472–9.
- ↑ 9,0 9,1 Regulation of Postabsorptive and Postprandial Glucose Metabolism // PubMed Central. — PMID PMC7825450.
- ↑ Embryology, Pancreas // StatPearls. — Treasure Island: StatPearls Publishing, 2023.
- ↑ 11,0 11,1 Butler P.C. Dynamic development of the pancreas from birth to adulthood // PubMed Central / P.C. Butler [et al.]. — 2016. — PMID PMC4900072.
- ↑ 12,0 12,1 Madsen O.D. Pancreas phylogeny and ontogeny // PubMed Central / O.D. Madsen, P. Serup. — 2007. — PMID PMC1988839.
- ↑ 13,0 13,1 Steiner D.J. Pancreatic islet plasticity: interspecies comparison // PubMed Central / D.J. Steiner [et al.]. — PMID PMC2908252.
- ↑ Noble P.N. Insulin — 90 years on: the discovery that opened the modern era // Journal of Medical Biography / P.N. Noble. — 2015. — Vol. 23, № 2. — P. 96–103. — doi:10.1177/0967772014558769.
- ↑ Bay N.S. Greek anatomist Herophilus: the father of anatomy // Anatomy & Cell Biology / N.S. Bay, B.H. Bay. — 2010. — Vol. 43, № 4. — P. 280–3. — PMID PMC3026179.
- ↑ Steele L. Andreas Vesalius and his De humani corporis Fabrica // Vesalius / L. Steele. — 2014. — Vol. 20, № 1. — P. 5—10. — PMID 25181775.
- ↑ Rosenqvist U. The history of the Nobel prize for the discovery of insulin // Diabetes Research and Clinical Practice / U. Rosenqvist. — 2021. — Vol. 175. — PMID 33865917.