Оксид лития
| Оксид лития | |
|---|---|
 | |
 | |
| Общие | |
| Систематическое наименование |
Оксид лития |
| Традиционные названия | Окись лития |
| Хим. формула | Li2O |
| Рац. формула | Li2O |
| Физические свойства | |
| Состояние | твёрдое |
| Молярная масса | 29,8774 г/моль |
| Плотность | 2,013 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 1570 °C |
| • кипения | 2600 °C |
| Энтальпия | |
| • образования | -595,8 кДж/моль |
| Химические свойства | |
| Растворимость | |
| • в воде | 6,67 (0 °C) |
| Классификация | |
| Рег. номер CAS | 12057-24-8 |
| RTECS | OJ6360000 |
| Безопасность | |
| NFPA 704 | |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Окси́д ли́тия (окись лития) — бинарное химическое соединение лития с кислородом, имеющее формулу Li₂O. Относится к классу основных оксидов. Представляет собой твёрдое кристаллическое вещество белого или светло-серого цвета[1].
История открытия
Историческое открытие и первые шаги в исследовании лития (XIX век)
В 1817 году шведский химик Иоганн Август Арфведсон обнаружил новый металл — литий, в минерале петалите (LiAlSi₄O₁₀), добытом на руднике Уто. Анализируя состав минерала, Арфведсон выявил, что 4 % его массы не могут быть объяснены известными элементами того времени. Наблюдение привело его к выводу о существовании нового соединения, который он охарактеризовал как «огнепостоянная щелочь до сих пор неизвестной природы». Название «литий» было предложено его наставником Йёнсом Берцелиусом, подчеркивая минеральное происхождение элемента[2].
В контексте систематизации химических элементов и их соединений, шведский химик Йёнс Якоб Берцелиус предложил номинировать данный щелочной элемент как литион (Lithion). Это решение было обусловлено тем, что в отличие от калия (K) и натрия (Na), впервые обнаруженного в минеральных соединениях, данный элемент был идентифицирован исключительно в рамках литогенной сферы, то есть в «царстве минералов». Этимология названия литиона восходит к греческому слову «λίθος» (lithos), что означает «камень» что подчёркивает его природное происхождение и тесную связь с минеральным миром[2].
Арфведсон подтвердил наличие лития и в других минералах, таких как сподумен (LiAlSi₂O₆) и лепидолит. Однако ключевая проблема заключалась в невозможности выделения чистого металла из-за высокой химической активности его соединений[2].
Ранние области применения лития (XIX — начало XX века)
В конце XIX века оксид лития начал активно использоваться в стекольной и керамической промышленности. Добавление Li₂O в стекольные шихты позволило снизить температуру плавления стекла и улучшить его оптические свойства, особенно в отношении прозрачности для ультрафиолетовых лучей. В керамике Li₂O использовался для повышения термостойкости глазурей, что стало важным шагом в развитии этих материалов[3].
Технологический прорыв в высокотехнологичных отраслях (вторая половина XX века)
В 1980-х годах исследования Стэнли Уиттингема из Exxon и Джона Гуденафа привели к повышению эффективности литий-ионных аккумуляторов. Хотя первоначально аноды делались из металлического лития, синтетические катодные материалы, такие как LiCoO₂, включали оксид лития. Это стало основой для дальнейшего развития аккумуляторных технологий[4].
Свойства вещества
Химическое строение
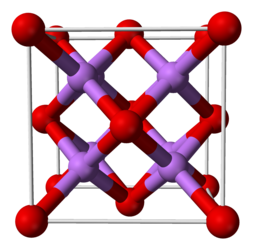
Оксид лития (Li₂O) представляет собой уникальный кристаллический материал характеризующейся кубической сингонией и пространственной группой Fm3̄m. В этой структуре ионы кислорода (O²⁻) формируют плотную кубическую упаковку, аналогичную катионам кальция в структуре флюорита (CaF₂). Катионы лития (Li⁺) занимают все тетраэдрические пустоты, что соответствует 8 катионам на элементарную ячейку. Параметр кристаллической решетки при 25 °C составляет 4,611 Å[3]. Каждый ион Li⁺ окружен четырьмя ионами O²⁻, формируя тетраэдрическое координационное окружение, в то время как каждый ион O²⁻ координирован восемью ионами Li⁺, что соответствует кубической симметрии[5][6].
Химическая связь в Li₂O преимущественно ионная, с долей ионности, составляющей около 79 % по шкале Полинга. Это обусловлено значительной разностью электроотрицательностей элементов (ΔЭО = 2,5) и сферической симметрией электронных оболочек ионов. Несмотря на малый размер иона Li⁺, составляющий 76 пм, энергия решетки Li₂O, равная −2973 кДж/моль, превышает аналогичные показатели для других оксидов щелочных металлов, таких как Na₂O (−2481 кДж/моль). Это объясняется максимальным электростатическим притяжением между компактными ионами Li⁺ и O²⁻[6].
Физические свойства
Молекулярная масса соединения относительно невелика и составляет 29,88 атомных единиц массы (а. е. м.). Важной особенностью Li₂O является его высокая гигроскопичность — он активно поглощает влагу из окружающего воздуха, что требует особых условий обращения и хранения[1].
Кристаллическая структура оксида лития относится к кубическому типу, что во многом определяет его физические свойства. Плотность кристаллического Li₂O при стандартных условиях (25 °C) равна 2,013 г/см³, что свидетельствует о его достаточно высокой упаковке. Соединение обладает выдающейся термической стабильностью. Температура плавления находится в районе 1570 °C (в некоторых авторитетных источниках, таких как Большая российская энциклопедия, приводится значение 1453 °C, что может быть связано с различиями в методиках определения или чистоте образцов). Температура кипения Li₂O чрезвычайно высока и оценивается примерно в 2600 °C (по другим данным, около 2000 °C), что подчеркивает его устойчивость к термическому разложению[1][6][7].
Энергетика образования и превращений оксида лития характеризуется следующими ключевыми термодинамическими параметрами[7]:
- Стандартная энтальпия образования (ΔH°f) твердого Li₂O составляет −595.8 кДж/моль, а для газообразного состояния — −166 кДж/моль. Эти значительные отрицательные значения, особенно для твердой фазы, указывают на высокую энергетическую стабильность соединения. Стандартная энергия Гиббса образования (ΔG°f) также отрицательна для твердого оксида (-562.1 кДж/моль), подтверждая его термодинамическую устойчивость при стандартных условиях. Для газообразного Li₂O значение ΔG°f положительно (+43 кДж/моль), что свидетельствует о его неустойчивости в этом состоянии.
- Стандартная энтропия (S°) твердого Li₂O равна 37.89 Дж/(моль·K), в то время как для газообразного состояния она значительно выше — 233 Дж/(моль·K), что характерно для увеличения степени свободы молекул.
- Стандартная мольная теплоемкость (Cp°) при постоянном давлении для твердой фазы составляет 54.1 Дж/(моль·K), а для газообразной — 50 Дж/(моль·K).
- Процесс плавления твердого оксида лития требует затраты теплоты, равной 35.6 кДж/моль. Теплота сублимации (прямого перехода из твердого состояния в газообразное) при 0 К составляет 425 кДж/моль, что отражает высокую энергию, необходимую для полного разрыва кристаллической решетки и перевода вещества в газовую фазу.
Химические свойства
Реакция с водой
Оксид лития (Li₂O) проявляет выраженные основные свойства при взаимодействии с водой (H₂O)[8]. Реакция протекает медленно по сравнению с оксидами других щелочных металлов[9]:
Образующийся гидроксид лития (LiOH) является сильным основанием[8].
Взаимодействие с кислотами
Оксид лития, как типичный основный оксид, активно взаимодействует с кислотами, демонстрируя характерное кислотно-основное поведение. Рассмотрим реакции с соляной кислотой (HCl) и серной кислотой (H₂SO₄)[8]:
В результате реакции образуется хлорид лития (LiCl) и вода. Данный процесс иллюстрирует типичное взаимодействие основного оксида с кислотой с образованием соли и воды.
Продуктами реакции являются сульфат лития (Li₂SO₄) и вода. Этот процесс также подчиняется классическим законам кислотно-основного взаимодействия[8].
Взаимодействие с кислотными оксидами
Оксид лития активно реагирует с кислотными оксидами, образуя соответствующие соли. Примером такой реакции является взаимодействие с углекислым газом (CO₂):
В результате образуется карбонат лития (Li₂CO₃).
Способы получения
Горение металлического лития
Оксид лития (Li₂O) может быть синтезирован посредством высокотемпературного окисления металлического лития (Li) в атмосфере сухого воздуха. Реакция протекает при температуре приблизительно 200 °C, сопровождаясь значительным выделением тепла (142,3 ккал на моль)[9]:
Продукт может иметь желтоватый оттенок из-за небольшого количества пероксида лития (Li₂O₂)[9].
Прокаливание гидроксида лития
Нагревание гидроксида лития (LiOH) до высоких температур инициирует его термическое разложение, приводящее к образованию оксида лития и воды. Этот процесс протекает по следующей схеме[9]:
Прокаливание нитрата лития
При термическом воздействии на нитрат лития (LiNO₃) происходит его разложение на оксид лития, диоксид азота и молекулярный кислород. Реакция может быть представлена следующим образом[9]:
Прокаливание нитрита лития
Данная химическая реакция представляет собой процесс термического разложения нитрита лития, в результате которого образуются оксид лития(Li2O), диоксид азота (NO2) и монооксид азота (NO). Для успешного проведения данной реакции необходимо соблюдать определённые условия: температура должна превышать 180 °C, а также обеспечивать вакуум для минимизации побочных процессов[10].
Прокаливание карбоната лития
Карбонат лития (Li₂CO₃) при нагревании в токе водорода разлагается на оксид лития и углекислый газ. Данный процесс можно описать следующей химической реакцией[9]:
Реакции с металлами
Оксид лития, обладая высокой реакционной способностью, вызывает интенсивную коррозию большинства материалов, устойчивых к воздействию агрессивных сред, особенно при температурах, превышающих 1000 °C. В этих условиях он демонстрирует способность к деструктивному взаимодействию с широким спектром оксидов и металлов, что обуславливает его значительную химическую агрессивность. Однако при температурах ниже 1000 °C некоторые материалы, такие как платина, золото и никель, проявляют устойчивость к воздействию оксида лития. Это обусловлено их физико-химическими свойствами, которые минимизируют процессы коррозии при контакте с данным соединением[11].
Один из таких процессов — взаимодействие оксида лития (Li₂O) с магнием (Mg), приводящее к образованию лития (Li) и оксида магния (MgO)[12].
Это окислительно-восстановительная реакция: магний (Mg) выступает в роли восстановителя, окисляясь до ионов Mg²⁺, а оксид лития (Li₂O) — окислителя, восстанавливаясь до металлического лития (Li). Реакция требует температуры выше 800 °C, что указывает на её эндотермический характер и необходимость значительного энергетического вклада для преодоления энергетического барьера. Высокая температура обеспечивает кинетическую энергию для преодоления межатомных взаимодействий[12].
Особые свойства
Оксид лития не взаимодействует с водородом, углеродом (II) и кислородом ни при каких температурах.
Применение
Оксид лития (Li₂O) является многофункциональным компонентом, широко используемым в различных областях химии и материаловедения. В контексте твердофазного синтеза двойных и тройных оксидов, его применение обусловлено способностью значительно снижать температуру реакции, что позволяет оптимизировать процессы и повысить их эффективность[13].
В области производства специальных стёкол, глазурей и эмалей оксид лития играет ключевую роль, улучшая их физико-химические свойства. Введение Li₂O в состав этих материалов способствует повышению их химической и термической стойкости, а также увеличению механической прочности. Кроме того, оксид лития снижает вязкость расплавов, что особенно важно при изготовлении стёкол с низким температурным коэффициентом линейного расширения (ТКЛР) и рентгенопрозрачных стёкол, требующих высокой степени однородности и прозрачности[13].
В сфере литий-ионных аккумуляторов оксид лития является неотъемлемым компонентом катодных материалов, обеспечивая высокую энергетическую плотность и долговечность батарей. Его использование в катодах способствует улучшению электрохимических характеристик аккумуляторов, что делает их более эффективными и надёжными для широкого спектра применений[13].
В химической промышленности оксид лития также находит применение в производстве резиновых и уплотнительных материалов, где он может выступать в качестве добавки, улучшающей эксплуатационные свойства конечных продуктов. Включение Li₂O в состав резиновых композиций способствует повышению их термостойкости, химической инертности и долговечности, что особенно важно для применения в агрессивных средах и при высоких температурах[13].
Научные, оптические и электротехнические приборы. В этой области оксид лития играет ключевую роль в разработке и производстве литий-ионных аккумуляторов, которые являются основой для современных портативных электронных устройств. Его высокая электропроводность и способность обратимо интеркалировать ионы лития обеспечивают высокую энергетическую плотность и длительный срок службы батарей[13].
Оксид лития может быть использован в качестве компонента в системах теплообмена и охлаждения благодаря своей высокой теплопроводности и термостойкости. Он применяется в различных типах теплообменников, радиаторов и других устройств, обеспечивающих регулирование температуры в промышленных и бытовых условиях[13].
Оксид лития находит применение в агрохимической отрасли, где он используется в качестве добавки в удобрениях и средствах защиты растений. Его свойства позволяют улучшить питательный режим почвы, повысить устойчивость растений к стрессовым факторам и стимулировать их рост и развитие[13].
Уровень опасности и меры предосторожности
Оксид лития представляет серьёзную опасность для здоровья человека. Вещество обладает выраженным токсическим действием, особенно на центральную нервную систему. Ионы лития оказывают общетоксическое воздействие на организм, вызывая ряд негативных симптомов при попадании в организм[14][15].
При контакте с оксидом лития возможны следующие проявления: боли в животе, тошнота, рвота, диарея. Вещество оказывает сильное коррозионное действие при попадании на кожу и вызывает выраженное раздражение слизистых оболочек. Особую опасность представляет вдыхание пыли данного вещества. Основными органами-мишенями при воздействии оксида лития являются желудочно-кишечный тракт, печень, почки, а также глаза и кожные покровы[14][15].
Для безопасного обращения с веществом необходимо строго соблюдать меры предосторожности. Обязательно использование средств индивидуальной защиты: респиратора, защитных очков закрытого типа, специальных перчаток и защитной одежды[15].
В случае контакта с веществом необходимо оказать первую помощь. При попадании через рот следует прополоскать ротовую полость водой, обеспечить обильное питьё, принять активированный уголь и немедленно обратиться за медицинской помощью. При контакте с кожей нужно тщательно промыть поражённые участки проточной водой. Если вещество попало в глаза, необходимо промывать их проточной водой не менее 15 минут, удерживая веки широко раскрытыми, после чего при сохранении раздражения обратиться к врачу. При вдыхании следует вывести пострадавшего на свежий воздух, обеспечить покой и тепло, при затруднении дыхания — доступ кислорода[15].
Для безопасного хранения оксида лития необходимо соблюдать следующие условия: хранить вещество в сухом помещении, защищать от влаги и углекислого газа, использовать герметичную тару, а также следовать общим правилам складирования химических веществ[15].
Примечания
- ↑ 1,0 1,1 1,2 Химическая энциклопедия / Главный редактор: И. Л. Кнунянц. — М.: Советская энциклопедия, 1990. — Т. 2. — С. 608. — 671 с. — ISBN 5-82270-035-5.
- ↑ 2,0 2,1 2,2 Литий: история открытия элемента. Химический факультет МГУ. Дата обращения: 29 июня 2025.
- ↑ 3,0 3,1 Зимина Г.В., Потапова А.М.,Смирнова И.Н. Избранные главы ХиТРЭ. Химия и технология лития. Учебное пособие / Рецензент: проф., д.х.н. Вольдман Г.М.. — М.: Московский государственный университет тонких химических технологий им. М.В. Ломоносова, 2014. — 60 с.
- ↑ История развития литиевых батарей. Янчжоу Яркий Солнечная Решения Компания (16 мая 2024). Дата обращения: 29 июня 2025.
- ↑ Гринвуд Н., Эрншо А. Химия элементов : в 2 томах / Перевод с английского канд. хим. наук Л.Ю. Аликберовой и др.. — М.: Бином, 2008. — С. 84—109. — 607 с. — ISBN 978-5-94774-373-9.
- ↑ 6,0 6,1 6,2 Стёпин Б. Д. Оксид лития. БРЭ (24 апреля 2024). Дата обращения: 29 июня 2025.
- ↑ 7,0 7,1 Кипер Р. А. Лития оксид. Химия и токсикология. Дата обращения: 29 июня 2025.
- ↑ 8,0 8,1 8,2 8,3 Оксид лития. Acetyl. Дата обращения: 29 июня 2025.
- ↑ 9,0 9,1 9,2 9,3 9,4 9,5 Рипан Р., Четяну И. Неорганическая химия. Химия металлов / Гл.ред.: акад. В. И. Спицын. — М.: Мир, 1971. — Т. 1. — С. 57. — 560 с.
- ↑ Реакция термического разложения нитрита лития. Chemicalstudy.ru. Дата обращения: 30 июня 2025.
- ↑ Амелина Г. Н., Жерин И.И. Частные реакции лития. — Томск: Издательство Томского политехнического университета, 2014. — С. 5—6.
- ↑ 12,0 12,1 Реакция взаимодействия оксида лития и магния. Сhemicalstudy.ru. Дата обращения: 30 июня 2025.
- ↑ 13,0 13,1 13,2 13,3 13,4 13,5 13,6 Оксид лития - классы МКТУ. МКТУ. Дата обращения: 30 июня 2025.
- ↑ 14,0 14,1 Токсичность лития. Техника безопасности при работе с литием. Markmet. Дата обращения: 30 июня 2025.
- ↑ 15,0 15,1 15,2 15,3 15,4 Федеральный регистр потенциально опасных химических и биологических веществ. НИАЦ РПОХБВ ФБУН «ФНЦГ им. Ф.Ф.Эрисмана» Роспотребнадзора. Дата обращения: 30 июня 2025.











