Индометацин
| Индометацин | |
|---|---|
 Химическая формула индометацина Химическая формула индометацина | |
| Химическое соединение | |
| ИЮПАК | 2-{1-[(4-chlorophenyl)carbonyl]-5-methoxy-2-methyl-1''H''-indol-3-yl}acetic acid |
| Брутто-формула | C19H16ClNO4 |
| Молярная масса | 357,787 г/моль−1 |
| CAS | 53-86-1 |
| PubChem | 3715 |
| DrugBank | APRD00109 |
| Состав | |
| Классификация | |
| АТХ | C01EB03, Шаблон:ATC, Шаблон:ATC, Шаблон:ATC |
| Фармакокинетика | |
| Биодоступн. | ~100 % (внутрь), 80-90 % (ректально) |
| Связывание с белками плазмы | 99% |
| Метаболизм | в печени |
| Период полувывед. | 4,5 часов |
| Экскреция | Почки 60 %, кишечник 33 % |
| Способы введения | |
| внутрь, ректально, внутривенно, местное применение | |
Индометаци́н (англ. Indomethacin, лат. Indometacinum) — лекарственное средство из группы нестероидных противовоспалительных препаратов, производное индолилуксусной кислоты[1].
Относится к числу наиболее мощных противовоспалительных средств с выраженным анальгетическим и жаропонижающим действием. Препарат характеризуется сложным профилем фармакологической активности, включающим как классические эффекты ингибирования циклооксигеназы, так и уникальные нейротропные свойства.
Общие сведения и классификация
Химическая структура и номенклатура
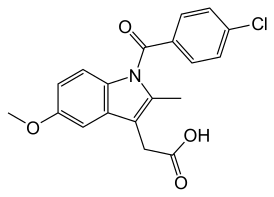
Индометацин представляет собой производное индолилуксусной кислоты с химической формулой C₁₉H₁₆ClNO₄ и молекулярной массой 357,79 г/моль. Систематическое химическое название: 2-{1-[(4-хлорфенил)карбонил]-5-метокси-2-метил-1H-индол-3-ил}уксусная кислота. Международное непатентованное наименование (МНН) — индометацин[1]. В различных фармакопеях препарат имеет следующие обозначения:
- Indometacin (Британская фармакопея);
- Indomethacin (Фармакопея США).
Структура молекулы включает индольное кольцо, соединённое с уксусной кислотой, что обеспечивает высокую липофильность препарата и способность проникать через гематоэнцефалический барьер. Наличие хлорфенильной группы и метоксильного заместителя определяет специфические фармакокинетические свойства молекулы. Кристаллическая форма представляет собой белый или слегка желтоватый кристаллический порошок, практически нерастворимый в воде, но растворимый в этаноле и хлороформе.
История открытия и разработки
Препарат был запатентован в 1961 году американской фармацевтической компанией Merck & Co и получил одобрение для медицинского применения в 1963 году[2]. Первоначальные клинические исследования проводились под руководством F. D. Hart и P. L. Boardman, которые продемонстрировали эффективность препарата при ревматоидном артрите. Фундаментальное описание механизма действия индометацина, наряду с другими ингибиторами циклооксигеназы, было представлено в революционной работе S. H. Ferreira, S. Moncada и J. R. Vane в 1971 году[3]. Это исследование заложило основы современного понимания фармакологии нестероидных противовоспалительных средств.
Разработка индометацина стала результатом систематического поиска новых противовоспалительных агентов в рамках программы модификации структуры индолуксусной кислоты. Первые клинические испытания показали высокую эффективность препарата, однако вскоре были выявлены серьёзные побочные эффекты, что потребовало пересмотра показаний к применению. В 1970-х годах были установлены специфические показания для использования индометацина в неонатологии для закрытия открытого артериального протока.
Место в международных классификациях
Индометацин включён в перечень основных лекарственных средств Всемирной организации здравоохранения[4], что подтверждает его важное значение в современной фармакотерапии. В анатомо-терапевтическо-химической классификации (АТХ) препарат относится к группе M01AB01 (индометацин) в разделе нестероидных противовоспалительных и противоревматических препаратов.
По классификации Американского колледжа ревматологии индометацин относится к традиционным НПВП с неселективным ингибированием циклооксигеназы. В российской фармакопее препарат включён в группу ненаркотических анальгетиков, нестероидных противовоспалительных препаратов. Европейское агентство по лекарственным средствам (EMA) классифицирует индометацин как препарат с ограниченными показаниями из-за неблагоприятного профиля безопасности. В базе данных Управления по контролю качества пищевых продуктов и лекарственных средств США (FDA) препарат имеет статус рецептурного лекарственного средства с предупреждениями о риске серьёзных сердечно-сосудистых и желудочно-кишечных осложнений.
Фармакологические свойства
Механизм действия
Основной механизм действия индометацина заключается в неселективном ингибировании циклооксигеназы первого и второго типов (ЦОГ-1 и ЦОГ-2)[5]. Препарат связывается с активным центром фермента, блокируя превращение арахидоновой кислоты в простагландины и тромбоксаны. Это приводит к снижению синтеза простагландинов — медиаторов воспаления, боли и лихорадки. Препарат характеризуется логарифмическим показателем кислотности (pKa) в диапазоне 3‒4,5, что определяет особенности его распределения в тканях организма.
Индометацин проявляет выраженную селективность к ЦОГ-1 по сравнению с ЦОГ-2, что объясняет высокую частоту желудочно-кишечных осложнений. Константа ингибирования (IC₅₀) для ЦОГ-1 составляет 0,1‒1,0 мкМ, для ЦОГ-2 — 1,0‒10 мкМ. Ингибирование носит обратимый характер, в отличие от необратимого ингибирования, характерного для ацетилсалициловой кислоты. Помимо основного механизма, индометацин оказывает прямое стабилизирующее действие на лизосомальные мембраны, препятствуя высвобождению медиаторов воспаления.
Фармакокинетика
После перорального приёма индометацин быстро абсорбируется из желудочно-кишечного тракта с биодоступностью 90‒98 %. Максимальная концентрация в плазме крови достигается через 2 часа при однократном приёме дозы 25 или 50 мг. При ректальном введении биодоступность составляет 80‒90 %. Связывание с белками плазмы крови высокое — 90‒98 %. Период полувыведения варьирует от 4 до 9 часов у взрослых пациентов[5].
Распределение характеризуется высокой липофильностью, что обеспечивает проникновение через гематоэнцефалический и плацентарный барьеры. Биотрансформация происходит преимущественно в печени путём деметилирования и дезбензоилирования. Экскреция осуществляется преимущественно почками — 70 % (30 % в неизменённом виде) и через желудочно-кишечный тракт — 30 %.
Специальные эффекты на центральную нервную систему
Уникальной особенностью индометацина является его способность снижать церебральный кровоток посредством интракраниальной прекапиллярной вазоконстрикции[6]. Внутривенное болюсное введение препарата в дозе 0,5‒1,0 мг/кг способно снизить внутричерепное давление на 37 % в течение 10‒15 минут при одновременном увеличении церебрального перфузионного давления на 30 %.
Нейротропные эффекты включают ингибирование верхнего слюнного ядра в стволе мозга, что лежит в основе эффективности при тригеминальных вегетативных цефалиях. Препарат накапливается в ткани мозга в концентрациях, превышающих плазменные в 2‒3 раза.
Каннабиноидные взаимодействия
Современные исследования выявили способность индометацина функционировать как положительный аллостерический модулятор CB1 каннабиноидного рецептора[7]. Данное открытие объясняет некоторые особенности анальгетического действия препарата, не связанные с ингибированием циклооксигеназы. Индометацин усиливает связывание эндогенных каннабиноидов (анандамида, 2-арахидоноилглицерола) с CB1 рецепторами, что может способствовать дополнительному обезболивающему эффекту.
Аллостерическая модуляция CB1 рецепторов происходит при концентрациях индометацина, соответствующих терапевтическим дозам. Этот механизм может обеспечивать тканеспецифическое усиление каннабиноидной сигнализации без развития психоактивных эффектов, характерных для прямых агонистов CB1 рецепторов. Выявленное взаимодействие открывает новые перспективы для понимания полифармакологии индометацина и разработки более селективных противовоспалительных средств.
Клиническое применение
Ревматологические заболевания
Индометацин широко применяется в ревматологической практике для лечения ревматоидного артрита, анкилозирующего спондилоартрита, остеоартрита и подагрического артрита[5]. Препарат эффективен при остром болезненном плечевом бурсите и тендините. Клиническая эффективность при ревматоидном артрите сопоставима с преднизолоном в дозе 15‒20 мг/сут.
При анкилозирующем спондилоартрите индометацин является препаратом первой линии. Анальгетический эффект развивается в течение 2‒4 часов после приёма, противовоспалительное действие — через 24‒48 часов. При подагрическом артрите препарат используется в высоких дозах (150‒200 мг/сут) короткими курсами (3‒5 дней).
Неврологические синдромы
Особое место индометацин занимает в лечении головных болей, резистентных к другим анальгетикам. К индометацин-чувствительным головным болям относятся тригеминальные вегетативные цефалии, пароксизмальные гемикрании различных типов, первичная головная боль кашля и головная боль напряжения[8].
Диагностическое значение имеет положительный ответ на индометацин при хронической пароксизмальной гемикрании — полное купирование приступов в течение 24‒48 часов служит одним из критериев диагностики. При первичной головной боли кашля эффективность составляет 75‒80 % случаев при дозе 25‒50 мг три раза в сутки.
Кардиологические показания
В педиатрической кардиологии индометацин используется для закрытия открытого артериального протока у новорождённых[9]. Препарат блокирует синтез простагландинов E₂ и I₂, поддерживающих проходимость артериального протока. Эффективность составляет 60‒80 % при применении в первые 72 часа жизни.
Стандартная схема включает три внутривенных введения с интервалом 12‒24 часа. Дозировка зависит от возраста: 0,1 мг/кг для новорождённых младше 48 часов, 0,2 мг/кг для детей 2‒7 дней и 0,25 мг/кг для детей старше недели.
Урологическое применение
В урологической практике ректальные суппозитории с индометацином применяются при хроническом простатите[10]. Рекомендуемая схема — не более двух введений в сутки курсом 25‒30 дней. Лечебный эффект обусловлен противовоспалительным, обезболивающим и противомикробным действием. Клиническая эффективность проявляется уменьшением болевого синдрома в промежности и улучшением мочеиспускания.
Акушерско-гинекологические показания
Индометацин проявляет токолитическую активность, используется для задержки преждевременных родов[11]. Препарат блокирует синтез простагландинов F₂α и E₂ в миометрии, что приводит к снижению интенсивности маточных сокращений. Эффективность составляет 70‒80 % при применении до 32 недель беременности.
Стандартная схема токолиза включает начальную дозу 100 мг ректально, затем по 25‒50 мг каждые 4‒6 часов. Максимальная продолжительность лечения ограничивается 48‒72 часами из-за риска преждевременного закрытия артериального протока плода.
Режимы дозирования и способы применения
Пероральные формы
Стандартная терапевтическая доза составляет 50‒200 мг в сутки, разделённая на 2‒3 приёма. Препарат следует принимать во время или после еды для снижения риска желудочно-кишечных осложнений. Начальная доза обычно составляет 25 мг 2‒3 раза в день с возможным увеличением до 50 мг 3‒4 раза в день[5].
Пролонгированные формы содержат 75 мг действующего вещества и обеспечивают равномерное высвобождение в течение 12‒24 часов. При острых состояниях используются высокие дозы 150‒200 мг/сут коротким курсом. Пожилым пациентам рекомендуется снижение дозы на 25‒50 %.
Ректальные формы
Ректальное введение обеспечивает более быструю абсорбцию по сравнению с пероральным приёмом. Стандартные суппозитории содержат 50 или 100 мг индометацина[12]. Максимальная концентрация в плазме достигается через 30‒60 минут после введения. Ректальные формы особенно эффективны при ночных болях благодаря пролонгированному действию.
Офтальмологические формы
При инстилляции глазных капель индометацин проникает в переднюю камеру глаза. Стандартная концентрация составляет 0,1 % раствор для местного применения. Препарат эффективен при цистоидном макулярном отёке и воспалении после экстракции катаракты. Режим дозирования обычно включает 1‒2 капли 3‒4 раза в день в течение 1‒2 недель[5].
Парентеральное введение
Внутривенное введение индометацина применяется в специализированных отделениях для быстрого снижения внутричерепного давления[5]. Болюсная доза 0,5‒1,0 мг/кг с последующей двухчасовой инфузией обеспечивает нейропротективный эффект. Данный способ используется в нейрохирургии при черепно-мозговой травме и отёке мозга.
Безопасность и ограничения
Противопоказания
Абсолютными противопоказаниями являются[13]:
- активная пептическая язва или язвенная болезнь в анамнезе;
- аллергия на индометацин, ацетилсалициловую кислоту или другие НПВП;
- полипы носа с сопутствующей бронхиальной астмой (аспириновая триада);
- возраст до 2 лет (за исключением новорождённых с открытым артериальным протоком);
- тяжёлые поражения почек и печени с нарушением функции.
Относительными противопоказаниями служат неконтролируемая артериальная гипертензия, хроническая сердечная недостаточность, ишемическая болезнь сердца, воспалительные заболевания кишечника, нарушения свёртывающей системы крови.
Побочные эффекты
Частота развития головной боли на фоне приёма индометацина составляет 10‒20 %[13]. Желудочно-кишечные осложнения развиваются у 20‒30 % пациентов и включают диспепсию, тошноту, рвоту, диарею. Риск развития пептических язв составляет 1‒4 % при длительном применении, при этом 10‒20 % язв осложняются кровотечением или перфорацией.
Сердечно-сосудистые побочные эффекты включают повышение артериального давления на 5‒10 мм рт. ст., отёки, декомпенсацию хронической сердечной недостаточности. Почечные осложнения проявляются снижением скорости клубочковой фильтрации и развитием острой почечной недостаточности у предрасположенных пациентов.
Лекарственные взаимодействия
Индометацин значительно снижает почечную экскрецию лития, повышая риск интоксикации[14]. Концентрация лития в плазме может увеличиваться на 30‒60 %. При одновременном применении с ингибиторами АПФ или калийсберегающими диуретиками возрастает риск гиперкалиемии и острой почечной недостаточности.
Совместное применение с другими НПВП увеличивает риск желудочно-кишечных осложнений в 2‒3 раза. При сочетании с метотрексатом повышается риск токсического действия за счёт снижения почечной экскреции.
Особенности применения при беременности
Применение индометацина во второй половине беременности может вызвать преждевременное закрытие артериального протока плода[15]. FDA в 2020 году обновило предупреждения о риске почечных проблем у плода при использовании НПВП после 20 недель беременности.
При использовании в качестве токолитика после 32 недель беременности риск закрытия артериального протока возрастает до 50 %. В период грудного вскармливания препарат проникает в молоко в концентрациях 37‒47 % от материнских.
Токсикология и передозировка
Острая токсичность
Индометацин характеризуется высокой острой токсичностью. LD₅₀ у крыс составляет 12 мг/кг. Минимальная токсическая доза для человека составляет примерно 5‒10 мг/кг массы тела. У детей токсичность проявляется при дозах 2‒3 мг/кг из-за незрелости ферментных систем метаболизма[16].
Токсические эффекты обусловлены не только ингибированием циклооксигеназы, но и прямым цитотоксическим действием на клетки. Препарат способен вызывать разобщение окислительного фосфорилирования в митохондриях.
Клиника передозировки
Симптомы передозировки включают:
- тошноту, рвоту;
- сильную головную боль;
- головокружение, нарушения памяти;
- дезориентацию.
В тяжёлых случаях развиваются парестезии, судороги, кома. Неврологические симптомы появляются при концентрации препарата в плазме выше 5‒7 мкг/мл. Лечение передозировки симптоматическое. Гемодиализ неэффективен из-за высокого связывания с белками плазмы[16].
Специфические токсические эффекты
Препарат обладает ототоксическими свойствами[16], способен вызывать нарушения слуха и тиннитус. Описаны случаи тяжёлого поражения костного мозга с развитием апластической анемии. Фотосенсибилизация проявляется повышенной чувствительностью кожи к ультрафиолетовому излучению.
Гепатотоксичность может проявляться повышением активности печёночных ферментов или развитием фульминантного гепатита. Кожные реакции включают крапивницу, ангиоотёк, синдром Стивенса‒Джонсона.
Мониторинг терапии
Лабораторный контроль
Пациенты, получающие индометацин, нуждаются в регулярном мониторинге электролитов (натрий, калий, хлорид), общего анализа крови, печёночных ферментов и креатинина. Особое внимание требуется при сочетанном применении с ингибиторами АПФ или калийсберегающими диуретиками[12]. Базовые лабораторные исследования проводятся до начала лечения, затем через 2‒4 недели терапии и далее каждые 2‒3 месяца при длительном применении.
Контроль функции почек включает определение креатинина, мочевины, клиренса креатинина, общий анализ мочи с микроскопией осадка. При повышении креатинина более чем на 30 % от исходного уровня или развитии протеинурии требуется коррекция дозы или отмена препарата. Мониторинг печёночных ферментов (АЛТ, АСТ, щелочная фосфатаза, билирубин) необходим для раннего выявления гепатотоксичности. Контроль электролитов особенно важен у пациентов с сердечной недостаточностью, заболеваниями почек, при одновременном приёме диуретиков.
Клиническое наблюдение
Необходим регулярный контроль артериального давления для выявления гипертензии, физикальное обследование для выявления отёков и признаков центрально-нервных побочных эффектов. При применении только топических форм (гель, спрей) специального мониторинга не требуется. Измерение артериального давления проводится еженедельно в первый месяц лечения, затем ежемесячно при длительной терапии[12].
Неврологический осмотр включает оценку когнитивных функций, выявление головной боли, головокружения, нарушений зрения и слуха. Особое внимание уделяется появлению симптомов депрессии, тревожности, нарушений сна. Офтальмологическое обследование рекомендуется каждые 6 месяцев при длительном лечении для исключения ретинопатии. Аудиометрия показана при появлении шума в ушах или снижения слуха. При появлении признаков желудочно-кишечных осложнений (боли в эпигастрии, тошнота, мелена) требуется немедленное обследование, включая эзофагогастродуоденоскопию.
Альтернативы и место в терапии
Сравнение с другими НПВП
Высокая частота и тяжесть побочных эффектов делают индометацин препаратом второго выбора среди НПВП. Для пациентов, принимающих литий, предпочтительны менее токсичные альтернативы — сулиндак или ацетилсалициловая кислота. По противовоспалительной активности индометацин превосходит большинство других НПВП, однако уступает по безопасности селективным ингибиторам ЦОГ-2.
Сравнительные исследования показали, что эффективность индометацина при ревматоидном артрите сопоставима с диклофенаком и напроксеном, но превосходит ибупрофен и пироксикам[9]. При анкилозирующем спондилоартрите индометацин остаётся золотым стандартом, хотя эторикоксиб показывает сравнимую эффективность с лучшей переносимостью. Риск развития серьёзных желудочно-кишечных осложнений для индометацина в 2‒3 раза выше, чем для других неселективных НПВП. Кардиоваскулярный риск сопоставим с диклофенаком и напроксеном, но выше, чем у ибупрофена.
Показания второй линии
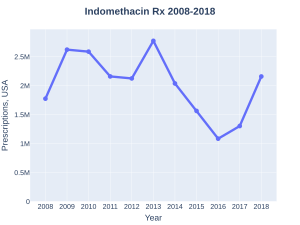
Обоснованное применение индометацина ограничивается состояниями, требующими кратковременной терапии (острые приступы подагры, дисменорея) или специфическими показаниями (индометацин-чувствительные головные боли, открытый артериальный проток у новорождённых). В статистике назначений США за 2022 год препарат занимал 256-е место с более чем одним миллионом выписанных рецептов[17].
Современные рекомендации различных медицинских обществ ограничивают применение индометацина специфическими клиническими ситуациями. Американский колледж ревматологии рекомендует индометацин только при неэффективности других НПВП или при специфических показаниях (анкилозирующий спондилоартрит, острый подагрический артрит). Европейская противоревматическая лига указывает на необходимость особой осторожности при назначении индометацина пациентам старше 65 лет. В российских клинических рекомендациях препарат рассматривается как средство резерва при воспалительных заболеваниях суставов.
Литература
- Клиническая фармакология: учебник / под ред. В. Г. Кукеса. — М.: ГЭОТАР-Медиа, 2009.
- Неврология: национальное руководство / под ред. Е. И. Гусева, А. Н. Коновалова, В. И. Скворцовой. — М.: ГЭОТАР-Медиа, 2009.
- Педиатрия: национальное руководство / под ред. А. А. Баранова. — М.: ГЭОТАР-Медиа, 2009.
- Ревматология: национальное руководство / под ред. Е. Л. Насонова, В. А. Насоновой. — М.: ГЭОТАР-Медиа, 2010.
Примечания
- ↑ 1,0 1,1 Elks J. The Dictionary of Drugs: Chemical Data, Structures and Bibliographies / J. Elks. — Springer, 2014. — 684 p. — ISBN 978-1-4757-2087-7.
- ↑ Hart F. D., Boardman P. L. Indomethacin: A New Non-steroid Anti-inflammatory Agent // British Medical Journal. — 1963. — Vol. 2, № 5363. — P. 965–970. — ISSN 0007-1447.
- ↑ Ferreira S. H., Moncada S., Vane J. R. Indomethacin and Aspirin abolish Prostaglandin Release from the Spleen // Nature New Biology. — 1971. — Vol. 231, № 25. — P. 237–239. — ISSN 0028-0836.
- ↑ World Health Organization model list of essential medicines: 22nd list. — Geneva: World Health Organization, 2021. — ISBN 978-92-4-003379-7.
- ↑ 5,0 5,1 5,2 5,3 5,4 5,5 Lucas S. The Pharmacology of Indomethacin // Headache. — 2016. — Vol. 56, № 2. — P. 436–446. — ISSN 0017-8748.
- ↑ Castellano A. E., Micieli G., Bellantonio P. et al. Indomethacin increases the effect of isosorbide dinitrate on cerebral hemodynamic in migraine patients // Cephalalgia. — 1998. — Vol. 18, № 9. — P. 622–630. — ISSN 0333-1024.
- ↑ Laprairie R. B., Mohamed K. A., Zagzoog A. et al. Indomethacin Enhances Type 1 Cannabinoid Receptor Signaling // Frontiers in Molecular Neuroscience. — 2019. — Vol. 12. — P. 257. — ISSN 1662-5099.
- ↑ Dodick D. W. Indomethacin-responsive headache syndromes // Current Pain and Headache Reports. — 2004. — Vol. 8, № 1. — P. 19–26. — ISSN 1531-3433.
- ↑ 9,0 9,1 Sekar K. C., Corff K. E. Treatment of patent ductus arteriosus: indomethacin or ibuprofen? // Journal of Perinatology. — 2008. — Vol. 28. — P. S60–S62. — ISSN 0743-8346.
- ↑ Рациональная фармакотерапия в урологии: руководство для практикующих врачей / под ред. Н. А. Лопаткина, Ю. Г. Аляева. — 2-е изд., испр. и доп. — М.: Литтерра, 2012. — 544 с. — ISBN 978-5-4235-0101-3.
- ↑ Hammerman C., Glaser J., Kaplan M. et al. Indomethacin tocolysis increases postnatal patent ductus arteriosus severity // Pediatrics. — 1998. — Vol. 102, № 5. — P. E56. — ISSN 0031-4005.
- ↑ 12,0 12,1 12,2 Индометацин. Справочник лекарственных средств Видаль. Дата обращения: 27 августа 2025.
- ↑ 13,0 13,1 Campo P., Maguin K., Gabriel S. et al. Combined Exposure to Noise and Ototoxic Substances. — Luxembourg: European Agency for Safety and Health, 2009. — ISBN 978-92-9191-258-6.
- ↑ Akbarpour F., Afrasiabi A., Vaziri N. D. Severe hyperkalemia caused by indomethacin and potassium supplementation // Southern Medical Journal. — 1985. — Vol. 78, № 6. — P. 756–757. — ISSN 0038-4348.
- ↑ Enzensberger C., Wienhard J., Weichert J. et al. Idiopathic constriction of the fetal ductus arteriosus: three cases and review of the literature // Journal of Ultrasound in Medicine. — 2012. — Vol. 31, № 8. — P. 1285–1291. — ISSN 0278-4297.
- ↑ 16,0 16,1 16,2 Johnson A.-C., Morata T. C. Occupational exposure to chemicals and hearing impairment. — Gothenburg: University of Gothenburg, 2010. — ISBN 978-91-628-8070-4.
- ↑ Indomethacin Drug Usage Statistics, United States, 2013‒2022. ClinCalc Database. Дата обращения: 27 августа 2025.
- Знание.Вики:Cite web (не указан язык)
- Страницы, использующие волшебные ссылки ISBN
- Лекарственные средства по алфавиту
- Ненаркотические анальгетики, включая нестероидные и другие противовоспалительные средства
- Ароматические карбоновые кислоты
- Хлорорганические соединения
- Соединения азота по алфавиту
- Производные индола
- Отклонённая статья