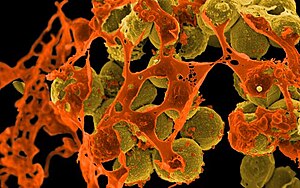
Золотистый стафилококк
| Золотистый стафилококк | ||||
|---|---|---|---|---|
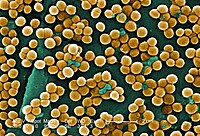 Колоризированная фотография бактерии в электронном микроскопе | ||||
| Научная классификация | ||||
|
Домен: Тип: Класс: Порядок: Семейство: Род: Вид: Золотистый стафилококк |
||||
| Международное научное название | ||||
| Staphylococcus aureus Rosenbach 1884 | ||||
| ||||
Золоти́стый стафилоко́кк (лат. Staphylococcus aureus) — грамположительная бактерия сферической формы, которая занимает особое место среди возбудителей инфекционных заболеваний человека.
Этот микроорганизм был впервые обнаружен в 1880 году шотландским хирургом Александром Огстоном в городе Абердине, что положило начало изучению одного из наиболее значимых патогенов современности[1].
Биологические особенности
Морфологически S. aureus характеризуется сферической формой клеток диаметром 0,7-1,2 микрометра, которые образуют характерные гроздевидные скопления. Отличительной чертой является золотистая пигментация колоний, обусловленная присутствием каротиноидных пигментов, что и дало название виду. Бактерия относится к факультативным анаэробам, что позволяет ей существовать как в присутствии, так и в отсутствие кислорода.
Генетическая организация микроорганизма включает приблизительно 2600 генов, расположенных на хромосоме длиной 0,5-1,0 микрометра с общим содержанием 2,8 миллиона пар нуклеотидов. Важной особенностью генома является то, что около 22 % его составляют некодирующие последовательности, что указывает на высокую вариабельность и адаптивные возможности бактерии.
Размножение осуществляется путём бинарного деления, при этом бактерия демонстрирует каталазоположительные свойства и не образует спор. Клетки неподвижны и способны к естественной генетической трансформации, хотя и с низкой частотой[2].
Распространение среди населения
Золотистый стафилококк демонстрирует широкое распространение в человеческой популяции. Согласно эпидемиологическим данным, от 25 до 40 % населения являются постоянными носителями данной бактерии. Носительство может быть как постоянным (около 20 % населения), так и периодическим (30 % населения), при этом около 33 % жителей США являются носителями различных штаммов стафилококка.
Основными местами колонизации служат кожные покровы и слизистые оболочки верхних дыхательных путей, особенно носовые ходы. У женщин бактерия может обнаруживаться в нижних отделах репродуктивного тракта. Особенно высокая частота обнаружения отмечается у пациентов с атопическим дерматитом, где она достигает 90 %.
Способность к длительному персистированию в организме позволяет микроорганизму находиться в состоянии покоя годами, активизируясь при благоприятных условиях. В активной фазе инфекции больной остаётся заразным в течение примерно двух недель после появления клинических симптомов[3].
Клинические проявления
Золотистый стафилококк занимает лидирующие позиции среди возбудителей внутрибольничных инфекций и способен вызывать широкий спектр патологических состояний. Клинические проявления варьируют от относительно лёгких поражений кожи и мягких тканей до жизнеугрожающих системных инфекций.
К поверхностным инфекциям относятся акне, импетиго, фурункулы, флегмоны и карбункулы. Более серьёзные формы включают абсцессы различной локализации, остеомиелит, эндокардит, пневмонию и менингит. Крайне тяжёлыми проявлениями являются септические состояния и инфекционно-токсический шок.
Особую опасность представляют штаммы, продуцирующие лейкоцидин Пантона-Валентайна, который ассоциирован с развитием тяжёлых некротизирующих пневмоний преимущественно у детей[4]. Без соответствующего антибактериального лечения летальность при бактериемии может достигать 80 %, тогда как при адекватной терапии этот показатель снижается до 15-50 %.
Пищевые токсикоинфекции характеризуются относительно коротким инкубационным периодом (30 минут — 8 часов) и обычно заканчиваются выздоровлением в течение 8-24 часов. На сегодняшний день идентифицировано 25 различных стафилококковых энтеротоксинов[5].
Факторы вирулентности
Вирулентность золотистого стафилококка обеспечивается многочисленными факторами агрессии, среди которых важное место занимают токсические субстанции. Альфа-токсин способен формировать ионные каналы в мембранах эритроцитов, лейкоцитов и искусственных липидных бислоях, что приводит к нарушению целостности клеточных структур.
Ферментативный комплекс включает:
- коагулазу, способствующую свёртыванию крови;
- гиалуронидазу (фактор распространения);
- дезоксирибонуклеазу, защищающую от внеклеточных ловушек нейтрофилов;
- липазу для расщепления липидов;
- стафилокиназу для растворения фибрина;
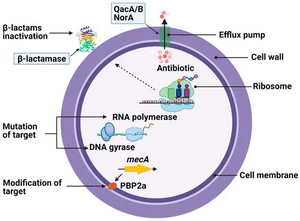
- бета-лактамазу, обеспечивающую резистентность к определённым антибиотикам.
Важную роль в патогенезе играет способность к образованию пенициллиназы — фермента, разрушающего молекулу пенициллина, что стало основой для развития антибиотикорезистентности[6].
Эпидемиологическая ситуация
Статистические данные свидетельствуют о масштабности проблемы стафилококковых инфекций. В Соединённых Штатах ежегодно регистрируется более 100 тысяч случаев инфицирования, при этом около 500 тысяч госпитализированных пациентов приобретают стафилококковую инфекцию, что приводит к 50 тысячам летальных исходов в год.
Метициллинрезистентные штаммы (MRSA) вызывают около 20 тысяч смертей ежегодно только в США, а общее количество инфекций кровотока, вызванных S. aureus, превышает 119 тысяч случаев в год. В 2019 году золотистый стафилококк занял второе место среди патогенов по смертности, связанной с антимикробной резистентностью.
Экономическое бремя инфекций, вызванных резистентными штаммами, составляет более 3,2 миллиарда долларов США ежегодно только для системы здравоохранения. Каждый случай MRSA-инфекции обходится в 23-46 тысяч долларов, при этом пациенты вынуждены находиться в стационаре на 6-11 дней дольше обычного[7].
Эволюция антибиотикорезистентности
Первые научные наблюдения за устойчивостью стафилококка к внешним воздействиям были сделаны в конце XIX века. В 1899 году русский исследователь Павел Лащенков обнаружил способность золотистого стафилококка к интенсивному размножению при температурах выше 37 °C, что стало одним из первых описаний адаптивных свойств патогена.
Физическая устойчивость микроорганизма проявляется в способности выживать при замораживании, в то время как тепловое воздействие вызывает гибель: при 78 °C — в течение одной минуты, при 64 °C — за десять минут.
Эра антибиотикотерапии началась в 1940-х годах с введения пенициллина, однако уже к концу того же десятилетия была отмечена широкая распространённость пенициллинрезистентных штаммов. В настоящее время в Великобритании лишь 2 % изолятов сохраняют чувствительность к пенициллину.
Для борьбы с пенициллинорезистентностью в 1959 году был внедрён метициллин, но уже в 1961 году в Англии был зарегистрирован первый случай метициллинрезистентного стафилококка. Дальнейшая эволюция резистентности привела к появлению штаммов, устойчивых к ванкомицину: первый случай промежуточной резистентности (VISA) был описан в Японии в 1996 году, а полная резистентность (VRSA) — в 2002 году. К 2005 году в США было зарегистрировано три случая VRSA-инфекций[8].
Современные методы терапии
Современная терапия стафилококковых инфекций сталкивается с серьёзными вызовами, связанными с множественной антибиотикорезистентностью. В 2003 году был одобрен дaптомицин — антибиотик с уникальным механизмом действия, эффективный против резистентных штаммов. Для лечения чувствительных штаммов по-прежнему применяются пенициллины, а при резистентности используются полусинтетические пенициллины (оксациллин, флуклоксациллин) или ванкомицин в зависимости от локальных особенностей резистентности.
Альтернативные методы лечения включают использование специфических бактериофагов, способных лизировать стафилококковые клетки. Показана эффективность металлотерапии: поверхности из меди и медных сплавов демонстрируют выраженное подавляющее действие против MRSA. Для топического применения широко используется мупироцин — ингибитор синтеза белка, который производится Pseudomonas fluorescens и показал эффективность при назальном носительстве S. aureus.
Профилактические стратегии включают местное применение мупироцина для снижения назального носительства, что может существенно уменьшить риск развития инфекций. Важно отметить, что некоторые штаммы проявляют устойчивость к хлорсодержащим дезинфектантам, что требует особого внимания при разработке санитарно-противоэпидемических мероприятий. Комбинированная терапия с гентамицином может применяться при тяжёлых инфекциях, хотя её использование ограничено высоким риском нефротоксичности[9].
Литература
- Базанов В. А. Большая медицинская энциклопедия. — 3-е изд. — М.: Советская энциклопедия, 1974–1989.
- Bowersox J. Experimental Staph Vaccine Broadly Protective in Animal Studies. — NIH.
- Krasilnikov O.V., Sabirov RZ. Ion transport through channels formed in lipid bilayers by Staphylococcus aureus alpha-toxin // General Physiology and Biophysics..
- Schlecht LM, Peters BM, Krom BP, et al. Systemic Staphylococcus aureus infection mediated by Candida albicans hyphal invasion of mucosal tissue // Microbiology.
- Tong SY, Davis JS, Eichenberger E, Holland TL, Fowler VG. Staphylococcus aureus infections: epidemiology, pathophysiology, clinical manifestations, and management // Clinical Microbiology Reviews.
Примечания
- ↑ Трубачева Е.С. Стафилококк золотистый. Микробиологические аспекты. ВИДАЛЬ. Дата обращения: 8 сентября 2025.
- ↑ Ганина Е.Б. [https://gabrich.ru/assets/files/gan-diss.pdf Характеристика биологических свойств STAPHYLOCOCCUS AUREUS]. — Тверь, 2021. — С. 10—15. — 136 с.
- ↑ Яковлева Е.Н. Носительство золотистого стафилококка. ФБУЗ «Центр гигиены и эпидемиологии в Чувашской Республике- Чувашии». Дата обращения: 8 сентября 2025.
- ↑ Di Bella S, Marini B, Stroffolini G, et al. The virulence toolkit of Staphylococcus aureus: a comprehensive review of toxin diversity, molecular mechanisms, and clinical implications (англ.) // European Journal of Clinical Microbiology & Infectious Diseases. — 2005. — doi:10.1007/s10096-025-05148-y.
- ↑ Романов А.В. , Чернов E.A., Эйдельштейн М.В. Молекулярная эпидемиология внутрибольничных золотистых стафилококков в стационарах различных регионов России // НИИ антимикробной химиотерапии : журнал. — 2013. — Апрель. — С. 55—64.
- ↑ Литусов Н.В. Грамположительные аэробные кокки. — Екатеринбург: ГБОУ ВПО УГМУ, 2016. — С. 4—34. — 8 с.
- ↑ Таран Т..В. Пиогенные кокки. RABIES. Дата обращения: 8 сентября 2025.
- ↑ Базанов В. А. Лащенков Павел Николаевич. Большая медицинская энциклопедия / гл. ред. Б. В. Петровский. — 3-е изд.. — М.: Советская энциклопедия, 1974–1989. — Т. 12.
- ↑ Сидоренко С.В., Тишков В.И. Молекулярные основы резистентности к антибиотикам // Успехи биологической химии : журнал. — 2004. — Т. 44. — С. 263—306.
Ссылки
- «Золотистые и смертоносные» Архивная копия от 31 декабря 2007 на Wayback Machine — статья в журнале «Вокруг Света»
- StopMRSANow.org — Discusses how to prevent the spread of MRSA
- «Staphylococcus aureus». NCBI Taxonomy Browser. 1280.
- Packham C (16 March 2015). «Successful in vivo test of breakthrough Staphylococcus aureus vaccine». Medical Press. Archived from the original on 19 September 2012. Retrieved 18 March 2015.
- Type strain of Staphylococcus aureus at BacDive — the Bacterial Diversity Metadatabase