Пробиотики
Пробио́тики — живые биологические агенты, которые при поступлении в организм в достаточном количестве способны оказывать благоприятное воздействие на здоровье человека[1]. Эта область биомедицинской науки объединяет микробиологию, иммунологию и диетологию, формируя междисциплинарный подход к изучению взаимодействия микроорганизмов с человеческим организмом. В основе концепции пробиотиков лежит понимание того, что человеческий организм представляет собой сложную экосистему, в которой триллионы микроорганизмов играют ключевую роль в поддержании здоровья. Современные исследования показывают, что правильно подобранные штаммы могут влиять не только на пищеварение, но и на иммунную систему, метаболизм и даже психоэмоциональное состояние человека.
Происхождение термина
Слово «пробиотик» имеет составную этимологическую структуру, объединяющую латинский предлог pro (означающий «для» или «в пользу») с греческим прилагательным βιωτικός (биотикос), которое переводится как «подходящий для жизни» или «живой»[2]. Данное словообразование отражает основную концепцию этих микроорганизмов как агентов, поддерживающих жизненные процессы.
Классификация и характеристика
Современная наука выделяет несколько ключевых таксономических групп пробиотических организмов. К основным семействам относятся лактобациллы, бифидобактерии, пропионовокислые бактерии, а также специфические виды стрептококков и лактококков[3]. Важно отметить, что значительная часть пробиотических штаммов принадлежит к группе молочнокислых бактерий, хотя эта классификация не является всеобъемлющей[1].
Российская нормативная база определяет пробиотики как функциональные пищевые ингредиенты, состоящие из полезных непатогенных микроорганизмов. Эти биологические агенты обеспечивают нормализацию состава кишечной микрофлоры и повышение её биологической активности при систематическом употреблении.
История изучения
Пионерские исследования
Научные основы современной пробиотической теории были заложены в начале XX столетия выдающимся русским учёным и нобелевским лауреатом Ильёй Мечниковым[4]. Его революционная гипотеза предполагала, что молочнокислые бактерии способны продлевать жизнь человека и улучшать его общее состояние здоровья. Мечников разработал концепцию кишечной аутоинтоксикации, согласно которой процессы старения можно замедлить путём модификации кишечной микробиоты и замещения вредных протеолитических микробов полезными организмами.
Практическое применение этих идей началось с изучения болгарского йогурта, содержащего специальный штамм бактерий. В 1905 году болгарский врач и микробиолог Стамен Григоров выделил и описал Lactobacillus bulgaricus — первый научно задокументированный пробиотический штамм[5]. Это открытие стало отправной точкой для систематического изучения благотворного воздействия ферментированных молочных продуктов на человеческий организм.
Развитие штаммового разнообразия
Дальнейшее развитие пробиотической науки характеризовалось расширением спектра изучаемых микроорганизмов[1]. В 1917 году немецкий учёный Альфред Ниссле изолировал непатогенный штамм Escherichia coli, получивший название E. coli Nissle 1917. Этот штамм стал примером использования немолочнокислых бактерий в качестве пробиотических агентов.
Параллельно французский исследователь Анри Тиссье в Институте Пастера проводил работы по изоляции бифидобактерий из кишечной микрофлоры грудных детей. Он выдвинул гипотезу о возможности замещения патогенных протеолитических бактерий полезными бифидобактериями для лечения детской диареи.
Японский врач Минору Сирота внёс значительный вклад в практическое применение пробиотиков, изолировав штамм Lactobacillus casei Shirota для борьбы с кишечными расстройствами. Этот штамм используется в коммерческих пробиотических продуктах с 1935 года.
Современное научное определение пробиотиков было сформулировано британским микробиологом Роем Фуллером в 1989 году[6]. Он определил пробиотики как «живые микробные пищевые добавки, которые благотворно влияют на организм-хозяин путём улучшения его кишечного микробного баланса». Это определение подчёркивает два ключевых аспекта: необходимость жизнеспособности микроорганизмов и их способность поддерживать кишечное равновесие.
Механизмы воздействия
Иммунологические эффекты
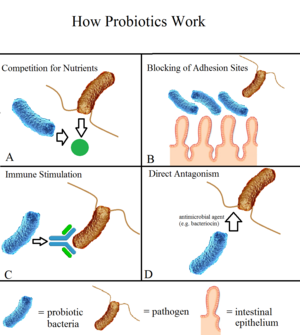
Пробиотические микроорганизмы оказывают многостороннее воздействие на иммунную систему человека через различные механизмы[7]. Одним из ключевых эффектов является активация локальных макрофагов, что приводит к усилению презентации антигенов B-лимфоцитам и увеличению продукции секреторного иммуноглобулина А как на местном, так и на системном уровне.
Важным аспектом иммуномодулирующего действия является способность пробиотиков влиять на цитокиновый профиль организма. Они способствуют балансировке провоспалительных и противовоспалительных сигналов, что особенно важно при воспалительных заболеваниях кишечника. Дополнительно пробиотики индуцируют толерантность к пищевым антигенам, снижая риск развития пищевых аллергий.
Клеточный иммунитет также подвергается положительным изменениям под воздействием пробиотических штаммов. Наблюдается увеличение количества иммуноглобулин А-продуцирующих плазматических клеток, усиление фагоцитарной активности и рост доли Т-лимфоцитов и естественных клеток-киллеров в иммунном ответе.
Метаболические процессы
Пробиотические бактерии активно участвуют в процессах пищеварения, конкурируя с патогенными микроорганизмами за питательные вещества[8]. Они способны модифицировать локальный кислотно-щелочной баланс, создавая неблагоприятную среду для роста болезнетворных бактерий.
Особое значение имеет способность пробиотиков синтезировать бактериоцины — природные антимикробные пептиды, которые специфически подавляют рост патогенных микроорганизмов. Эти вещества действуют как естественные антибиотики, не нарушая при этом нормальную микрофлору.
Антиоксидантная активность пробиотиков проявляется в их способности нейтрализовать супероксидные радикалы и другие активные формы кислорода, что способствует защите клеток кишечника от окислительного стресса. Метаболические изменения включают модификацию углеводного обмена с изменением абсорбции короткоцепочечных жирных кислот.
Барьерная функция кишечника
Пробиотические микроорганизмы играют ключевую роль в поддержании и укреплении кишечного барьера. Они стимулируют эпителиальную продукцию муцина — защитного слизистого секрета, который образует физический барьер между содержимым кишечника и эпителиальными клетками[4].
Конкурентное ингибирование представляет собой важный механизм защиты, при котором пробиотики конкурируют с патогенными микроорганизмами за места адгезии на кишечном эпителии. Это предотвращает колонизацию кишечника болезнетворными бактериями и снижает риск развития инфекционных заболеваний.
Дополнительным защитным механизмом является способность пробиотиков модифицировать токсины, вырабатываемые патогенными микроорганизмами, нейтрализуя их вредное воздействие на организм хозяина.
Клиническая эффективность
Методологические ограничения
Научная оценка эффективности пробиотических препаратов сталкивается с серьёзными методологическими ограничениями. Согласно позиции Американской гастроэнтерологической ассоциации, к 2008 году накопленные научные данные были недостаточными для определения оптимальных пробиотических штаммов для конкретных медицинских состояний[9].
Основной проблемой является высокая вариабельность состава пробиотических препаратов между различными лабораториями и производителями. Даже при использовании одинаковых штаммов живых бактерий, окончательный состав продукта может существенно различаться, что затрудняет сравнение результатов исследований.
Критическим аспектом является невозможность экстраполяции результатов, полученных для одного штамма, на другие штаммы того же вида или рода. Эффекты пробиотиков являются высокоспецифичными для конкретного штамма, что требует индивидуальной оценки каждого пробиотического продукта.
Респираторные инфекции
Систематический анализ влияния пробиотиков на респираторные заболевания выявил умеренные положительные эффекты. Кохрейновский метаобзор продемонстрировал небольшой защитный эффект пробиотических препаратов в сравнении с плацебо для профилактики острых инфекций верхних дыхательных путей[10].
Важно отметить, что качество исходных исследований было оценено как низкое или очень низкое, что ограничивает возможность формулирования окончательных выводов. Побочные эффекты пробиотической терапии оказались минимальными и в основном ограничивались незначительными желудочно-кишечными симптомами.
Анализ воздействия на пожилых пациентов показал отсутствие значимого влияния пробиотиков на риск развития инфекционных заболеваний в этой возрастной группе, что может быть связано с возрастными изменениями иммунной системы.
Антибиотико-ассоциированная диарея
Наиболее убедительные доказательства эффективности пробиотиков получены в области профилактики и лечения антибиотико-ассоциированной диареи. Масштабный клинический обзор, включивший анализ восьмидесяти двух рандомизированных исследований, подтвердил эффективность пробиотической терапии как при лёгких, так и при тяжёлых формах диареи, вызванной Clostridium difficile[11].
Механизм развития антибиотико-ассоциированной диареи связан с нарушением баланса толстокишечной микробиоты под воздействием антибиотических препаратов. Это приводит к изменениям углеводного метаболизма, снижению абсорбции короткоцепочечных жирных кислот и развитию осмотической диареи.
От 11 % до 40 % детей, получающих антибиотики, развивают диарею. Кохрейновский обзор 2019 года подтвердил наличие защитного эффекта некоторых пробиотических штаммов для предотвращения антибиотико-ассоциированной диареи у детей. Особую эффективность продемонстрировали Lactobacillus rhamnosus и Saccharomyces boulardii в дозировках от 5 до 40 миллиардов колониеобразующих единиц в день.
Ограничения доказательной базы
Критический анализ накопленных научных данных выявляет существенные пробелы в доказательной базе пробиотической терапии. Согласно систематическому обзору 2011 года, на тот момент отсутствовали убедительные научные доказательства способности пробиотиков предотвращать заболевания или улучшать общее состояние здоровья[12].
Основные ограничения связаны с недостаточным количеством качественных исследований для большинства пробиотических штаммов. Даже наиболее изученные штаммы не получили одобрения регулирующих органов, таких как FDA или Европейское агентство по безопасности пищевых продуктов, для заявлений о пользе для здоровья.
Эксперты высказывают скептицизм относительно эффективности различных пробиотических штаммов и отмечают, что не все люди получают пользу от пробиотической терапии. Индивидуальная вариабельность ответа на пробиотики остаётся плохо изученной областью.
Метаболические эффекты
Исследования влияния пробиотиков на липидный профиль крови дали ограниченные, но обнадёживающие результаты. Метаанализ 2002 года, включивший пять двойных слепых исследований краткосрочного применения йогурта с пробиотическими штаммами, выявил умеренное снижение уровня общего холестерина на 8,5 мг/дл и холестерина ЛПНП на 7,7 мг/дл[13].
Хотя эти изменения статистически значимы, их клиническая значимость остаётся предметом дебатов. Необходимы долгосрочные исследования для оценки устойчивости этих эффектов и их влияния на сердечно-сосудистые исходы.
Исследования гликемического контроля показывают, что пробиотические добавки могут влиять на гомеостаз глюкозы, потенциально снижая уровень сахара в крови. Однако требуется осторожность для предотвращения развития гипогликемии, особенно у пациентов с диабетом.
Регулирование и коммерциализация
Международные подходы
Регулирование пробиотических продуктов значительно различается между странами и регионами[14]. Европейское агентство по безопасности пищевых продуктов занимает строгую позицию, отклонив к 2019 году все заявки коммерческих производителей на одобрение заявлений о пользе пробиотиков для здоровья из-за недостаточности доказательств причинно-следственных связей.
Европейская комиссия установила запрет на использование термина «пробиотик» на упаковке продуктов, поскольку такая маркировка может вводить потребителей в заблуждение относительно доказанной пользы для здоровья. Эта позиция отражает высокие стандарты доказательности, требуемые европейскими регулирующими органами.
В Соединённых Штатах FDA и Федеральная торговая комиссия выдают предупредительные письма и налагают штрафы на производителей пробиотических продуктов, которые делают необоснованные заявления о лечении заболеваний. Один из крупнейших штрафов в размере 21 миллиона долларов был наложен объединёнными усилиями 39 правительств штатов на крупного производителя за обманную рекламу и преувеличенные заявления о пользе йогурта и пробиотических напитков.
Рыночная динамика
Мировой рынок пробиотиков демонстрирует устойчивый рост, достигнув в 2015 году оборота в 41 миллиард долларов США[15]. Структура рынка характеризуется доминированием ферментированных молочных продуктов, особенно йогурта, который составляет около 75 % общего потребления пробиотических продуктов.
Сегмент пищевых добавок показывает наиболее динамичный рост, достигнув оборота в 4 миллиарда долларов в 2015 году с прогнозируемым ростом на 37 % к 2020 году. Региональные различия в потреблении особенно заметны в Китае, где потребление йогуртовых продуктов увеличивается на 20 % ежегодно с 2014 года.
Инновации в области пробиотических продуктов сосредоточены преимущественно в сфере диетических добавок, включая разработку новых форм выпуска, таких как капсулы, таблетки и порошки с лиофилизированными бактериями.
Безопасность применения
Группы риска
Хотя пробиотики в целом считаются безопасными для здорового населения, определённые группы пациентов подвержены повышенному риску развития нежелательных реакций[16]. К группам высокого риска относятся пациенты с иммунодефицитными состояниями, синдромом короткой кишки, наличием центральных венозных катетеров и заболеваниями сердечных клапанов.
Особую осторожность следует проявлять при назначении пробиотиков недоношенным младенцам и детям с критическими заболеваниями. У этих пациентов существует риск развития бактериемии или фунгемии — попадания живых микроорганизмов в кровоток, что может привести к сепсису и другим жизнеугрожающим осложнениям.
Пациенты с тяжёлыми воспалительными заболеваниями кишечника подвержены риску бактериальной транслокации — проникновения жизнеспособных бактерий из желудочно-кишечного тракта во внутренние органы, что может вызвать серьёзные инфекционные осложнения.
Нежелательные эффекты
Наиболее частые побочные эффекты пробиотической терапии связаны с желудочно-кишечными расстройствами и включают вздутие живота, повышенное газообразование и диарею. Эти симптомы обычно носят временный характер и исчезают при продолжении терапии или снижении дозировки[16].
Избыточное потребление пробиотиков может привести к ятрогенному синдрому избыточного бактериального роста в тонкой кишке, особенно у предрасположенных пациентов. Стандартные пробиотические добавки содержат от одного до десяти миллиардов колониеобразующих единиц на дозу, и превышение этих количеств не обеспечивает дополнительной пользы.
Редко встречающиеся серьёзные осложнения включают развитие оппортунистических инфекций у иммунокомпрометированных пациентов и потенциальную активацию сигнальных путей, связанных с аутоиммунными расстройствами или онкологическими заболеваниями.
Пищевые источники
Традиционные ферментированные продукты
История использования ферментированных продуктов насчитывает тысячелетия и охватывает различные культуры и цивилизации[17]. Археологические данные свидетельствуют об использовании кефира и дрожжевого брожения уже в 5000 году до нашей эры, что делает эти технологии одними из древнейших биотехнологических процессов.
Современная классификация ферментированных продуктов включает широкий спектр пищевых источников пробиотических микроорганизмов. Овощные ферментированные продукты представлены квашеной капустой, кимчи, маринованными овощами и китайским пао кай. Зерновые продукты включают хлеб на закваске и различные ферментированные каши.
Соевые ферментированные продукты, такие как темпе, мисо и соевый соус, содержат разнообразные пробиотические культуры и являются важным источником растительных пробиотиков. Молочные продукты традиционно представлены йогуртом, кефиром и пахтой, которые содержат живые активные культуры.
Микробиологическое разнообразие
Квашеная капуста характеризуется сложным микробиологическим составом, включающим Leuconostoc mesenteroides, Lactobacillus plantarum, Pediococcus pentosaceus, Lactobacillus brevis и различные виды Weissella. Корейское кимчи содержит преимущественно представителей родов Leuconostoc, Weissella и Lactobacillus[17].
Кефир отличается особенно богатым микробиологическим составом, включающим Lactobacillus acidophilus, Bifidobacterium bifidum, Streptococcus thermophilus, Lactobacillus helveticus и множество других штаммов. Этот продукт представляет собой естественный пробиотический консорциум с синбиотическими свойствами.
Комбуча, ферментированный чайный напиток, содержит уникальную комбинацию бактерий и дрожжей, включая Gluconacetobacter xylinus, различные виды Acetobacter и Gluconobacter. Этот продукт демонстрирует пример симбиотических отношений между различными микроорганизмами.
Технологические аспекты
Производство и контроль качества
Современное производство пробиотических продуктов сталкивается с техническими вызовами, связанными с поддержанием жизнеспособности микроорганизмов[18]. Разработка методов микроинкапсулирования направлена на защиту пробиотических бактерий от кислой среды желудка и обеспечение их доставки в толстую кишку.
Стабильность пробиотических продуктов критически зависит от условий хранения. Исследования показывают драматическое снижение жизнеспособности пробиотиков при комнатной температуре по сравнению с охлаждением. При температуре 25 °C количество жизнеспособных бактерий может уменьшиться на 5-6 логарифмических единиц в течение 90 дней хранения.
Контроль качества пробиотических продуктов осложняется отсутствием единых стандартов маркировки. Большинство производителей указывают количество жизнеспособных клеток на момент производства, а не в конце срока годности, что может вводить потребителей в заблуждение относительно реальной эффективности продукта.
Формы выпуска
Пробиотические препараты выпускаются в различных формах: жидкие продукты, сухие лиофилизированные препараты, таблетки, капсулы и пакетики с сублимированными бактериями. Каждая форма имеет свои преимущества и ограничения в плане стабильности, биодоступности и удобства применения[18].
Комбинированные препараты могут содержать помимо пробиотических штаммов дополнительные активные компоненты: лизоцим, инулин, действующие вещества лекарственных растений, витамины, микроэлементы. Такие препараты оказывают комплексное терапевтическое воздействие на организм человека.
Перспективы развития
Персонализированная терапия
Развитие геномных технологий и методов анализа микробиоты открывает возможности для персонализированного подбора пробиотических штаммов[19]. Индивидуальная вариабельность состава кишечной микрофлоры требует дифференцированного подхода к выбору оптимальных пробиотических вмешательств.
Концепция «респондеров» и «нон-респондеров» на пробиотическую терапию становится центральной в современных исследованиях. Идентификация биомаркеров, предсказывающих эффективность конкретных штаммов для отдельных пациентов, может революционизировать область пробиотической медицины.
Мультиштаммовые пробиотические препараты представляют перспективное направление, поскольку человеческая кишечная микробиота содержит десятки тысяч видов микроорганизмов. Теоретически, использование нескольких штаммов может более эффективно имитировать естественное микробиологическое разнообразие.
Новые области применения
Исследования связи между кишечной микробиотой и нейродегенеративными заболеваниями открывают новые терапевтические возможности. Пробиотические подходы к профилактике и лечению болезни Альцгеймера, болезни Паркинсона и других неврологических состояний находятся на ранних стадиях изучения[20].
Офтальмологические применения пробиотиков, включая лечение синдрома сухого глаза, представляют собой инновационную область исследований. Предварительные результаты показывают потенциал некоторых штаммов для улучшения состояния глазной поверхности при местном применении.
Урогенитальная медицина также рассматривает пробиотические вмешательства как альтернативу традиционной антибиотической терапии бактериального вагиноза и рецидивирующих инфекций мочевыводящих путей.
Интеграция в медицинскую практику
Интеграция пробиотических технологий в клиническую практику требует разработки строгих протоколов оценки эффективности и безопасности. Необходимость проведения крупномасштабных долгосрочных исследований становится всё более очевидной для установления чётких клинических рекомендаций.
Образовательные программы для медицинских работников должны включать современные знания о механизмах действия пробиотиков, показаниях и противопоказаниях к их применению. Это особенно важно в контексте растущего интереса пациентов к пробиотической терапии и необходимости предоставления научно обоснованных рекомендаций[20].
Стандартизация методов оценки качества пробиотических продуктов остаётся критически важной задачей для обеспечения воспроизводимости результатов и защиты интересов потребителей. Разработка международных стандартов маркировки и контроля качества могла бы значительно улучшить ситуацию в этой области.
Литература
- Probiotics and prebiotics / World Gastroenterology Organisation Global Guidelines, February 2017 («Пробиотики и пребиотики» / Глобальные практические рекомендации Всемирной Гастроэнтерологической Организации, февраль 2017).
- Зайков, С. В. Нарушения микробиоценоза кишечника: всегда ли необходимы пробиотики?: [арх. 5 июля 2008] // Рациональная фармакотерапия: журн. — 2008. — № 2. — С. 1−6.
- Шендеров, Б. А. Медицинская микробная экология и функциональное питание: в 3 т. — М.: ГРАНТЪ, 2001. — Т. 3: Пробиотики и функциональное питание : Биоплёнка. Кожа и слизистые. Иммун. механизмы. — 287 с.
- Перспективы практической реализации биотехнологического потенциала пробиотических микроорганизмов / Хамагаева И. С.; Крючкова И. // Региональный рынок товаров и услуг: инновационные технологии и организация бизнеса : Международная научно-практическая конференция, 30-31 октября 2008 г.: материалы конференции : сб. / М-во пищевой пром-сти и потребительского рынка Хабаровского края, М-во образования и науки Российской Федерации, Федеральное агентство по образованию, Гос. образовательное учреждение высш. проф. образования «Хабаровская гос. акад. экономики и права», Коммерческий фак., Хабаровская междунар. ярмарка; [редкол.: С. И. Лопатин и др.]. — Хабаровск : ХГАЭП, 2008. — Ч. 2. — С. 323—327.
- Белоусова, Е. А. Всемирный конгресс по гастроэнтерологии (Монреаль, 2005): [арх. 1 марта 2014] // Фарматека: журн. — 2006. — № 1. — С. 3.
- Джереми Тейлор. Здоровье по Дарвину: Почему мы болеем и как это связано с эволюцией = Jeremy Taylor «Body by Darwin: How Evolution Shapes Our Health and Transforms Medicine». — М.: Альпина Паблишер, 2016. — 333 с.
- ГОСТ Р 52349-2005: Продукты пищевые. Продукты пищевые функциональные. Термины и определения. — С изменением N1. — М. : АО «Кодекс», 2010.
- ГОСТ Р 56139-2014: Продукты пищевые функциональные. Методы определения и подсчёта пробиотических микроорганизмов. — М. : Стандартинформ, 2015.
- English-Russian Glossary of Key Terms on Vaccinology and Immunization — Англо-русский глоссарий основных терминов по вакцинологии и иммунизации : [арх. 16 июня 2010] / WHO Regional Office for Europe. — Женева : ВОЗ, 2009. — 110 с.
- Пробиотики и пребиотики: Глобальные практические рекомендации Всемирной Гастроэнтерологической Организации : [арх. 31 октября 2017] = WGO Global Guideline Probiotics and prebiotics. World Gastroenterology Organisation, 2017 : обзор / Авторы обзора ВГО Francisco Guarner (Председатель, Испания), Mary Ellen Sanders (Сопредседатель, США), Rami Eliakim (Израиль), Richard Fedorak (Канада), Alfred Gangl (Австрия), James Garisch (Южная Африка), Pedro Kaufmann (Уругвай), Tarkan Karakan (Турция), Aamir G. Khan (Пакистан), Nayoung Kim (Южная Корея), Juan Andrés De Paula (Аргентина), Balakrishnan Ramakrishna (Индия), Fergus Shanahan (Ирландия), Hania Szajewska (Польша), Alan Thomson (Канада), Anton Le Mair (Нидерланды). Приглашённые эксперты Dan Merenstein (США), Seppo Salminen (Финляндия). — Всемирная организация гастроэнтерологов, 2017.
- Суворов, А. Н. Микробиота пожилых : истоки долголетия / Александр Николаевич Суворов // Природа : журн. — 2017. — № 1. — С. 22-29.
- Суворов, А. Н. Полезные микробы — кто они? / Александр Николаевич Суворов // Природа : журн. — 2009. — № 7. — С. 21-30.
- Суворов, А. Н. Мир микробов и человек // Природа. 2015. № 5. С. 11-19. / Александр Николаевич Суворов // Природа : журн. — 2015. — № 5. — С. 11-19.
Примечания
- ↑ 1,0 1,1 1,2 Андреев, Игорь Леонидович. Человек и бактериальный мир: проблемы взаимодействия // Вестник РАН : журнал. — 2009. — Январь.
- ↑ Макарова С.Г. Что такое пробиотики, пребиотики, синбиотики, симбиотики и постбиотики. НЦЗД (2021).
- ↑ ГОСТ Р 56139-2014, 2015.
- ↑ 4,0 4,1 Шендеров, Б. А. Медицинская микробная экология и функциональное питание: в 3 т.. — М.: ГРАНТЪ, 2001. — Т. 3. Пробиотики и функциональное питание : Биоплёнка. Кожа и слизистые. Иммун. механизмы.. — С. 287.
- ↑ Brown AC, Valiere A. Probiotics and Medical Nutrition Therapy // Nutrition in Clinical Care : журнал. — 2004. — № 7. — С. 56–68.
- ↑ Fuller R. Probiotics in man and animals // The Journal of Applied Bacteriology : журнал. — 1989. — 5 66. — С. 365–378. — doi:10.1111/j.1365-2672.1989.tb05105.x.
- ↑ Корниенко Е. А., Нетребенко О. К. Пробиотики: механизмы действия и показания в соответствии с международными рекомендациями в педиатрии. Педиатрия, 2018.
- ↑ Тараканов Б.В. Механизмы действия пробиотиков на микроэкологию пищеварительного тракта. ВЕТОМ (2000).
- ↑ D’Arrigo, Terri. Probiotics : What They Are and What They Can Do for You : [арх. 5 июня 2010] / Reviewed by Richard Fedorak, John I. Allen, Linda A. Lee. — American Gastroenterological Association, 2008.
- ↑ Hao, Qiukui. Probiotics for preventing acute upper respiratory tract infections // Cochrane Database of Systematic Reviews / Qiukui Hao, Bi Rong Dong, Taixiang Wu. — 2015. — Февраль (№ 2). — doi:10.1002/14651858.CD006895.pub3.
- ↑ Hempel, S. Probiotics for the Prevention and Treatment of Antibiotic-Associated Diarrhea : A Systematic Review and Meta-analysis // JAMA : журнал / S. Hempel, S. J. Newberry, A. R. Maher … [et al.]. — 2012. — Май (№ 18). — С. 1959–1969. — doi:10.1001/jama.2012.3507.
- ↑ Rijkers, G. T. Health benefits and health claims of probiotics : Bridging science and marketing // British Journal of Nutrition : журнал / G. T. Rijkers, W. M. de Vos, R. J. Brummer. — 2011. — Ноябрь (№ 106). — С. 1291–1296. — doi:10.1017/S000711451100287X.
- ↑ Agerholm-Larsen L, Bell ML, Grunwald GK, et al. The effect of a probiotic milk product on plasma cholesterol: a meta-analysis of short term intervention studies // European Journal of Clinical Nutrition : журнал. — 2002. — Ноябрь (№ 54). — С. 856–860. — doi:10.1038/sj.ejcn.1601104.
- ↑ Погожева А.В., Шевелева С.А., Маркова Ю.М. Роль пробиотиков в питании здорового и больного человека. Лечащий врач (2017).
- ↑ Feldman M. The New Market Profile of Probiotics Consumption. Natural Products Insider, 2016
- ↑ 16,0 16,1 Андреева И.В. Эффективность пробиотиков при инфекциях желудочно-кишечного тракта. Доктор Ру (2015).
- ↑ 17,0 17,1 Федеральная служба по надзору в сфере защиты прав потребителей. Пребиотики, пробиотики и синбиотики: разобраться и найти отличия. ФБУЗ, 2021.
- ↑ 18,0 18,1 Бондаренко В. М. Молекулярно-клеточные механизмы терапевтического действия пробиотических препаратов. Фарматека (2010).
- ↑ Юдина Ю.В., Корсунский А.А., Аминова А.И. Микробиота кишечника как отдельная система организма. Доказательная гастроэнтерология (2019).
- ↑ 20,0 20,1 Суворов, А. Н. Полезные микробы — кто они? // Природа : жкрнал. — 2009. — № 7. — С. 21–30.