Почечный диализ
По́чечный диа́лиз (от греческого διάλυσις, диализ, «растворение»; от διά, dia, «через» и λύσις, лизис, «разрыхление или расщепление») — способ заместительной почечной терапии, направленный на удаление из крови избыточной воды, растворённых продуктов обмена веществ и уремических токсинов при утрате нормальной работы почек[1]. Процедура проводится аппаратами, фильтрующими кровь через полупроницаемую мембрану («искусственная почка»).
История развития метода
Процесс диффузии кристаллоидов через пергаментную бумагу был описан и назван диализом в середине XIX века (Thomas Graham)[2]. Эти ранние исследования продемонстрировали взаимосвязь скорости диффузии растворённого вещества с размером его молекулы: чем крупнее молекула, тем медленнее скорость диффузии.
Первые попытки создания аппарата для внепочечного очищения крови относятся к 1912—1913 годам, когда исследователи в фармакологической лаборатории Медицинской школы Джонса Хопкинса в Балтиморе продемонстрировали в экспериментах на животных возможность удаления из организма продуктов жизнедеятельности путём диализа. Леонард Раунтри и Джон Абель разработали первую экспериментальную диализную систему, которую успешно испытали на лабораторных животных[3].
В октябре 1924 года немецкий врач Георг Хаас провёл первый гемодиализ человеку, страдавшему уремией[4]. В качестве антикоагулянта использовался очищенный гирудин[4], антигенные свойства которого не позволяли проводить диализ более 30-60 минут. В 1925 году Хаас после многочисленных неудач смог получить первую партию гепарина. В экспериментах на животных он выявил высокую эффективность препарата и в 1927 году впервые применил его при гемодиализе у пациента. Хаас разработал диализатор с большой поверхностью мембраны (1,5-2,1 м2), нашёл рабочую мембрану с адекватным распределением крови, стал применять насос для перфузии крови.
17 марта 1943 года голландский терапевт Виллем Йохан (Пим) Колф (Кольф) начал лечение первого пациента с почечной недостаточностью с применением созданного им аппарата. Устройство представляло собой вращающийся барабан, на который наматывалась целлофановая трубка длиной 30-40 метров[5]. Нижняя часть барабана, вращающегося в горизонтальной плоскости, погружалась в стационарный резервуар, содержащий 70 литров (позднее 100 литров) диализирующего раствора[5]. Барабан приводился в движение мотором от швейной машинки. Первыми в истории диализными мембранами стали целлофановые оболочки, заимствованные у производителей колбасных изделий[5].
С 17 марта 1943 года по 27 июля 1944 года на аппарате Кольфа лечилось 16 пациентов, только один из них выжил[5]. Это был мужчина, леченный сульфаниламидами от крупозной пневмонии. Анурия на фоне терапии сульфаниламидами была в то время частым осложнением. Пациенту провели одну процедуру гемодиализа со снижением концентрации мочевины крови. На следующий день мочеточники были разблокированы от сульфаниламидных кристаллов, у пациента восстановился диурез. В 1945 году 67-летняя женщина в коме пришла в сознание после 11,5 часов гемодиализа с применением диализатора Кольфа и прожила ещё семь лет[5].
В 1962 году в Сиэтле открылся первый в мире медицинский центр, предоставляющий терапию гемодиализом в Соединённых Штатах Америки[6]. С 1963 по 1980 годы технические характеристики устройств существенно улучшились, появилась возможность сократить время процедур с 8 до 4 часов, а их частоту — до 2-3 раз в неделю[6]. Первые плоские диализаторы представляли собой многокилограммовые устройства на специальных столах. Позднее производство диализных мембран из целлюлозы было заменено применением полностью синтетических либо модифицированных целлюлозных мембран. Современные полусинтетические и синтетические мембраны по характеристикам различаются незначительно, каждая имеет широкий спектр вариантов исполнения.
Физиологические основы
Кровь пациента протекает по одну сторону полупроницаемой мембраны диализатора, а диализирующий раствор — по другую. Процесс очищения основан на принципе диффузии: растворённые вещества перемещаются из зоны с высокой концентрацией в зону с низкой концентрацией[7]. Мембрана пропускает воду и растворённые в ней низкомолекулярные соединения, но задерживает клеточные элементы крови и крупные белковые молекулы[7].
Для поддержания максимального градиента концентрации кровь и диализирующий раствор движутся навстречу друг другу[8]. Состав диализата подбирается таким образом, чтобы концентрации калия и кальция были близки к физиологическим значениям[9]. В организме уремические токсины распределены между различными водными секторами: объём крови составляет приблизительно 5 литров, межклеточной жидкости — около 10 литров, внутриклеточной жидкости — около 15 литров[10]. Для выравнивания концентраций между этими пространствами требуется определённое время, что обуславливает необходимость достаточной продолжительности сеанса и объясняет феномен диализного дизэквилибриума[10].
Показания к началу терапии
Экстренными показаниями к началу диализа служат тяжёлая азотемия, опасная гиперкалиемия, интоксикации диализируемыми веществами (салицилаты, литий, изопропанол, магний при передозировке слабительных средств, этиленгликоль), рефрактерная перегрузка жидкостью, осложнения уремии (перикардит, энцефалопатия, желудочно-кишечное кровотечение)[11].
При хронической уремии либо её декомпенсации диализ начинают при наличии признаков эндотоксикоза: слабость, недомогание, тошнота, рвота, головная боль, субфебрильная температура, нестабильная гемодинамика. Нарушение водно-электролитного обмена проявляется гипергидратацией с отёками, высоким артериальным давлением, угрозой отёка лёгких. Биохимическими критериями служат калий плазмы выше 6,5 ммоль/л, мочевина выше 30 ммоль/л, креатинин выше 0,7 ммоль/л, скорость клубочковой фильтрации менее 10 мл/мин (у больных сахарным диабетом и детей менее 15 мл/мин)[11][12].
При метаболическом ацидозе показаниями являются pH менее 7,35, стандартные бикарбонаты менее 20 ммоль/л, дефицит оснований менее −10 ммоль/л. К угрожающим состояниям относятся отёк головного мозга либо лёгких, уремическая предкома или кома. При хроническом течении заболевания предпочтительно откладывать начало диализа до снижения расчётной скорости клубочковой фильтрации до 5-9 мл/мин на 1,73 м2 при появлении симптоматики[12]. Раннее начало при расчётной скорости клубочковой фильтрации выше 10 мл/мин не продемонстрировало преимуществ и может причинять вред[13].
Противопоказания
Абсолютными противопоказаниями к программному гемодиализу являются агональное состояние либо необратимая полиорганная недостаточность, необратимые психические расстройства, злокачественные новообразования с множественными отдалёнными метастазами, письменный отказ пациента с оформлением решения консилиума[12].
Относительными противопоказаниями служат гиповолемия и гипотония, геморрагический синдром любого происхождения, активные инфекции (включая активный туберкулёз), онкологические заболевания без метастазов, кратковременные психические нарушения, временный отказ пациента от лечения[12]. При наличии относительных противопоказаний решение о начале диализа принимается индивидуально с учётом тяжести состояния пациента и возможности коррекции выявленных нарушений. Временный отказ пациента от лечения фиксируется в медицинской документации с последующим проведением разъяснительной работы о необходимости терапии[14]. При онкологических заболеваниях без метастазирования диализ может быть начат после консультации онколога и оценки прогноза основного заболевания.
Методы заместительной терапии
Гемодиализ
Гемодиализ представляет собой прерывистую процедуру, которая обычно выполняется три раза в неделю. Стандартная продолжительность сеанса составляет 4-5 часов[15]. Сокращение времени процедуры допустимо только при выраженной остаточной функции почек либо при увеличении частоты сеансов свыше трёх раз в неделю[15]. Простое увеличение площади мембраны диализатора без изменения длительности сеанса не позволяет компенсировать сокращение времени.
Площадь мембраны в типовых диализаторах составляет порядка 1-2 м2. Эффективность процедуры оценивается по показателям обеспеченного Kt/V и URR (степень снижения концентрации мочевины)[15]. Для качественного диализа необходима скорость кровотока не менее 250—300 мл/мин[10]. При гемодиафильтрации и применении высокопоточных режимов требуется скорость 350—400 мл/мин. Хорошо функционирующая артериовенозная фистула способна обеспечить кровоток 400—600 мл/мин и более, в то время как по магистралям экстракорпорального контура скорость составляет около 300 мл/мин[10].
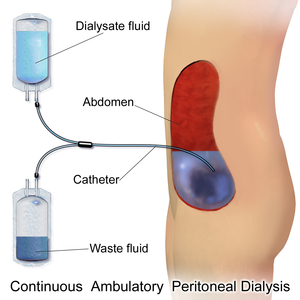
Перитонеальный диализ
При перитонеальном диализе обмены диализирующего раствора проводятся 4-5 раз в сутки, в ночное время возможны автоматические циклы[16]. Эффективность метода за единицу времени ниже по сравнению с гемодиализом, однако суммарно, за счёт непрерывности процесса, результативность сопоставима. Процедура выполняется в домашних условиях[16]. Диализирующий раствор содержит глюкозу для создания осмотического градиента[17].
Преимуществом перитонеального диализа является возможность самостоятельного выполнения процедур пациентом после соответствующего обучения[18]. Метод обеспечивает более стабильную гемодинамику по сравнению с гемодиализом, что особенно важно для пациентов с сердечно-сосудистыми заболеваниями[16]. Однако длительное применение глюкозосодержащих растворов может приводить к метаболическим нарушениям и постепенному снижению проницаемости брюшины, что требует периодической оценки эффективности метода и возможного перевода на гемодиализ.
Конвекционные методики
Гемофильтрация основана на конвективном удалении веществ через высокопроницаемую мембрану с одновременным введением замещающего раствора[19]. Гемодиафильтрация сочетает диффузионный и конвекционный механизмы переноса[7]. Эти методики применимы как при хронической почечной недостаточности, так и при остром повреждении почек[7].
Показания к гемодиафильтрации включают гемодинамическую нестабильность во время сеанса, устойчивую к иным видам профилактики, резистентное асептическое воспаление, гиперфосфатемию, не поддающуюся терапии, анемию с устойчивостью к эритропоэз-стимулирующим препаратам, профилактику либо снижение выраженности диализного амилоидоза, снижение риска сердечно-сосудистых осложнений[20]. При постдилюции замещающий раствор вводится после диализатора в венозную магистраль, при предилюции — до диализатора в артериальную, что снижает гемоконцентрацию и предпочтительно при невозможности достижения высоких скоростей кровотока либо при высоких значениях гематокрита и белка крови[20].
Специальные режимы
Раздельная ультрафильтрация применяется при необходимости удалить большой объём жидкости у пациентов с низким давлением либо нестабильной центральной гемодинамикой. Вначале проводится ультрафильтрация без диализирующего раствора, затем диализ без ультрафильтрации[12].
Профилирование натрия позволяет удалять необходимые объёмы жидкости из организма, воздействуя на осмолярность крови путём регулируемого повышения натрия в диализирующем растворе, чаще в первую половину процедуры. Существуют три основных вида профиля концентрации натрия в диализате: линейная регрессия, ступенчатая и экспоненциальная. Профиль подбирается индивидуально для достижения целевого удаления воды при гемодинамической стабильности[12].
Режим «гемодиализ в возрастающей дозе» предполагает проведение сеансов с увеличивающейся кратностью от одного до трёх раз в неделю. Показан пациентам при наличии скорости клубочковой фильтрации более 3 мл/мин, междиализной прибавке в массе менее 2,5 кг (менее 5 % сухого веса), отсутствии клинических признаков прогрессирования сердечно-сосудистых болезней, корригируемой гиперфосфатемии, контролируемом уровне калия крови, отсутствии выраженной анемии (гемоглобин выше 80 г/л), адекватном нутриционном статусе без катаболизма[12].
При недостаточной дозе диализа увеличивают время либо частоту сеансов, используют более эффективный диализатор либо высокопоточный режим при скорости кровотока не менее 300 мл/мин[21]. При сердечной недостаточности удлиняют либо учащают сеансы.
Сосудистый доступ
Для выполнения гемодиализа необходим надёжный сосудистый доступ[22]. Нативная артериовенозная фистула считается оптимальным вариантом[22]. Параметры готовности фистулы к использованию включают кровоток более 600 мл/мин, диаметр более 0,6 см, глубину залегания менее 0,6 см[23]. Фистульные иглы располагают максимально далеко друг от друга: игла для забора крови устанавливается ближе к соустью с артерией, игла для возврата крови — дистальнее по току, что позволяет минимизировать рециркуляцию. При отсутствии пригодных вен применяются синтетические протезы либо алло- и аутотрансплантаты[22].
Для временного доступа используются двухпросветные катетеры[24]. При ожидаемом использовании свыше трёх недель устанавливается туннелируемый долгосрочный катетер, который может функционировать в течение месяцев или лет[24]. Показаниями к катетеризации служат рецидивирующий тромбоз фистулы, низкое артериальное давление, малый калибр вен. После каждого сеанса диализа просветы катетера заполняются раствором гепарина в концентрации 1000-5000 ЕД/мл либо цитратом[12]. На выходные отверстия надеваются одноразовые колпачки, место выхода закрывается стерильной повязкой[12].
Проблемы с сосудистым доступом и варианты их решения
Признаками стеноза сосудистого доступа без тромбоза являются внешние изменения, рост венозного давления, снижение кровотока[25]. Показаниями к хирургическому вмешательству являются тромбозы в анамнезе, рециркуляция более 20 %[22], снижение дозы диализа.
При критическом дистальном ишемическом синдроме требуется закрытие фистулы[26]. Псевдоаневризма сосудистого протеза подлежит оперативному лечению при быстром росте, размере более двух диаметров протеза, изменениях кожного покрова либо присоединении инфекции.
Показаниями к удалению перманентного катетера служат инфекция, вызванная Staphylococcus aureus, Pseudomonas aeruginosa, Candida, Bacillus species, сохраняющаяся бактериемия спустя 72 часа адекватной терапии, осложнения (гнойный тромбофлебит, эндокардит, остеомиелит), сепсис либо шок. Кончик удалённого катетера направляют на микробиологическое исследование[27].
Антибактериальная терапия проводится в течение трёх недель, при остеомиелите — восьми недель, при инфекционном эндокардите — шести недель[28]. Новый катетер устанавливается через 48 часов либо производится обмен по проводнику при нормализации температуры в течение 48 часов и отсутствии инфекции выхода либо туннеля.
Для профилактики рецидива и усиления системной терапии применяют блокирующие растворы: цефазолин 10 мг/мл с гепарином 1 мл на 5000 ЕД, цефтазидим 10 мг/мл с гепарином 1 мл на 5000 ЕД, гентамицин 4 мг/мл с гепарином 1 мл на 5000 ЕД, ванкомицин 10 мг/мл с гепарином 1 мл на 5000 ЕД.
При подозрении на катетер-ассоциированную бактериемию берутся посевы из периферической вены и катетера, начинается эмпирическая терапия с охватом грамположительных и грамотрицательных возбудителей. При выявлении Staphylococcus aureus проводится удаление катетера и системная терапия в течение 28-42 дней. При Enterococci spp. — системная терапия в течение 7-14 дней с применением блокирующих растворов[28].
При инфицировании артериовенозной фистулы проводится антибактериальная терапия в течение 2-6 недель с коррекцией по результатам посева. При септических эмболах требуется закрытие фистулы. При генерализованной инфекции протеза тактика аналогична лечению фистулы. При отсутствии эффекта в течение 48 часов проводится удаление протеза[29].
Оборудование и параметры процедуры
Современные диализаторы представляют собой компактные устройства, в которых мембрана выполнена в виде капиллярных волокон диаметром около 200 микрометров. Внутри капилляров протекает кровь, снаружи их омывает диализирующий раствор. Таким образом, площадь мембраны 1-2 м2 упакована в цилиндр высотой около 30 см и диаметром около 5 см[10].
Современные мембраны подразделяются на низкопоточные, среднепоточные и высокопоточные в зависимости от способности пропускать средне- и высокомолекулярные соединения. Все типы мембран обладают практически одинаковой способностью удалять низкомолекулярные вещества, такие как мочевина, креатинин, мочевая кислота, избыток калия, натрия, воды[10]. В последние десятилетия установлено, что многие проявления уремического синдрома обусловлены задержкой не столько низкомолекулярных соединений, сколько средне- и высокомолекулярных веществ. Число идентифицированных соединений, ответственных за конкретные проявления уремии, превышает 100[30].
Удаляемый объём жидкости задаётся по междиализной прибавке массы тела. Аппарат управляет отрицательным давлением для достижения планового удаления жидкости. Сухой вес представляет собой целевую массу тела к концу сеанса без признаков гипер- или гипогидратации. Снижение массы до сухого веса проводят постепенно небольшими шагами[12].
Недостаточное удаление воды приводит к артериальной гипертензии и перегрузке сердца. Избыточное удаление вызывает гипотонию и судороги[12]. На конец длинного междиализного интервала приходится до 40 % всех смертей диализных пациентов. В ряде центров применяют режим проведения процедур через день по календарю, включая воскресенье.
Числовыми целями эффективности диализа служат показатель URR (доля снижения концентрации мочевины за сеанс) не менее 65-70 % и целевой выровненный Kt/V не менее 1,2 при режиме три раза в неделю. У пациентов с массой тела более 90 кг недельный Kt/V должен составлять не менее 3,6. Контроль Kt/V по пробам крови проводится ежемесячно. При аппаратном мониторинге предоставляется среднее значение за месяц[31].
Правила забора проб строго регламентированы. Проба «до» берётся из иглы до подключения экстракорпорального контура. Проба «после» забирается спустя одну минуту после снижения кровотока до 50 мл/мин при отключённой ультрафильтрации и диализате.
Качество воды и диализирующих растворов
Для программного гемодиализа необходима химически чистая вода. Допустимые уровни микробной контаминации различаются в зависимости от типа диализаторов: для низкопоточных допускается до 500 колониеобразующих единиц на миллилитр, для высокопоточных — менее 100 колониеобразующих единиц на миллилитр.
Сверхчистая диализирующая жидкость получается дополнительной фильтрацией чистой воды для гемодиализа (с содержанием колониеобразующих единиц не более 100 на миллилитр и эндотоксина не более 0,5 единиц на миллилитр) через встроенный фильтр аппарата[32][33]. Замена фильтра, его стерилизация и тестирование проводятся строго согласно инструкции производителя.
Диализирующий раствор готовится из солевых смесей и щёлочного компонента на чистой воде[33]. Состав раствора может изменяться по медицинским показаниям. Диализат с глюкозой в концентрации 5,0-5,5 ммоль/л целесообразен для всех пациентов и обязателен при сахарном диабете[15]. У больных диабетом возможно применение концентрации глюкозы до 11 ммоль/л[15]. Основным буферным компонентом служит бикарбонат натрия[33]. Предпочтительны сухие концентраты; жидкий концентрат в открытой ёмкости допускается использовать не более суток.
При высокопоточных методиках обязателен регулярный контроль эндотоксинов. При небезопасных уровнях эндотоксинов применение высокопоточных фильтров может причинять вред. Для снижения риска устанавливают дополнительные фильтры диализата и замещающего раствора[33].
Мониторинг и организация лечения
У амбулаторных пациентов общий анализ крови проводится ежемесячно[12]. Ферритин и процент насыщения трансферрина определяются раз в три месяца[34]. Базовая биохимия (включая глюкозу, креатинин, мочевину, электролиты, альбумин, билирубин, аланинаминотрансферазу, аспартатаминотрансферазу) — ежемесячно[12]. Липидограмма — два раза в год при показаниях. Коагулограмма, кислотно-щелочное состояние и другие исследования — по показаниям. Группа крови и резус-фактор определяются однократно при поступлении[35].
Инструментально выполняются рентгенография лёгких один раз в год, электрокардиография — два раза в год, эхокардиография — один раз в год, фиброгастродуоденоскопия — один раз в год. Остальные исследования проводятся по показаниям.
Программный гемодиализ при необратимой утрате функции почек проводится пожизненно. Пациенты без противопоказаний к трансплантации подлежат обследованию и направлению в трансплантационный центр для постановки в лист ожидания[36].
Междиализная прибавка массы тела не должна превышать 3 % массы тела, предпочтительны меньшие значения[37]. Контроль водного баланса осуществляется регулярными взвешиваниями.
Многие фрукты содержат более 90 % воды, каши — не менее 70 %. Эндогенная вода окисления образуется при метаболизме питательных веществ: из 100 граммов жира образуется 107 миллилитров воды, из 100 граммов белка — 41 миллилитр, из 100 граммов углеводов — 55,5 миллилитров[38]. Физическая активность увеличивает эндогенное образование воды вследствие повышения интенсивности обменных процессов.
Антикоагуляция
У стабильных пациентов применяется дозированная гепаринизация: болюс приблизительно 5000 ЕД и поддерживающая инфузия насосом[12]. Контроль осуществляется по активированному частичному тромбопластиновому времени (не более 140 секунд), активированному времени свёртывания (не более 250 секунд), времени по Ли-Уайту (не более 30 минут). Кровь для контроля берут из артериальной магистрали до введения гепарина.
Нефракционированный гепарин может вводиться непрерывно (окончание примерно за один час до окончания сеанса) либо одной-двумя разовыми дозами в начале и середине процедуры[39]. Низкомолекулярные гепарины (надропарин, эноксапарин, дальтепарин) вводятся однократно[40]. Они снижают риск кровотечений, но обладают большей продолжительностью действия, что требует более длительного поддержания повязки и может приводить к затяжным малым кровотечениям[40][41].
При высоком риске кровотечения доза низкомолекулярного гепарина уменьшается вдвое. Ориентировочная стартовая доза составляет 2500 международных единиц при массе тела менее 60 кг и 3500 международных единиц при массе тела более 60 кг[12]. При крайне высоком риске гемодиализ проводится без гепарина: короткий сеанс, скорость кровотока более 300 мл/мин, воздушные ловушки без пузырьков, смена контура при подозрении на тромбоз, промывание физиологическим раствором каждые 30 минут[7].
Вводный период
В первые сеансы диализа рекомендуется снижать уровень мочевины не более чем на 30 % от исходного значения за процедуру. В первую неделю проводятся короткие и частые процедуры с использованием профилирования натрия[12][20]. Подобная тактика позволяет предотвратить развитие дизэквилибриум-синдрома и оценить переносимость метода.
Начальные сеансы обычно проводятся с меньшей площадью диализатора и сниженной скоростью кровотока для постепенной адаптации организма к процедуре[20]. Длительность первых процедур составляет 2-3 часа с последующим увеличением до стандартных 4-5 часов[12][20]. Контроль артериального давления, частоты сердечных сокращений и общего состояния осуществляется особенно тщательно. Пациентам с высокими исходными значениями мочевины и креатинина может потребоваться проведение ежедневных сеансов в течение первой недели для безопасного достижения целевых показателей.
При гипертоническом кризе у диализных пациентов применяются специальные протоколы терапии с регламентированными дозировками препаратов (урапидил, глицерил тринитрат) и скоростями введения[12]. Выбор конкретного препарата зависит от уровня артериального давления, наличия сопутствующих осложнений и индивидуальной переносимости.
Осложнения и их профилактика
Гипотония и судороги возникают при слишком быстром удалении воды и натрия, приводящем к падению объёма циркулирующей крови. Чаще развиваются при достижении массы тела ниже сухого веса. Профилактика включает уменьшение междиализной прибавки массы (в том числе ограничение соли), профилирование натрия и ультрафильтрации, удлинение сеанса[12][15]. Возможно применение вспомогательных средств: карнитин, габапентин, витамин Е.
При судорогах применяются позиция Тренделенбурга, уменьшение ультрафильтрации, повышение натрия в диализате, внутривенное введение 100—150 мл 0,9 % раствора хлорида натрия либо гипертонического раствора хлорида натрия или глюкозы 10-20 %, коррекция гипокальциемии введением 40-60 мл 10 % глюконата кальция, применение диализата на основе глюкозы[12].
При тошноте и рвоте проводятся мониторирование состояния, уменьшение ультрафильтрации, введение метоклопрамида 0,5 мл 0,5 % внутривенно, снижение кровотока в первый час, профилирование ультрафильтрации, лечение сопутствующей гастродуоденальной патологии[12]. При боли и стенокардии осуществляются нормализация артериального давления, снижение скорости кровотока и ультрафильтрации, оксигенотерапия, профилактический приём антиангинальных средств[12].
Выраженность дизэквилибриума уменьшается при удлинении либо учащении сеансов[42]. Чувствительность к дизэквилибриуму снижают коррекцией анемии (целевой гемоглобин 110—120 г/л) и белкового статуса (альбумин не менее 40 г/л)[10].
Примечания
- ↑ Hechanova L. A. Диализ. Справочник MSD.
- ↑ Яковлев В. А. Грегем, Томас. Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890–1907.
- ↑ Abel J. J., Rowntree L. G., Turner B. B. On the removal of diffusible substances from the circulating blood of living animals by dialysis (англ.) // Journal of Pharmacology and Experimental Therapeutics. — 1914. — Vol. 5, no. 3. — P. 75–316.
- ↑ 4,0 4,1 Gottschalk C. W., Fellner S. K. History of the Science of Dialysis // American Journal of Nephrology. — 1997. — P. 289–298.
- ↑ 5,0 5,1 5,2 5,3 5,4 Sharma N., Khav E., Elahmadi A., et al. Dr. Willem Kolff: The Father of the Artificial Kidney (англ.) // Cureus. — 2024. — September (vol. 16).
- ↑ 6,0 6,1 Blagg C. R. The Early History of Dialysis for Chronic Renal Failure in the United States: A View From Seattle (англ.) // American Journal of Kidney Diseases. — 2007. — Vol. 49, no. 3. — P. 482–496.
- ↑ 7,0 7,1 7,2 7,3 7,4 Пушкина А. В., Анашкин В. А., Шило В. Ю., Шутов Е. В., Ушакова А. И., Котенко О. Н. Методическое руководство процедуры гемодиализа/гемодиафильтрации // Клиническая нефрология. — 2018. — № 4. — С. 6–19.
- ↑ Aimee Hechanova L. Гемодиализ. Справочник MSD.
- ↑ Гемолактол (раствор для гемодиализа). Инструкция по медицинскому применению. Энциклопедия РЛС (2019).
- ↑ 10,0 10,1 10,2 10,3 10,4 10,5 10,6 Жизнь с хроническим заболеванием. Гемодиализ (брошюра для пациентов) // nephro.ru.
- ↑ 11,0 11,1 Острое повреждение почек (ОПП). Клинические рекомендации (2020).
- ↑ 12,00 12,01 12,02 12,03 12,04 12,05 12,06 12,07 12,08 12,09 12,10 12,11 12,12 12,13 12,14 12,15 12,16 12,17 12,18 12,19 12,20 12,21 Клинический протокол «Диагностика и лечение пациентов (взрослое население) с хронической болезнью почек 5 стадии методом программного гемодиализа». Министерство здравоохранения Республики Беларусь (2021).
- ↑ Cooper B. A., Branley P., Bulfone L., et al. A Randomized, Controlled Trial of Early versus Late Initiation of Dialysis // New England Journal of Medicine. — 2010. — Vol. 363, № 7. — P. 609–619.
- ↑ Федеральный закон от 21.11.2011 № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации».
- ↑ 15,0 15,1 15,2 15,3 15,4 15,5 Клинические рекомендации «Лечение пациентов с хронической болезнью почек 5 стадии (ХБП 5) методами гемодиализа и гемодиафильтрации. Министерство здравоохранения Российской Федерации (2016).
- ↑ 16,0 16,1 16,2 Hechanova L. A. Перитонеальный диализ. Справочник MSD.
- ↑ Батурина Г. С., Каткова Л. Е., Солёнов Е. И. Влияние глюкозы на транспорт воды в клетках перитонеального мезотелия крыс // Российский физиологический журнал им. И. М. Сеченова. — 2023. — Т. 109, № 3. — С. 366–374.
- ↑ Li P. K.-T., Chow K. M., Cho Y. Рекомендации ISPD: обновление 2022 года по профилактике и лечению диализного перитонита // Клиническая нефрология. — 2022. — № 4.
- ↑ Бояринов Г. А., Зубеев П. С., Мокров К. В., Военнов О. В. Гемофильтрация у пациентов с тяжелым острым панкреатитом (обзор) // Cовременные технологии в медицине. — 2020. — Т. 12, № 1.
- ↑ 20,0 20,1 20,2 20,3 20,4 Хроническая болезнь почек стадии 4-5D и принципы нутриционной поддержки. Клинические протоколы КР 2024 (Кыргызстан).
- ↑ Режим лечения ГД. Российское диализное общество (2017).
- ↑ 22,0 22,1 22,2 22,3 Калинин Р. Е., Сучков И. А., Егоров А. А., Крылов А. А. Сосудистый доступ для гемодиализа: учебное пособие. — М.: ГОЭТАР-Медиа, 2021. — С. 20–21.
- ↑ Ряснянский В. Ю. Сосудистый доступ для гемодиализа — современные представления о безопасности и эффективности (презентация) (2016).
- ↑ 24,0 24,1 Национальная Ассоциация нефрологов. Хроническая болезнь почек (ХБП). Клинические рекомендации (Россия) (2024).
- ↑ KDOQI clinical practice guideline for vascular access: 2018 (англ.). National kidney Foundation (2019).
- ↑ Schmidli J., Widmer M. K., Basile C. et al. Editor’s Choice e Vascular Access: 2018 Clinical Practice Guidelines of the European Society for Vascular Surgery (ESVS) (англ.) // Eur. J. Vasc. Endovasc. Surg.. — 2018. — Vol. 55. — P. 757–818.
- ↑ Mermel L. A., Allon M., Bouza E., et al. Mermel L. A., Allon M., Bouza E., et al. (англ.) // Clinical Infectious Diseases. — 2009. — Vol. 49, no. 1. — P. 1–45.
- ↑ 28,0 28,1 Бережанский Б. В., Жевнерев А. А. Катетер-ассоциированные инфекции кровотока // Клиническая микробиология и антимикробная химиотерапия. — 2006. — Т. 8, № 2. — С. 130–142.
- ↑ Tordoir J., et al. 12. Management of the infected vascular access (англ.).
- ↑ Лукичёв Б. Г., Подгаецкая О. Ю., Карунная А. В., Румянцев А. Ш. Индоксил сульфат при хронической болезни почек // Нефрология. — 2014. — № 1.
- ↑ KDOQI Clinical Practice Guideline for Hemodialysis Adequacy: 2015 Update // National Kidney Foundation. — 2015. — P. 18.
- ↑ Canaud B., Lertdumrongluk. Ultrapure Dialysis Fluid: A New Standard for Contemporary Hemodialysis (англ.) // Nephro-Urology Monthly. — 2012. — Vol. 4, no. 3. — P. 519–523.
- ↑ 33,0 33,1 33,2 33,3 ГОСТР ИСО 23500-5-2021. Подготовка жидкостей для гемодиализа и сопутствующей терапии и менеджмент качества. — М.: Российский институт стандартизации, 2021. — С. 5–6. — 20 с.
- ↑ Паровичникова Е. Н., Варфоломеева С. Р., Шилов Е. М. Анемия при хронической болезни почек // Клинические рекомендации. — 2024.
- ↑ Приказ от 25.11.2002 № 363 «Об утверждении Инструкции по применению компонентов и препаратов крови». Министерство здравоохранения РФ.
- ↑ Axelrod, D. A., Foster B. J., et al. KDIGO Clinical Practice Guideline on the Evaluation and Management of Candidates for Kidney Transplantation (англ.) // Transplantation. — 2020. — P. 104.
- ↑ Питание при лечении гемодиализом. Нефроцентр ХМАО.
- ↑ Ламажапова Г. П. Физиология питания. Учебное пособие. — М.: Изд-во «МН», 2016. — 146 с. — ISBN 978-5-9908912-4-1.
- ↑ Милованов Ю. С., Добросмыслов И. А., Милованова С. Ю. Тромбопрофилактика при гемодиализе // Consilium Medicum. — 2017. — № 7–2.
- ↑ 40,0 40,1 Шило В. Ю., и др. Низкомолекулярные гепарины у больных на программном гемодиализе: опыт применения фраксипарина // Нефрология и диализ. — 2006. — Т. 8, № 2.
- ↑ Lazrak H. H., René É., Elftouh N., Leblanc M., Lafrance J. P. Safety of low-molecular-weight heparin compared to unfractionated heparin in hemodialysis: a systematic review and meta-analysi // BMC Nephrol. — 2017. — Январь (№ 18). — С. 187. — doi:10.1186/s12882-017-0596-4. — PMID 28592259.
- ↑ Habas E., Habas A., Farfar K., Habas E., Rayani A. Disequilibrium syndrome in hemodialysis patients; narrative review (англ.) // Turkish Journal of Nephrology. — 2025. — Vol. 34, no. 2.